五虎汤抑制STAT3通路并调节哮喘小鼠Th2/Th17免疫平衡*
丁 伊,王孟清,罗银河△,胡 燕,江智豪,张 鑫,李 英,罗 菁,丁 焕,邓羿駃
(1湖南中医药大学,湖南长沙410208;2湖南中医药大学第一附属医院,湖南长沙410007;3深圳市南山区蛇口人民医院,广东深圳154100;4长沙医学院,湖南长沙410219)
支气管哮喘(简称哮喘)是一种气道异质性疾病,其特征在于气道炎症和支气管高反应性,导致可逆性气流受限[1]。呼吸道合胞病毒(respiratory syncytial virus,RSV)是婴幼儿呼吸道感染最常见的病原体[2]。哮喘的发病机制复杂多样,涉及各种免疫细胞和促炎细胞因子[3]。Th17细胞是近年来发现的不同于Th1和Th2的T淋巴细胞亚群,参与了哮喘的发生与发展[4]。越来越多研究认为Th2/Th17免疫失衡在RSV诱发哮喘的发病机理和炎症中起关键作用[5]。信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路的激活参与Th2和Th17细胞因子的产生,与哮喘的发生关系密切[6]。相关研究已证实采用小分子C188-9可以通过拮抗小鼠STAT3信号通路抑制Th2/Th17细胞因子比例水平改善哮喘小鼠炎症反应[7]。
目前临床通常认为吸入皮质类固醇可以很好地控制哮喘,但长期使用会引起各种副作用,中药已被证明对哮喘有治疗作用[8-10]。传统古方五虎汤(Wuhu decoction)具有清泻肺热、止咳平喘之功效。前期临床研究表明,五虎汤能明显减少RSV毛细支气管炎发展为典型哮喘[11];动物实验表明,五虎汤抑制RSV复制,降低哮喘气道高反应性,改善气道炎症及气道重塑[12-13]。但关于五虎汤对RSV诱发的哮喘小鼠Th2/Th17免疫平衡机制的研究鲜见报道。因此,本研究构建RSV复合卵清蛋白(ovalbumin,OVA)哮喘小鼠模型,观察STAT3信号通路对RSV诱发的哮喘小鼠Th2/Th17的免疫调节作用及五虎汤在其中的干预作用,为阐明五虎汤缓解RSV诱发的哮喘气道免疫炎症提供新的理论依据。
材料和方法
1 材料
1.1 实验动物SPF级雌性BALB/c小鼠60只,4~6周龄,15~18 g,购自湖南斯莱克景达实验动物有限公司,动物资格证书编号为SCXK(湘)2019-0004。实验方案经湖南中医药大学第一附属医院动物实验伦理委员会批准,伦理审批号为ZYFY20200712。
1.2 药物与试剂五虎汤由麻黄(不去节)2.4 g、杏仁(去尖皮)6.0 g、生石膏9.0 g、生甘草2.4 g和细茶叶4.8 g组成,每瓶100 mL,含生药24.6 g,由湖南中医药大学第一附属医院药剂科制备。RSV Long株及人喉癌上皮Hep-2细胞(武汉大学医学部病毒学研究所);鸡OVA(Solarbio,批号9006-59-1);STAT3抑制剂Stattic(MCE,批号HY-13818);氯化乙酰胆碱(Selleck,批号2260-50-6);白细胞介素4(interleukin-4,IL-4)、IL-5、IL-17A和IL-23 ELISA试剂盒(上海晶天生物科技有限公司);抗STAT3抗体(批号ab119352)和抗p-STAT3抗体(批号ab76315)均购自Abcam。
1.3 主要仪器超声雾化器(南京道芬电子有限公司,型号S888E);DHX-50小动物呼吸机及气道阻力和肺顺应性分析软件(BUXCO);透射电子显微镜(日立高新技术公司,型号HT7700);台式离心机(金坛市大地自动化仪器厂,型号12008007)。
2 实验方法
2.1 动物造模及分组SPF级雌性BALB/c小鼠60只,随机分20只为正常组,其余40只为模型组。参照前期文献建立哮喘小鼠模型[12],实验前2 d模型组每只小鼠鼻腔滴入RSV(0.05 mL)并腹腔注射0.25 mL 1%鸡OVA,正常组予以等体积Hep-2细胞滴鼻,同时皮下注射等体积生理盐水。从第9天起模型组小鼠予以1%鸡OVA隔天雾化1次,每次30 min,正常组予同样体积生理盐水雾化吸入,持续2周。雾化结束后从正常组和模型组小鼠中分别随机抽取10只进行气道反应性测定,观察到造模后小鼠气道反应性显著高于正常组并出现气短、喘息等行为学表现提示造模成功。将正常组及造模成功后的小鼠随机分成4组,每组10只,即正常(normal)组、模型(model)组、五虎汤(Wuhu decoction)组和STAT3抑制剂(Stattic)组。
2.2 给药按临床量效关系观察结果,拟定五虎汤组灌胃剂量为3.2 g/kg,同时腹腔注射0.9%生理盐水(10 mL/kg);Stattic组腹腔注射Stattic(3.75 mg/kg),并灌胃等容积生理盐水;正常组及模型组均灌胃并腹腔注射相同体积生理盐水,每日1次,连续2周。
2.3 气道反应性的测定小鼠末次给药后24 h,麻醉、行气管插管后,把小鼠放入体描箱中,连接呼吸机,调整呼吸机参数,频率为75 min-1,潮气量为8 mL/kg时记录初始的气道压力、流速及潮气量变化,待小鼠气道压力平稳后,雾化吸入0.1 mL不同剂量(0、6.25、12.5、25和50μg/kg)的乙酰胆碱,每次吸入乙酰胆碱后,收集吸入后5 s~1 min的数据,并计算最大肺阻力(lung resistance,RL)。
2.4 组织学检查肺组织由多聚甲醛固定,常规石蜡包埋,切片,进行HE染色,梯度脱水,透明切片滴上树胶,盖上盖玻片并进行镜检。
2.5 血清中IL-4、IL-5、IL-17A和IL-23含量的测定根据ELISA试剂盒说明书的步骤,依次检测血清中IL-4、IL-5、IL-17A和IL-23的含量,通过标准曲线计算其浓度。
2.6 肺组织中STAT3和p-STAT3蛋白水平的测定
2.6.1 Western blot法在肺组织中提取总蛋白,BAC法进行蛋白定量,每组取50μg的总蛋白,按1∶4加入SDS上样缓冲液,加热5 min后加入样品,进行电泳、转膜,封闭1 h,分别加入兔抗STAT3和抗p-STAT3多克隆抗体及内参照抗β-actin抗体孵育过夜,TBST洗涤10 min×3次,加入Ⅱ抗,孵育1 h,再用TBST洗涤10 min×3次。扫描后用Quantity One灰度分析软件,相应目的蛋白表达量为目的蛋白与β-actin条带灰度的比值。
2.6.2 免疫组化法石蜡切片脱蜡后水化,热修复抗原,加入1%高碘酸,室温10 min以灭活内源性酶,PBS冲洗3 min×3次,滴加非免疫正常山羊血清100μL,室温孵育60 min后移液枪吸去封闭液,分别滴加抗STAT3及抗p-STAT3的Ⅰ抗,4℃孵育过夜,使用PBST充分浸洗5 min×5次,辣根过氧化物酶标记聚合物,室温孵育30 min,PBST充分浸洗5 min×5次,3,3′-二甲基联苯胺(3,3′-diaminobenzidine,DAB)显色30 s,蒸馏水洗涤终止显色,苏木素复染,中性树胶封片,显微镜下观察阳性细胞并采用Image-Pro Plus 6.0专业图像分析进行阳性细胞计数。
3 统计学处理
应用SPSS 25.0进行数据统计分析。计量资料采用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析(one-way ANOVA),两两比较采用Boferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 五虎汤对哮喘模型小鼠气道反应性的影响
乙酰胆碱浓度在6.25、12.5、25和50μg/kg时,与正常组比较,模型组小鼠RL显著上升(P<0.01);与模型组比较,五虎汤组及Stattic组的RL则显著下降(P<0.01),见表1。
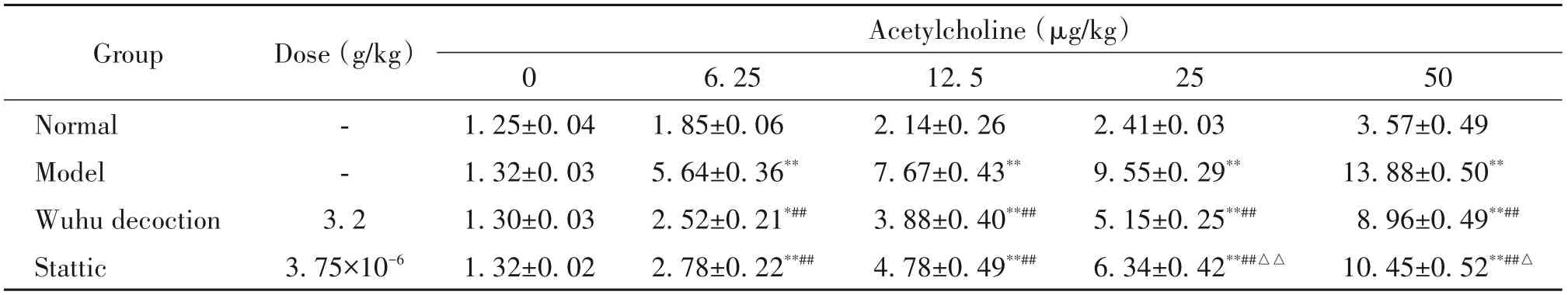
表1 各组小鼠在不同剂量乙酰胆碱激发下的气道反应性Table 1.Effects of different concentrations of acetylcholine on airway responsiveness(lung resistance,R L)in mice(cmH2O·s/mL.Mean±SD.n=10)
2 五虎汤对哮喘模型小鼠肺组织病理学的影响
HE染色结果显示,正常组小鼠肺组织周围无明显炎症细胞浸润,支气管管腔规则,气道黏膜上皮细胞完整;模型组小鼠支气管管腔狭窄,毛细血管水肿,周围可见大量炎症细胞浸润;五虎汤组和Stattic组上述肺组织损伤情况均明显减轻,见图1。
3 五虎汤对哮喘模型小鼠血清中IL-4、IL-5、IL-17A和IL-23含量的影响
ELISA结果显示,与正常组比较,模型组小鼠血清中IL-4、IL-5、IL-17A和IL-23的含量显著上升(P<0.01);与模型组相比,五虎汤和Stattic灌胃处理后小鼠血清中IL-4、IL-5、IL-17A和IL-23的含量显著降低(P<0.01),见图2。
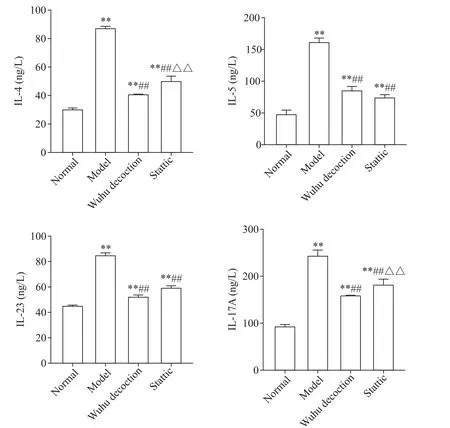
Figure 2.The serum levels of inflammatory factors in mice of different groups.Mean±SD.n=10.**P<0.01 vs normal group;##P<0.01 vs model group;△△P<0.01 vs Wuhu decoction group.图2 各组小鼠血清中炎症因子含量的比较
4 五虎汤对哮喘模型小鼠肺组织中STAT3和p-STAT3蛋白水平的影响
Western blot结果显示,与正常组比较,模型组小鼠肺组织中p-STAT3/STAT3比值显著升高(P<0.01);与模型组比较,五虎汤组和Stattic组小鼠STAT3和p-STAT3蛋白水平均显著下降(P<0.01),见图3。
免疫组化法结果显示,正常组小鼠几乎无STAT3及p-STAT3表达;模型组小鼠中STAT3表达呈棕黄色颗粒着色,表达较正常组增加(P<0.01),p-STAT3的变化特点与STAT3一致(P<0.01);与模型组比较,五虎汤组和Stattic组STAT3及p-STAT3蛋白水平均显著降低(P<0.01),见图4。
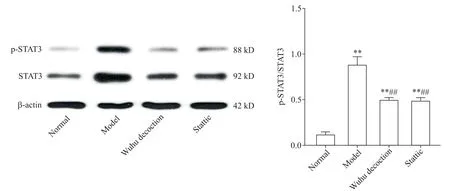
Figure 3.The protein levels of p-STAT3/STAT3 in mouse lung tissues from different groups were determined by Western blot.Mean±SD.n=10.**P<0.01 vs normal group;##P<0.01 vs model group.图3 Western blot检测各组小鼠肺组织p-STAT3/STAT3蛋白水平
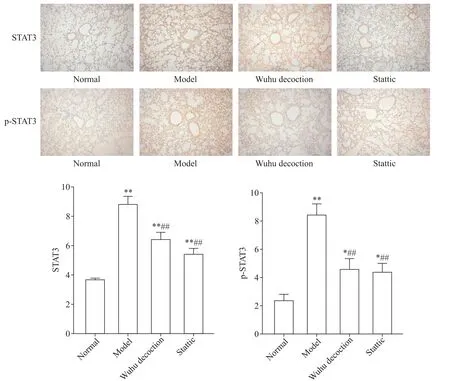
Figure 4.The results of immunohistochemistry for STAT3 and p-STAT3 in mouse lung tissues fromeach group(×200),and the quantitative analysis(C).Mean±SD.n=10.*P<0.05,**P<0.01 vs normal group;##P<0.01 vs model group.图4 免疫组化检测各组小鼠肺组织中STAT3和p-STAT3蛋白水平
讨 论
哮喘是复杂的宿主与环境相互作用的结果,涉及免疫反应的多种表型特征。但研究表明,大多数哮喘表型与致病性Th2和Th17细胞有关[14],Th17可以增强Th2介导的嗜酸性粒细胞哮喘的炎症反应[15],Th2/Th17可能共同参与哮喘的发病机制。STAT3信号通路是炎症细胞因子重要信号转导通路之一,可经细胞因子和氧化刺激等激活后参与调控细胞增殖、分化及免疫调节等病理生理过程[16-17]。因此,各种细胞因子可以通过STAT3信号通路传递信息,促进炎症反应,参与哮喘发生[18]。
RSV诱导气道慢性炎症发生时,Th2细胞的主要细胞因子IL-4和IL-5大量分泌,刺激B淋巴细胞,促进炎症趋化因子的形成,从而加剧变态反应过程[19]。Th17细胞特异性产生的IL-17A可致肺组织病理学改变,出现支气管管腔狭窄及气道上皮细胞损伤等炎症反应[20]。IL-23是Th17细胞的重要存活因子,可诱导初始CD4+T细胞分化为Th17细胞[21]。STAT3是STAT3信号通路的关键因子,参与细胞内炎症反应的发生[22]。本研究结果显示,RSV诱发的哮喘模型小鼠出现肺组织损伤,血清中IL-4、IL-5、IL-17A和IL-23的含量显著上升,引起Th2/Th17免疫失衡,加重哮喘症状,同时肺组织中STAT3及p-STAT3的蛋白水平显著升高,提示哮喘小鼠中STAT3蛋白的过度表达和持续激活。本研究以治哮名方五虎汤和STAT3抑制剂Stattic进行灌胃干预处理,观察其对Th2/Th17免疫平衡和STAT3通路的影响,结果发现五虎汤和Stattic均可减轻RSV诱发的哮喘小鼠肺组织病理学改变,显著减少炎症因子的释放,降低肺组织中STAT3及p-STAT3的蛋白水平,进而纠正Th2/Th17失衡,减轻免疫炎症。
综上所述,本研究成功建立了RSV诱导的哮喘小鼠模型;五虎汤可能通过抑制STAT3通路,调节Th2/Th17免疫平衡,减少炎症因子的分泌,进而抑制免疫炎症。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

