经皮穴位电刺激不同时间对利多卡因致大鼠心脏毒性的影响
张 静,李建东
(1.中国人民解放军陆军第八十一集团军医院麻醉科,河北 张家口 075000;2.河北北方学院基础医学院生理教研室,河北 张家口 075000)
利多卡因是一种氨基酰胺型局部麻醉剂,具有抗炎、镇痛和抗痛觉过敏的作用,但其对心血管系统和中枢神经系统有一定毒性,可导致脊髓神经元细胞凋亡[1]、神经毒副反应[2],对心脏的毒性表现为心动过缓、房室或室内传导阻滞和室性心律失常,导致循环衰竭,甚至出现心脏骤停[3]。经皮穴位电刺激(transcutaneous electrical acupoint stimulation,TAES)是一种将经皮电刺激与穴位疗法相结合用于针灸实践改进的治疗方法,入侵性低、安全且技术简单。TEAS具有镇痛作用,可以促进麻醉效果,并减少麻醉药物用药剂量[4-5]。方剑乔[6]等研究发现,TAES能改善心肌缺血状况和心功能恢复能力,减少心肌细胞凋亡,从而对心肌起到保护作用。我们以大鼠为研究对象,分析不同TEAS处理时间对利多卡因致大鼠心脏毒性的影响,探讨TEAS对局麻药中毒心脏保护的可能机制,现报道如下。
1 材料与方法
1.1 动物与分组
健康雄性SD大鼠50只,体质量200~250 g,随机分为5组各10只:空白组、模型组、TEAS Ⅰ组、TEAS Ⅱ组、TEAS Ⅲ组。
1.2 实验仪器与试剂
LDH酶联免疫检测试剂盒、CK-MB酶联免疫检测试剂盒、T-SOD活力检测试剂盒、MDA含量检测试剂盒、NO含量检测试剂盒和NOS活性测定试剂盒均购自南京建成生物工程研究所,盐酸利多卡因注射液(上海朝晖药业有限公司,H31021072);钙离子荧光探针Fluo-3AM(碧云天),LH202H型韩氏穴位神经刺激仪,SpectraMax M4酶标仪。
1.3 方法
用经皮电刺激仪持续做经皮穴位电刺激,穴位选用双侧“内关”“合谷”“足三里”“三阴交”,同侧穴位连接电极,刺激强度6~8 mA,频率5 Hz,TEAS Ⅰ组刺激20 min,TEAS Ⅱ组刺激40 min,TEAS Ⅲ组刺激60 min。电刺激后,大鼠在腹腔注射戊巴比妥钠40 mg·kg-1麻醉下,仰卧位固定于动物台上,用3根针灸针插入大鼠双前肢及左后肢皮下,监测Ⅱ导联ECG。暴露左侧股静脉,置入24 G套管针,用于利多卡因给药;暴露右侧颈动脉,置入24 G套管针用于监测动脉血压。空白组泵注生理盐水,其余4组大鼠股静脉匀速泵注0.75%利多卡因2 mg·(kg·min)-1。所有大鼠持续泵注6 min后开腹,分离出腹主动脉,通过腹主动脉采血保存待测。在取血后迅速结扎主动脉干,并沿结扎处心脏一侧将心脏剪开,分离出左心室迅速置于-80 ℃冰箱冷藏。
称取冷冻的心脏组织,按质量(g)∶容积(mL)=1/9的比例加入生理盐水制成10%的匀浆液,以3 500 rpm离心10min,上清液即为10%组织匀浆,用前用生理盐水按1/9的比例稀释成1%匀浆液。
将心肌细胞以10 000个细胞/皿的密度接种在35 mm共聚焦培养皿中。每次处理后,用PBS洗涤细胞三次,然后在37 ℃下用10 μmol·L-1Fluo-3/AM((Fluo-3/AM∶激发/发射=488/525 nm)孵育30 min。然后弃去溶液,PBS完全洗掉细胞外无负载的游离Fluo-3/AM,共聚焦激光扫描显微镜扫描图像,测量荧光强度以测定心肌细胞Ca2+含量。
持续监测MAP和HR变化,严格按照试剂盒说明书测定泵注利多卡因6 min后心肌组织乳酸脱氢酶(LDH)和肌酸激酶同工酶(CK-MB)活性、总超氧化物歧化酶(T-SOD)活力、丙二醛(MDA)含量、一氧化氮(NO)含量和一氧化氮合酶(NOS)活性、Ca2+含量的变化。
1.4 统计学方法
2 结 果
2.1 血压和心率变化
各组大鼠给药前MAP与HR相比差异无统计学意义(P>0.05);泵注利多卡因4、6 min后,模型组、TEAS Ⅰ组、TEAS Ⅱ组和TEAS Ⅲ组与给药前比较,MAP与HR差异有统计学意义(P<0.05);与模型组比较,各TEAS组注射利多卡因4、6 min后MAP与HR均显著升高(P<0.05),且与时间呈正相关;注射利多卡因4、6 min后各TEAS组之间差异有统计学意义(P<0.05)(表1)。

表1 各组大鼠注射利多卡因后不同时间MAP、HR变化比较
2.2 LDH、CK-MB活性变化
泵注利多卡因6 min后,与空白组比较,模型组、TEAS Ⅰ组、TEAS Ⅱ组和TEAS Ⅲ组大鼠心肌组织中LDH和CK-MB活性显著升高(P<0.05)。与模型组比较,TEAS可以显著降低LDH和CK-MB的活性(P<0.05),且TEAS Ⅲ组和TEAS Ⅰ组之间差异有统计学意义(P<0.05);TEAS Ⅱ组与TEAS Ⅰ和TEAS Ⅲ组之间差异无统计学意义(P>0.05)(图1)。

注:与空白组比较aP<0.05;与模型组比较bP<0.05;与TEASⅠ组比较cP<0.05。
2.3 T-SOD活力和MDA含量的变化
泵注利多卡因6 min后,与空白组比较,模型组、TEAS Ⅰ组、TEAS Ⅱ组和TEAS Ⅲ组大鼠心肌组织中T-SOD活力显著降低,MDA含量显著升高,差异有统计学意义(P<0.05);与模型组比较,TEAS可显著升高T-SOD活力,降低MDA含量(P<0.05);各TEAS组之间差异无统计学意义(P>0.05)(图2)。

注:与空白组比较aP<0.05;与模型组比较bP<0.05。
2.4 NO含量和NOS活性的变化
泵注利多卡因6 min后,与空白组相比,模型组、TEAS Ⅰ组、TEAS Ⅱ组和TEAS Ⅲ组大鼠NO含量和NOS活性降低,差异有统计学意义(P<0.05);与模型组相比,TEAS可显著升高NO含量和NOS活性,差异有统计学意义(P<0.05),且与时间呈正相关;各TEAS组间NO含量差异有统计学意义(P<0.05),而NOS活性差异无统计学意义(P>0.05)(图3)。

注:与空白组比较aP<0.05;与模型组比较bP<0.05;与TEASⅠ组比较cP<0.05。
2.5 心肌细胞中Ca2+含量的变化
泵注利多卡因6 min后,与空白组比较,模型组、TEAS Ⅰ组、TEAS Ⅱ组和TEAS Ⅲ组大鼠心肌细胞中的Ca2+含量明显增加(P<0.05);与模型组比较,TEAS可显著降低Ca2+含量(P<0.05);随着刺激时间的增加,Ca2+荧光强度逐渐减弱,且各TEAS组间差异有统计学意义(P<0.05)(图4~5)。

A.空白组;B.模型组;C.TEASⅠ组;D.TEASⅡ组;E.TEASⅢ组。
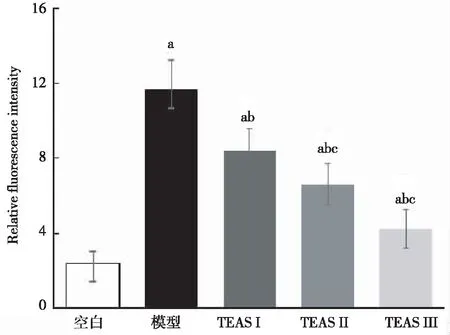
注:与空白组比较aP<0.05;与模型组比较bP<0.05;与TEASⅠ组比较cP<0.05。
3 讨 论
利多卡因属酰胺类局麻药,当药物超过机体耐药量或注射到血管或血液丰富的区域被吸收过快会引起中毒,主要是对心血管系统的毒性。目前局麻药引起的中毒通过肾上腺素[7]、脂肪乳[8]、胰岛素[9]等药物治疗。有研究报道电针刺激内关穴可减少细胞凋亡并降低自噬水平,降低心肌梗死面积实现对心肌缺血-再灌注大鼠的保护效应[10]。方剑乔等研究发现,经皮穴位电刺激双侧“曲池”“合谷”“足三里”“三阴交”可能通过提高心肌抗氧自由基能力减少LDH、CK-MB释放,从而达到心肌保护作用[11]。LDH、CK-MB、NO、NOS是标志再灌注损伤/心肌缺血的重要诊断指标[12-13],SOD、MDA是机体损伤后反映氧自由基水平的可靠指标[14]。本研究通过20、40和60 min电刺激“内关”、“合谷”、“足三里”和“三阴交”4个穴位,探讨了TEAS累加效应对利多卡因所致心脏毒性的影响,并通过测定LDH、CK-MB、SOD、MDA等指标探讨可能的机制。
LDH可以判断心肌损伤程度,CK-MB在临床上主要用于诊断心梗。心肌受损后,细胞膜通透性增加,心肌细胞中LDH和CK-MB释放入血,致含量急剧上升[15]。本研究显示注射利多卡因后大鼠心肌组织中LDH和CK-MB活性显著升高,而TEAS可以显著降低两者的活性,表明TEAS可减轻心肌损伤。
心肌缺血时,氧自由基(OFR)生成增加,形成脂质过氧化物,清除氧自由基的SOD活性下降,导致氧自由基堆积,引起心肌细胞内一系列改变,最终导致心肌缺血[16]。MDA是体内脂质过氧化产物,其含量能较好地反映组织脂质过氧化程度,间接反映细胞损伤程度[17]。本研究中注射利多卡因后大鼠心肌组织中T-SOD活力显著降低,MDA含量显著升高,TEAS可显著升高T-SOD活力,降低MDA含量。表明TEAS可通过加强自由基代谢、增强心肌抗氧化能力而保护心脏。
NO是心血管系统中一种重要的生物活性物质,其作用是保护血管内皮功能、抗氧化和抑制中性粒细胞浸润[18]。韩宇博等[19]研究表明提高血清中NOS活性,增加NO含量可对缺血的心肌细胞起保护作用。Ca2+可将心脏收缩周期中肌肉收缩和松弛与线粒体能量的产生联系起来[20],有研究表明,细胞内Ca2+水平可调节钙调神经磷酸酶的激活[21],而持续的钙调神经磷酸酶激活可促进心脏结构和功能的损伤[22]。本研究中,注射利多卡因后心肌细胞中Ca2+含量明显增加,而随着TEAS时间延长,Ca2+荧光强度逐渐减弱,表明TEAS可抑制利多卡因导致的大鼠心肌组织Ca2+水平升高,增加NOS活性,促进NO释放而达到对心肌的保护作用。
综上,本研究结果表明TEAS可降低LDH和CK-MB活性,减轻心肌损伤;升高T-SOD活力,降低MDA含量,加强自由基代谢,增强心肌抗氧化能力;抑制Ca2+水平升高,增加NOS活性,促使NO释放,进而达到对心脏的保护作用。

