感染对肝硬化食管胃底静脉曲张破裂出血患者预后的影响
秦榕 陈思瑾 黄芸 张志波 姜华 黄维康 王辉
肝硬化是临床上常见的慢性肝病,晚期由于合并各种并发症,病死率较高。研究表明,有35%~66%的肝硬化患者在消化道出血早期的5~7天并发细菌感染[1],出现感染会导致病情恶化,增加治疗难度,严重影响患者预后。我们通过分析感染对肝硬化食管胃底静脉曲张破裂出血(GEVB)患者预后的影响,以期为指导临床治疗和改善患者预后提供依据。
对象与方法
1.对象:2016年5月~2019年5月我院收治的随访信息完整的肝硬化GEVB患者256例,男162例,女94例,年龄24~83岁,平均年龄(56.41±14.32)岁。肝硬化诊断标准[2]:(1)有慢性病毒性肝炎及长期饮酒等病史;(2)肝脏质地坚硬且有结节感;(3)临床表现包括门脉高压和肝功能减退;(4)有肝功能异常。所有患者通过胃镜检查明确有食管或胃底静脉曲张,当胃镜检查有以下情况之一时,即诊断为食管胃底静脉曲张出血[3]:(1)静脉曲张有活动性出血;(2)曲张静脉表面有“白色血栓头”;(3)曲张静脉上覆血凝块或无其他潜在出血原因的静脉曲张。满足以下任意1项标准诊断为感染:(1)血白细胞及中性粒细胞升高;(2)降钙素原升高;(3)病原学检测发现病原微生物;(4)影像学检查发现阳性病灶。排除有严重的心、脑、肺等器质性病变或恶性肿瘤的患者。本研究通过我院伦理委员会审核批准。
2.方法:通过查阅病历资料收集患者信息,包括性别、年龄、肝硬化病因、病史(糖尿病、高血压)、合并症(感染、肝性脑病、腹腔积液、肾功能衰竭)、实验室检查指标[白蛋白(Alb)、总胆红素(TBil)、血肌酐、国际标准化比值(INR)]、内镜治疗情况、β受体阻滞剂使用情况、Child-Pugh分级,并计算终末期肝病模型(MELD)评分。Child-Pugh分级包含肝性脑病、血清胆红素、腹腔积液、凝血酶原时间及血清白蛋白浓度5项指标,每个指标根据不同情况按1、2、3分记分后相加,总分最低为5分,最高为15分,再根据评分结果将肝功能分为A、B、C 3级,得分越高,提示肝脏储备功能越差。MELD评分=3.8×ln[TBil(mg/dl)]+11.2×ln(INR)+9.6×ln[血肌酐(mg/dl)]+6.4×病因(胆汁性或酒精性为0,其他为1)[4]。根据预后将患者分为生存组(169例)和死亡组(87例),比较两组患者的临床资料;再根据是否发生感染分为感染组(82例)和非感染组(174例),比较两组患者的生存情况。

结 果
1.死亡组和生存组患者临床资料比较:死亡组中合并糖尿病、感染、腹腔积液及Child-Pugh分级为C级患者比例及MELD评分、INR均明显高于生存组,接受内镜治疗患者比例低于生存组,差异有统计学意义(P<0.05)。见表1。
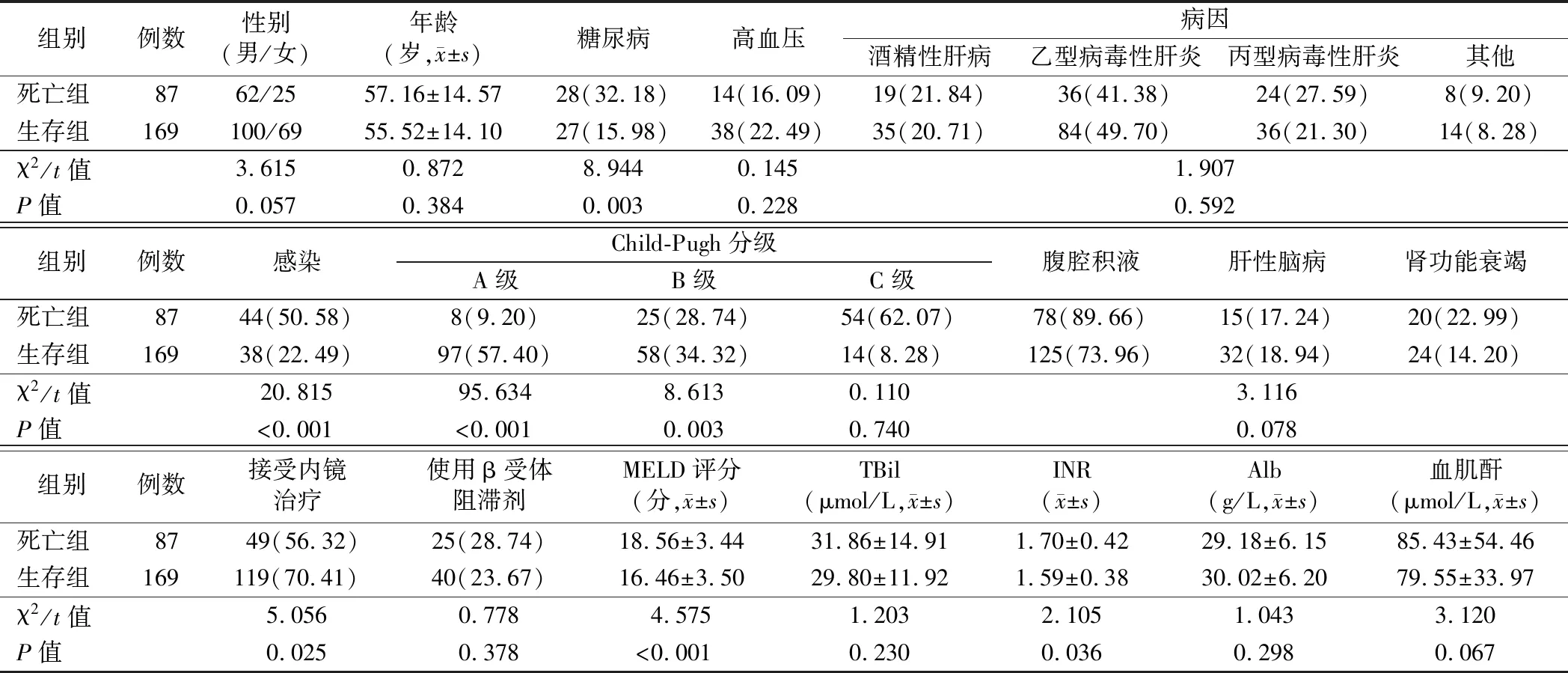
表1 死亡组和生存组患者临床资料比较[例,(%)]
2.肝硬化GEVB患者生存预后的影响因素分析:COX多因素回归分析结果显示,糖尿病、感染、Child-Pugh分级为B和C级、MELD评分较高是影响肝硬化GEVB患者生存预后的独立危险因素(P<0.05),其中感染组相对于非感染组生存时间的HR值为1.687(95%CI1.071~2.658,P=0.024)。见表2。
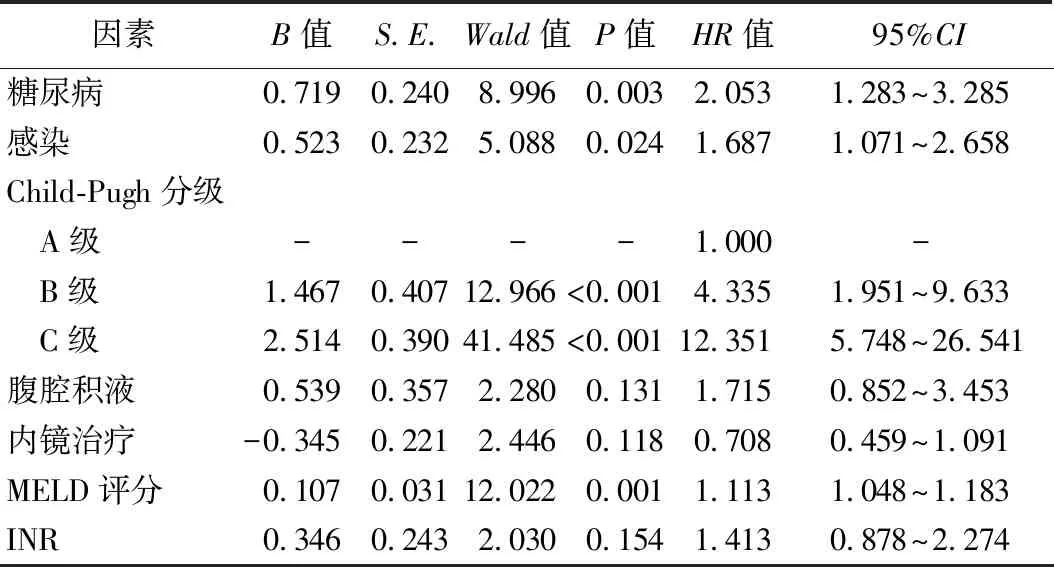
表2 肝硬化GEVB患者预后影响因素的COX多因素回归分析
3.感染组和非感染组患者生存情况比较:感染组患者的生存期为20.01~26.11个月,中位生存期为23.06个月;非感染组患者的生存期为28.86~32.07个月,中位生存期为30.47个月。感染组患者生存期明显短于非感染组(P<0.001)。见图1。
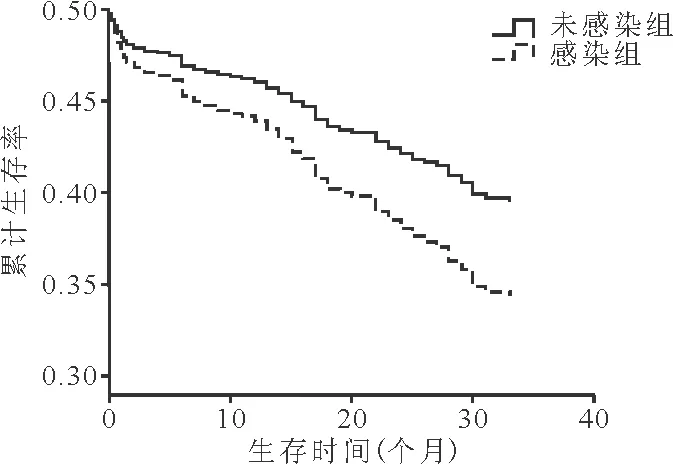
图1 感染组和非感染组患者生存曲线
4.不同感染部位死亡情况:感染部位死亡率最高为败血症(14例),其次为呼吸道感染(12例)、腹腔感染(10例)、泌尿道感染(4例)、胃肠道感染(2例)、其他部位感染(2例)。
讨 论
GEVB是肝硬化患者的严重并发症之一,GEVB患者也可能发生其他并发症,如低血容量性休克、感染或肝衰竭。当出现感染,尤其是吸入性肺炎和败血症时,会加剧患者肝功能恶化,同时体内大量病原体繁殖,导致一系列炎症反应,严重时全身多个脏器受损,引发多脏器功能衰竭[5],最终导致死亡。尽管在过去20年中,学者们对门静脉高压症的病理生理认识有所提高,但肝硬化GEVB患者的死亡率仍然很高,约为20%[6]。Augustin等[7]研究表明,与食管静脉曲张破裂出血发生后6周内的死亡风险相关因素包括Child-Pugh分级、MELD评分、肾衰竭、细菌感染。本研究对肝硬化GEVB患者的死亡风险因素进行分析发现,感染是影响其生存预后的独立危险因素之一,合并感染相对于未合并感染患者生存时间的HR值为1.687,合并感染患者死亡率高达53.66%,且生存时间明显缩短。本研究还发现Child-Pugh分级为B、C级和MELD评分较高也是影响肝硬化GEVB患者生存预后的独立危险因素。有研究结果显示,Child-Pugh分级为B、C级患者容易发生感染,从而进一步加重肝功能恶化,导致患者预后更差[8],与本研究结果一致。
有文献报道,20%的消化道出血住院患者存在细菌感染[9],而肝硬化消化道出血患者细菌感染的发生率更高,达30%~60%[9-10]。本研究结果显示,肝硬化患者如出现GEVB,其感染发生率高达32.03%。分析原因可能是:(1)在静脉曲张破裂出血发生时,肝内Kupffer细胞的杀伤力及肝脏蛋白质合成能力均下降,患者机体免疫力及对病原体的抵抗能力下降[11],且胃肠道黏膜供血不足,屏障功能下降,肠道内残留的淤血为细菌繁殖提供了良好环境,这些细菌可以通过肠道屏障进入腹腔、淋巴液甚至血液中,引发患者感染相关症状;(2)侵袭性操作如胃镜下治疗在一定程度上会破坏黏膜的完整性,为病原菌入侵提供了通路,进而增加感染发生率。此外,感染也会诱发肝硬化相关并发症的发生,如GEVB,其原因是肝硬化时,细菌易穿透肠壁,进入门静脉系统或体循环,形成菌血症和内毒素血症[12],从而引起炎性细胞因子大量分泌,干扰全身和内脏血液动力学,导致门静脉压力升高和凝血功能障碍加重,加剧肝功能恶化,最终导致静脉曲张破裂出血[13]。除血流动力学不稳定外,细菌感染还会加重食管胃静脉曲张的严重程度并增加再出血率[10],这也是合并细菌感染会增加肝硬化GEVB患者死亡率的主要原因。
目前有研究显示,肝硬化GEVB合并败血症的患者6周死亡率最高,其次是合并肺炎和自发性腹膜炎者[14]。本研究收集的病例为近3年死亡的患者,结果表明,败血症仍然是引起高死亡率的合并症。
综上所述,合并感染对肝硬化GEVB患者的生存率、长期预后影响较大。为减少肝硬化GEVB患者并发感染,临床医生应加强宣教,保护易感人群,防止长期卧床造成呼吸道分泌物的聚积。如出现感染,应根据药敏试验和临床经验选择敏感抗生素以控制感染,改善患者生存预后。

