银屑病关节炎的诊治
崔然 戴生明
银屑病关节炎(PsA)即银屑病的关节损害,表现为慢性炎症性关节病变和附着点病变。除皮肤病变外,PsA具体可表现为外周关节炎、附着点炎、指(趾)炎、中轴关节炎(骶髂关节炎、脊柱炎)[1]。此外,PsA患者易合并肥胖、代谢综合征、痛风、高血压、糖尿病、动脉粥样硬化、恶性肿瘤、慢性肝病、肺部疾病及精神障碍[2-4]。这类合并症(共病)的存在显著增加其死亡率,尤其是心血管疾病死亡风险[5]。因此,银屑病并不仅是一种传统意义上的皮肤疾病,而是一种系统性疾病,我们建议用“银屑病综合征(psoriatic syndrome)”来概括该类患者皮肤与指(趾)甲的损害、关节损害、代谢异常与心血管病变等多种临床表现。
一、PsA的临床表现和诊断现状
从皮肤银屑病到出现PsA的平均病程为10年左右,约70%的患者银屑病皮损表现早于关节炎症状发生,分别有15%的患者皮损表现与关节炎症状同时发生或PsA发生于皮损之前。PsA主要累及指(趾)间关节、掌指关节、跖趾关节等手足小关节,也可累及腕关节、踝关节、肘关节及膝关节等四肢大关节,少数可累及骶髂关节及脊柱。受累关节常不对称,远端指间关节受累常见且具有一定的特征性,累及手关节较足关节多见。临床上除了有关节疼痛外,可伴有关节红肿、晨僵,随着病情进展可出现关节强直、畸形及不同程度的功能障碍,少数可引起残毁。总之,PsA的关节表现具有很大的个体差异,从外周关节到脊柱中轴关节均可受累。另外,患者往往不了解关节炎与银屑病之间有内在联系,常导致PsA被漏诊。研究表明,银屑病患者中未被发现的PsA比例为4.2%~33.6%[7-9]。德国一项纳入了1 511例银屑病患者的大型调查发现,20.6%的患者伴有PsA,其中85%为新诊断病例。该研究表明,有许多银屑病患者在接受皮肤科医师的诊疗时并未注意到PsA,因而被漏诊[9]。另外一项研究显示,在949例银屑病患者中,先由皮肤科医师检查仅发现168例(17.7%)PsA,再由风湿科医师进行体格检查,结果发现高达30%(285例)的银屑病患者患有PsA[8]。法国一篇系统综述显示,在皮肤科就诊的银屑病患者中,被漏诊的PsA患者约占银屑病患者的15.5%[10]。一项调查显示,在283例爱尔兰PsA患者中,延误诊断超过6个月、1年和2年的患者比例分别高达69.6%、47.7%和28.6%[11]。最近一项西班牙的研究结果显示,在503例PsA患者中,延迟诊断时间为(4.01±1.42)年[12]。上述研究结果均表明,PsA极易被漏诊及延误诊断。
二、PsA的早期筛查和早期诊断
1.PsA早期筛查
在我国,与类风湿关节炎及强直性脊柱炎相比,PsA是一种公众关注度较低的疾病。前已述及,有较多的银屑病患者缺乏对皮肤病变与关节炎之间关系的认识。通常,银屑病患者自发而不是通过皮肤科医生转诊寻求风湿病专家对关节炎症状进行治疗,而许多皮肤科医生更加关注皮肤病变,而不是关节炎,这又更加延迟了PsA的诊断和及时干预。据报道,银屑病患者中PsA的患病率为6%~42%[13-14]。由于银屑病通常存在数年之后才出现PsA相关的关节症状,因此,使用筛查工具可能将早期PsA患者从银屑病患者人群中鉴别出来。目前有多种问卷工具用于筛查早期PsA,并得到了部分研究的验证,但不同研究所得结果(包括界值、敏感度和特异度)的差异较大,且现有的这几种工具对中轴型PsA的筛查不够敏感。笔者所在团队的研究发现,银屑病与关节炎的筛查问卷表(PASQ)[15]和银屑病患者筛查早期关节炎问卷表(EARP)[16]在筛查PsA方面相对更优;银屑病流行病学筛查工具问卷(PEST)[17]最简单,只包含5个问题,但其敏感度和特异度均较差;银屑病关节炎筛查与评价问卷(PASE)[18]最为繁琐,且非常不利于早期PsA的筛查。
2.PsA早期诊断
多项研究结果表明,PsA患者在起病后的2年内接受规范治疗可减轻其关节损害[19-21]。若诊断延迟6个月,则患者的影像学和关节功能预后均不如那些得到及时诊治的患者[11]。因此,早期诊断对于改善PsA患者的预后至关重要。自1973年以来诞生了多套PsA分类/诊断标准,包括Moll-Wright标准、Bennett诊断标准、Vasey-Espinoza分类标准、Gladman标准、修订的McGonagle标准和Fournie标准。目前被广泛应用的是2006年发布的CASPAR分类标准[22]。该标准的敏感度为91.4%,特异度为98.7%。采用CASPAR标准对于只有附着点炎、指(趾)炎的早期患者也可能作出诊断;即使患者的类风湿因子阳性、有对称性多关节炎也可能作出诊断。尽管已有多项研究对其敏感度及特异度进行了验证,得到了很高的信度,但该标准对于那些皮肤病变很轻(甚至患者本人并未觉察)或皮肤病变晚于关节病变出现的患者,其敏感度可能并不高。
三、PsA的实验室检查与影像学检查
PsA属于血清阴性脊柱关节炎(血清阴性即类风湿因子阴性)家族。95%的PsA患者类风湿因子和(或)抗环瓜氨酸肽抗体阴性,当其中一项检测结果为阳性时,必须结合临床表现和影像学特征来鉴别PsA与类风湿关节炎。约25%的PsA患者人类白细胞抗原(HLA)-B27阳性,40%患者可检测到C反应蛋白水平升高、红细胞沉降率(ESR)增快。
影像学检查包括X线平片、关节超声和磁共振(MRI)检查。X线平片常被作为评测关节结构损害进展的手段。高频超声因可显示发生炎症反应的软组织结构,不仅对PsA的诊断具有重要价值,且可早期发现亚临床炎症、精确引导关节腔穿刺或局部治疗及监测关节、肌腱、附着点、指甲和皮肤在治疗前后的病情变化。MRI可显示关节炎相关的所有结构,并且对外周和中轴病变的表现均比较敏感。对于外周型PsA,MRI可显示的异常包括滑膜炎、附着点炎、腱鞘炎、关节周围炎症、骨髓水肿、骨侵蚀和骨质增生。滑膜炎的MRI特征为增厚的滑膜在注射钆对比剂后被强化;对于中轴PsA,MRI可显示的异常主要为骨髓水肿/骨炎、附着点炎、脂肪浸润、骨侵蚀、骨质增生和关节强直。但MRI显示的骨侵蚀、骨质硬化/增生不如CT可靠。骨髓水肿/骨炎在T2加权像的脂肪抑制序列、STIR序列或增强T1WI表现为高信号。
四、PsA的鉴别诊断
银屑病可与类风湿关节炎、骨关节炎、痛风、假性痛风、系统性红斑狼疮等疾病引起的关节炎并存。若患者有银屑病皮疹、对称性关节炎和高滴度类风湿因子和(或)抗环瓜氨酸肽抗体阳性,则需要考虑银屑病与类风湿关节炎合并存在。若存在高滴度类风湿因子和(或)抗环瓜氨酸肽抗体阳性,也不能武断地排除PsA。因此,患者若同时存在银屑病皮损与关节炎并不能理所当然诊断为PsA。需要注意的是,PsA在起病时通常表现为非对称性寡关节炎,但随着时间推移,可能转变成对称性多关节炎。PsA还需与强直性脊柱炎、反应性关节炎、白塞病相关关节炎、弥漫性特发性骨肥厚等相鉴别。
五、PsA的治疗原则
PsA的治疗原则包括:(1)个体化治疗:PsA是一种异质性疾病,其临床表现涉及许多方面,不同患者临床表现之间的差异性决定治疗方案应该个体化。在为每个患者制订治疗方案时,应结合其具体的整体情况,评估每个治疗方案的有效性及潜在风险。(2)多学科协作治疗。(3)早期干预。(4)“达标”治疗:目前仅为理念,因为一方面PsA尚无公认的临床缓解与低疾病活动度的评判标准;另一方面2015年发表的“PsA严格控制”(TICOPA)研究结果并未证明严格控制组的影像学进展优于常规治疗组[23]。
六、PsA的治疗药物
PsA的治疗药物主要包括非甾体抗炎药(NSAIDs)、改变病情抗风湿药(DMARDs,包括传统DMARDs、生物制剂和小分子靶向药物)及糖皮质激素。
1.NSAIDs
NSAIDs是治疗PsA的最常见药物,包括双氯芬酸、美洛昔康、布洛芬、塞来昔布等,该类药物只有缓解症状的作用,并不能阻止疾病进展。NSAIDs主要通过抑制环氧化酶活性而抑制前列腺素的合成发挥抗炎镇痛的作用,还可抑制细胞膜相关的酶活性、细胞膜离子转运、花生四烯酸前体的摄取、胶原酶释放和中性粒细胞的功能。
2.DMARDs
(1)传统DMARDs
传统DMARDs包括甲氨蝶呤、柳氮磺吡啶、来氟米特、环孢素等。支持这类药物使用的主要证据来自于观察性的研究和临床实践。尽管一些系统综述和荟萃分析显示这类药物治疗PsA缺乏可靠证据,但在目前所有指南/推荐意见中,甲氨蝶呤仍然被推荐为治疗外周型PsA的首选药物。常用于类风湿关节炎治疗的抗疟药物羟氯喹因为可能加重皮疹,一般不用于PsA的治疗。
(2)生物制剂类DMARDs
生物制剂类DMARDs种类繁多,常用的生物制剂类药物及用法见表1。具体包括肿瘤坏死因子-α(TNF-α)抑制剂(包括重组人Ⅱ型TNF-α受体-抗体融合蛋白和TNF-α单克隆抗体)、白细胞介素(IL)-17抑制剂和IL-23抑制剂。目前有确切的证据显示,抗TNF-α药物[包括阿达木单抗(Adalimumab)、培塞利珠单抗(Certolizumab)、依那西普(Etanercept)和戈利木单抗(Golimumab)]可有效抑制皮肤、关节炎症和延缓放射学进展。这些药物对于附着点炎、指(趾)炎均有效,基于治疗强直性脊柱炎的数据显示这些药物对中轴关节炎病变亦有效。司库奇尤单抗(Secukinumab)和柏达鲁单抗(Brodalumab)分别阻断IL-17A、IL-17A受体,能有效改善PsA的皮损及骨骼肌肉疼痛症状。依奇珠单抗(Ixekizumab)是另一种IL-17A阻断剂,Ⅲ期临床试验显示对PsA有效,已被批准用于治疗银屑病。乌司奴单抗(Ustekinumab)是一种靶向IL-12/23共有亚基p40的新型抗体,能有效治疗PsA及银屑病,但治疗银屑病皮损的效果比关节炎更显著。古塞奇尤单抗(Guselkumab)是一种靶向IL-23亚基p19的新型抗体,可以获得更高和更为持久的银屑病皮损PASI90缓解率(48周PASI90缓解率可达84%);最新的证据显示,乌司奴单抗和古塞奇尤单抗对中轴型PsA可能无效。
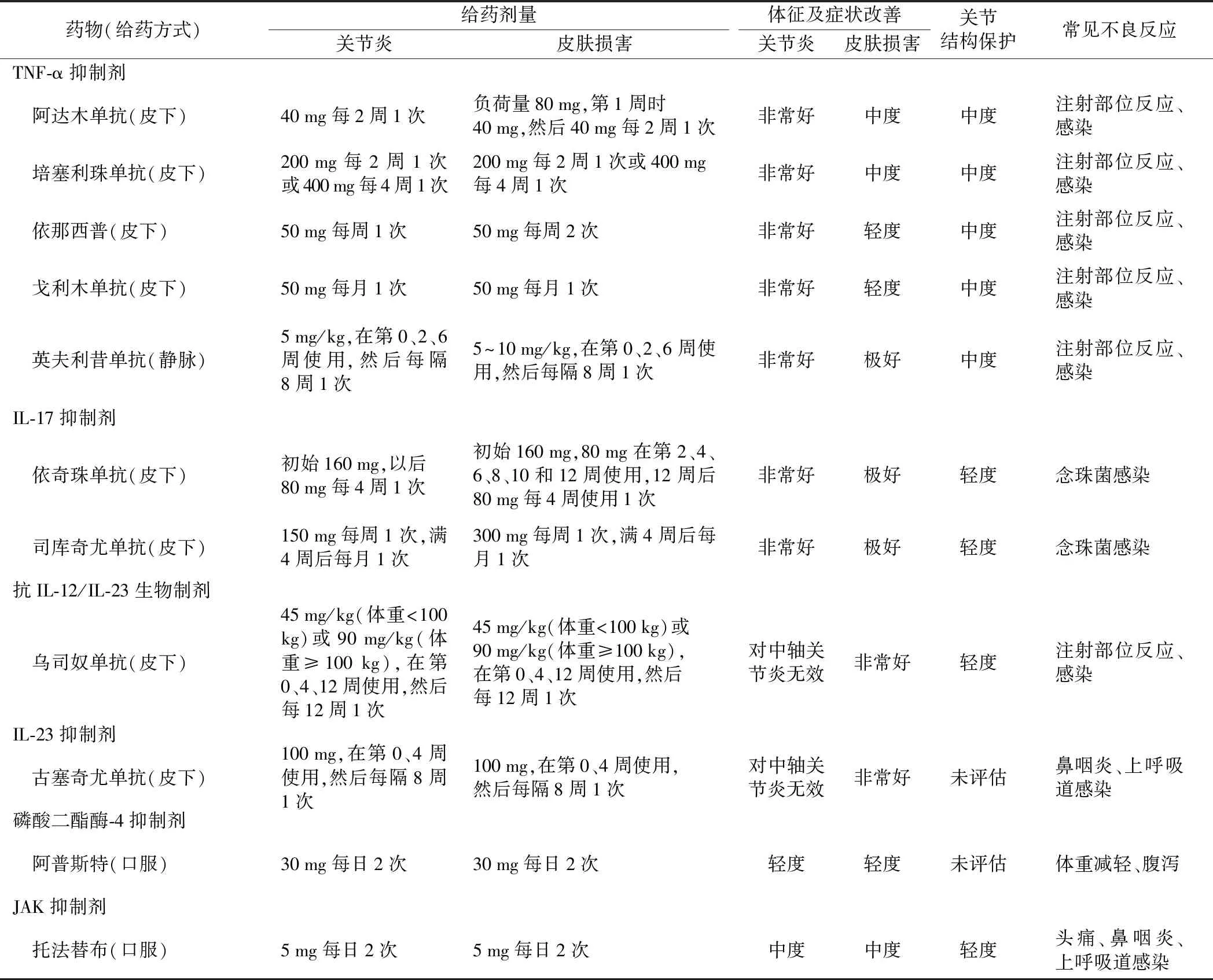
表1 治疗PsA的生物制剂类DMARDs及靶向药物的分类、疗效及常见不良反应
(3)小分子靶向药物DMARDs
小分子靶向药物DMARDs包括磷酸二酯酶4抑制剂和Janus激酶(JAK)抑制剂(表1)。阿普斯特(Apremilast)是一种可以口服的小分子药物,通过选择性抑制磷酸二酯酶4,减少cAMP的降解,进而抑制炎症反应。本品已于2014年被美国FDA批准用于治疗PsA,而且是美国FDA批准用于治疗PsA的第一个口服药品。阿普斯特治疗银屑病皮损的疗效与甲氨蝶呤类似,但对关节炎的疗效比生物制剂低。托法替布(Tofacitinib)是一种口服的JAK抑制剂,主要抑制JAK3和JAK1,对JAK2有轻度抑制作用,国外现已被批准用于治疗PsA,对皮疹和关节炎均有效。
3.糖皮质激素
局部注射糖皮质激素可作为PsA的辅助疗法,但全身性应用糖皮质激素需谨慎,目前尚缺乏全身运用糖皮质激素的循证学证据,停用糖皮质激素后可能“反跳性”加重银屑病皮损及转化成红皮病型银屑病的风险。关节腔内注射糖皮质激素非常有效,特别是对于在充分系统治疗后仍有关节炎症状控制不佳的少关节炎型患者;或累及局部肌腱端者,如局部注射糖皮质激素可改善足底筋膜炎患者附着点炎、肌腱炎。
七、总结
PsA是一种慢性炎症性疾病,可严重影响患者关节活动功能,甚至致残。早期筛查、早期诊断对于改善PsA患者预后至关重要。虽然目前治疗PsA的药物越来越多,特别是生物制剂的疗效显著,但其治疗方案的制定需建立在患者的具体临床表现、疾病严重程度及共病情况的基础上。

