微小残留病在儿童急性B 淋巴细胞白血病预后中的意义
薛玉娟 陆爱东 王 毓 贾月萍 左英熹 张乐萍
北京大学人民医院儿科(北京 100044)
近年来,得益于危险度分层治疗体系的不断完善,儿童B 细胞急性淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)的长期生存率可达90%[1],但复发仍然是导致儿童B-ALL治疗失败的最主要原因。患儿体内的微小残留病(minimal residual disease,MRD)又是导致复发的罪魁祸首,因此MRD是现代危险度分层中的重要组成部分[2-3]。采用敏感、便捷的方法定期监测治疗过程中的MRD 水平,并加强对MRD阳性患者的治疗是提高整体B-ALL儿童生存的关键[4]。流式细胞术是检测MRD的常用方法,其临床意义已被多项研究证实[5]。本研究通过回顾性分析北京大学人民医院儿科B-ALL 患儿的数据,探究在MRD 指导危险度分层及治疗下,采用多参数流式细胞术(multi-parametric flow cytometry,MFC)监测治疗不同时间点MRD 水平与儿童B-ALL 预后的相 关性。
1 对象与方法
1.1 研究对象
回顾性分析自2014年9月至2017年12月北京大学人民医院儿科收治的417例初诊为B-ALL患儿的临床资料。研究对象入选标准:①0~18周岁;②初发患儿(就诊前未接受过任何ALL相关治疗),给予规律治疗及监测,排除治疗过程中放弃治疗或转院者;③临床表现符合ALL,并经形态学、免疫学、细胞遗传学及分子生物学确诊为B-ALL,诊断标准及危险度分层参照文献[6]。危险度分层根据MRD水平再次调整,诱导治疗第33 天骨髓MRD<1×10-4归入标危组;诱导治疗第33天骨髓MRD≥1×10-4且<1×10-2归入中危组;诱导治疗第33天骨髓MRD≥1×10-2或第90天MRD≥1×10-3归入高危组。
入选研究对象均采用改良的德国柏林-法兰克福-蒙斯特(BFM)方案。化疗方案参考儿童ALL诊疗建议[6]制定。诱导方案为CODPL,具体药物包括环磷酰胺(cyclophosphamide,CTX)、长春新碱(vincristine,VCR)、地塞米松或醋酸泼尼松(dexamethasone/prednisone,DEX/Pred)、去甲氧柔红霉素(idarubicin,IDR)、左旋门冬酰胺酶(native escherichia coli L-asparaginase,L-asp)。巩固强化方案包括大剂量甲氨喋呤、大剂量阿糖胞苷等药物序贯、交替使用。CODPL再诱导治疗每半年进行1轮,总计2轮。维持治疗方案包括口服巯嘌呤及肌注甲氨蝶呤。所有患儿均接受甲氨蝶呤、阿糖胞苷、地塞米松三联鞘注预防中枢神经系统白血病(central nervous system leukemia,CNSL),对已确诊的CNSL患儿,给予较密集的三联鞘注治疗。
入组患儿根据性别、年龄(<1岁、1~10岁、≥10岁)、初诊白细胞计数(WBC≥50×109/L、<50×109/L)、化疗不同时间点(化疗第15、33、90、180 天)不同MRD 水平(<0.01%、0.01%~0.1%、0.1%~1%、1%~10%、≥10%)、危险度分层(标危、中危、高危)等因素进行分组。
1.2 方法
1.2.1 临床资料收集 通过医院病案查询系统、科室专科患儿登记簿及电话随访等方法,收集研究对象的临床、实验室特征及预后疗效等资料。
1.2.2 MRD 检测 采用MFC 进行骨髓MRD 检 测。监测时间点分别为化疗第15、33、90及180天;检测的单克隆抗体包括CD 58、CD 10、CD 34、CD 123、CD38、CD19、CD45、CD20[7];检测敏感度为10-4。
1.2.3 疗效评估 完全缓解(complete remission,CR):①骨髓原始幼稚淋巴细胞<5%,且血常规恢复,即中性粒细胞绝对计数>1×109/L、血小板计 数>100×109/L;②外周血无原始幼稚淋巴细胞且无髓外白血病证据。复发:获得CR 后再次出现骨髓原始幼稚淋巴细胞>5%,或出现髓外白血病。总生存(overall survival,OS)期:自诊断至死亡或末次随访日期。无事件生存(event free survival,EFS)期:自诊断至首次事件(复发、第二肿瘤及死亡)发生日期。随访截止日期为2020年4月15日。
1.3 统计学分析
应用SPSS 20.0 进行数据处理。符合正态分布的计量资料以均数±标准差表示,非正态分布计量资料以中位数(四分位数范围)表示;计数资料以例数(百分比)表示。OS和EFS以估计值±标准误表示,组间生存率比较采用log-rank检验,生存分析采用 Kaplan-Meier生存曲线,多因素分析采用COX比例风险模型(纳入COX 比例风险模型的因素均为二分类变量)。以P<0.05为差异有统计学意义。
2 结果
2.1 患儿一般特征
共纳入417例患儿,男240例(57.6%)、女177例(42.4%),中位年龄5.0(3.0~10.0)岁,中位WBC 12.4(4.3~32.5)×109/L。3 年OS 及EFS 分别为(90.9±1.4)% 和(85.2±1.7)%。ETV 6-RUNX 1+ALL 71例(17.0%),MLL+ALL16例(3.8%),E2APBX1+ALL 32例(7.7%),BCR-ABL1+ALL 40例(9.6%)。
标危组132 例,男66 例、女66 例,中位年龄4.0(2.3~5.8)岁;中危组194例,男119例、女75例,中位年龄6.0(3.0~12.0)岁;高危组91例,男55例、女36例,中位年龄9.0(5.0~13.0)岁。WBC≥50×109/L 组69例,男40例、女29例,中位年龄6.0(3.0~11.0)岁;WBC<50×109/L组348例,男200例、女148例,中位年龄5.0(3.0~10.0)岁。3个时间点(第33、90、180天)MRD均阴性组279例,男145例、女134例,中位年龄5.0(3.0~10.0)岁,3个时间点MRD至少1次阳性组 135例,男95例、女40例,中位年龄6.0(3.0~11.0)岁。见表1。
2 例患儿于诱导化疗期因重症感染死亡,余415例患儿第一疗程CR 率为98.8%(410/415)。截至末次随访日期,共60 例患儿复发,其中单纯骨髓复发49 例,单纯中枢神经系统复发5 例,骨髓联合中枢神经系统复发4 例,单纯睾丸复发1 例,单纯乳腺复发 1例。随访期间共41例患儿死亡,其中32例死于复发,5例死于感染,2例死于脑出血,1例死于肺出血,1例死于重症胰腺炎。所有患儿的中位生存时间为44.0(33.7~56.2)月,3年OS及EFS率分别为(90.9±1.4)% 和(85.2±1.7)%。
2.2 不同分组与预后的关系
WBC ≥50×109/L 组3 年OS 及EFS 率均低于WBC<50×109/L 组,3 个时间点MRD 均阴性组的 3 年OS 及EFS 率均高于3 个时间点MRD 至少1 次阳性组,高危组的3年OS及EFS率均低于标危和中危组,差异均有统计学意义(P<0.05)。见表1。
417 例患儿中,第15、33、90 和180 天4 个时间点分别有336、415、414、414 例接受了骨髓MRD 检测。治疗第15天,MRD≥10%组的3年OS及EFS率均低于其他MRD 水平组;治疗第33 天,MRD ≥1%组的3年OS及EFS率均低于其他MRD水平组;第90天或180天,MRD≥0.1%组的3年OS及EFS率均低于其他MRD水平组,差异均有统计学意义(P<0.05)。见表1及图1、2。
COX 回归分析显示,化疗第33 天MRD ≥0.1%和第180天MRD≥0.01%均是影响OS和EFS的独立危险因素(P均<0.05)。见表2。
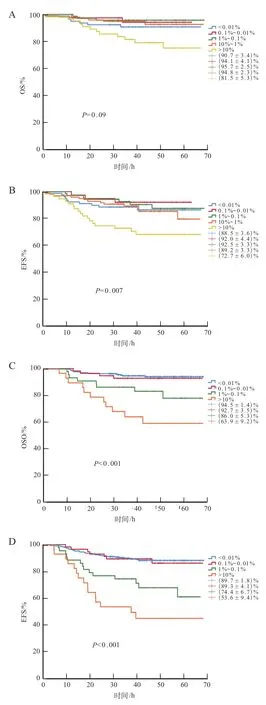
图1 治疗第15 天及第33 天不同MRD 水平对患儿预后影响
3 讨论
在儿童ALL 中如何进一步完善危险度分层,早期识别高风险复发患儿已经成为近年研究的重点。MRD 水平反映了白血病患儿体内肿瘤细胞遗传学、微环境、宿主因素及治疗敏感性等综合因素对治疗反应的共同影响[8]。已有多项研究证实,MRD 是判断预后的重要指标,可以识别早期治疗反应不良的患儿,并进一步指导治疗策略的选择[5,9]。在St.Jude儿童医院开展的第十五号全面治疗儿童ALL 的研究(NCT 00137111)中,使用MRD 指导治疗的策略显著提高了儿童ALL 的长期生存,取得了5 年EFS 率85.6%的疗效[9]。本研究也采用基于临床、生物遗传学特征、治疗反应和MRD 水平的综合危险度分层指导治疗,3年EFS率为(85.2±1.7)%,这与既往国内外的研究结果相一致[9-13],再次验证了MRD 指导危险度分层及治疗的良好疗效。
既往研究显示,在儿童ALL中,即使在诱导及巩固化疗期进行了基于MRD水平的治疗调整,MRD仍然是提示预后的重要因素[14]。但关于不同监测时间点的不同MRD 预测值尚存在争议。目前认为,诱导和巩固治疗期的骨髓MRD 监测均有重要意义,前者用于早期治疗反应及危险度分层的评估,并指导巩固治疗策略的选择;后者用于维持治疗强度的调整,并指导MRD水平复发时的挽救治疗策略[15]。本研究选择在第15、33 天诱导化疗期和第90、180 天巩固化疗期监测骨髓MRD,并分别界定自0.01%至10%等不同的MRD 比较水平,结果显示,第15、33、90、180天的MRD 水平均有预后提示意义。但不同时间点的MRD 阈值有所不同,第15 及33 天的MRD 预测水平分别为10%和0.1%,而第90和180天的预测水平则均为0.01%。而COX回归分析显示,第33天(0.1%)和180 天(0.01%)的MRD 水平是独立的预后影响因素,这与既往文献报道相符[9,12,15-16],且本研究中的MRD 预测定位时间点及精确度更高。此外,本研究还比较了在第33、90 及180 天3 个监测点全部达到MRD 阴性的患儿与至少1 次未达到阴性患儿的生存情况,发现两组间的差异也有明显的统计学意义,证实了儿童B-ALL 治疗过程中连续监测MRD 的必 要性[17]。
MFC和RT-PCR是进行白血病MRD检测最常用的两种方法[18]。相较于RT-PCR检测,MFC覆盖面更广、性价比更高,且方便省时,所以在临床工作中适用性更广,但RT-PCR的检测灵敏度更高。相关研究建议,条件允许的情况下可将两者结合应用以提高MRD检测的准确性和普及性[18]。本研究采用MFC 检测417例B-ALL患儿不同时间点的MRD,发现MRD与患儿预后的明确相关性,也再次验证了MFC检测MRD的可靠性。
综上所述,MRD 指导治疗下,诱导治疗第33 和180 天的骨髓MRD 水平是提示儿童B-ALL 预后的敏感指标。在儿童B-ALL 的治疗过程中应连续监测MRD。

