恶性实体瘤儿童营养状况及影响因素研究
颜 莓 唐维兵 黄 婕 方拥军 刘长伟 万园园 夏晓娜 朱 亭 潘 键
南京医科大学附属儿童医院 1.临床营养科,2.血液肿瘤科(江苏南京 210008 )
恶性实体瘤在<15岁人群的发病率可达0.24%,据统计美国0~14岁人群中,每100 000名中就有16.8例肿瘤患者,其中最常见的是脑和神经系统肿瘤及淋巴瘤[1-2]。因儿童时期生长发育及肿瘤自身代谢等原因,肿瘤患儿容易发生营养不良。营养不良的恶性实体瘤患儿对治疗的耐受性降低,感染、并发症及复发率的风险增加,最终导致生存率降低。目前关于恶性实体瘤儿童营养状况的研究不多,且多集中在入院时,对治疗过程中营养状况变化关注较少。本研究调查实体瘤患儿初诊及治疗过程中营养状况变化及相关影响因素,为临床评估营养状态及营养支持提供理论依据。
1 对象与方法
1.1 研究对象
以2018 年3 月至2019 年9 月收治于南京医科大学附属儿童医院血液肿瘤科的患儿为研究对象。纳入标准:①新诊断为恶性实体瘤的患儿;②年龄>28天,且不足14岁;③住院时间>48小时。排除标准:未坚持计划治疗,中途退出。
本研究经医院医学伦理委员会审批,患儿家长均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集 包括患儿姓名、性别、年龄、疾病诊断、入院48 小时及治疗3 个月后体质量、身高或身长。收集患儿入院及治疗3个月时的实验室检测结果,包括血红蛋白、白蛋白和前白蛋白。
1.2.2 营养风险筛查 采用STRONGkids 行营养风险筛查。STRONGkids 风险筛查主要包括主观临床评估、食物摄入或丢失、体质量减轻、疾病严重程度4 个部分,由营养科专业人员在患儿入院24 小时内进行评估。其中主观临床评分0~1 分,食物摄入或丢失0~1 分,体质量下降或不增0~1 分,疾病严重程度0~2 分;总评分0~1 分提示低度营养风险,2~3 分为中度营养风险,4~5 分为高度营养 风险。
1.2.3 营养摄入调查 患儿入院24小时内采用食物频率法记录营养摄入情况,根据一周患儿摄入食物的次数及种类计算膳食摄入,经过营养相关软件计算及分析,得到实际摄入热卡量,再与同年龄同性别儿童膳食营养参考摄入量(dietary reference intakes,DRIs)进行比较,了解患儿饮食情况。调查患儿住院期间肠外和肠内营养支持情况。
1.2.4 营养状况评定 入院时及治疗3 个月根据世界卫生组织儿童及青少年生长发育标准2006版(2006 WHO 儿童生长标准)评定,0~5 岁儿童采用WHO Anthro软件、>5岁儿童采用WHO AnthroPlus软件计算按年龄体质指数Z 评分(BMI-Z),Z>-1 为无营养不良,-2~-1 为轻度营养不良,-3~-2 为中度营养不良,Z ≤-3 为重度营养不良。其中<2 岁早产儿采用校正年龄。
1.3 统计学分析
采用SPSS 17.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon 秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2、校正χ2检验。采用多元logistic回归分析治疗后营养不良发生的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共收集104例恶性实体瘤患儿,男61例、女43例。中位年龄4.5岁(5个月~13岁8个月)。入院时营养不良29例,其中轻度营养不良21例、中度6例、重度2例。非霍奇金病淋巴瘤19 例,霍奇金淋巴瘤4 例,髓母细胞瘤6例,非髓母细胞瘤脑肿瘤7例,横纹肌肉瘤10例,肾母细胞瘤9 例,神经母细胞瘤27 例,生殖细胞肿瘤 11例,其他肿瘤11例(胰母细胞瘤1例、纤维肉瘤1例、小圆细胞未分化肉瘤1 例、头部结缔组织和软组织恶性肿瘤1例、软组织肉瘤1例、朗格汉斯组织细胞增生症2例、肝母细胞瘤2例、肾透明细胞肉瘤2例)。不同性别、年龄、肿瘤类型及分期的儿童入院时营养不良发生率差异均无统计学意义(P>0.05)。见表1。
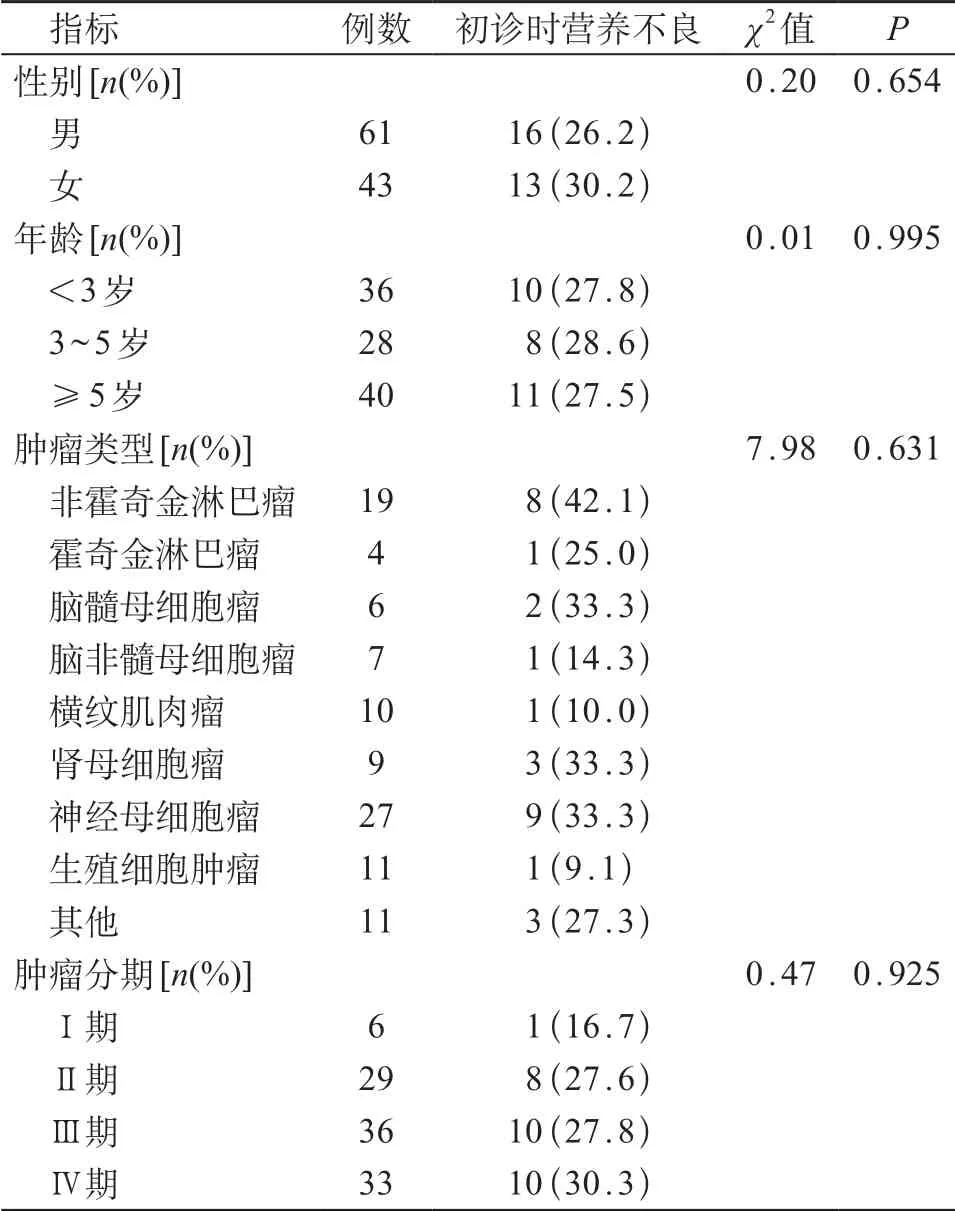
表1 实体瘤患儿入院时一般资料
2.2 入院时营养状况及治疗中营养支持
运用STRONGkids 营养风险评分,其中低风险患儿43 例(41.3%)、中风险39 例(37.5%)、高风险22例(21.2%)。入院时行膳食调查,未达到目标热量60%的共有28 例(26.9%),未达到目标蛋白推荐量的43 例(41.3%);治疗中采用肠内营养支持共8 例,采用肠外营养支持共7例。
2.3 患儿治疗过程中营养状态变化
治疗3 个月后实体瘤患儿的BMI-Z 值及血红蛋白水平与初诊时比较明显下降,差异有统计学意义(P<0.05)。治疗过程中白蛋白及前白蛋白水平无明显变化,差异无统计学意义(P>0.05)。见表2。
2.4 患儿营养状况变化的影响因素
实体瘤患儿治疗后,营养不良组和营养良好组,初诊时营养状态和STRONGkids营养风险筛查的差异有统计学意义(P<0.05)。营养不良组初诊时营养不良以及STRONGkids高营养风险比例较高。见表3。
多元logistic回归分析结果显示,初诊时营养不良以及STRONGkids高营养风险是患儿在治疗后出现营养不良的独立危险因素(P<0.05)。见表4。
3 讨论
血液肿瘤患儿初诊即有5.8%~50.0%营养不良,不同类型的肿瘤营养不良发生率不同,相比急性淋巴细胞白血病,实体瘤中髓母细胞瘤、肾母细胞瘤的营养不良发生率更高[3-5]。肿瘤的自身代谢异常,伴有脂肪分解增加、蛋白质转换增加,能量消耗增加,以及化疗或放疗引起恶心、呕吐、腹泻等,都可导致或加重患儿营养不良。营养不良不仅影响血液肿瘤患儿自身的生长发育,还会降低患儿对化疗药物的耐受性,从而影响治疗效果以及患儿整体生存率[6]。本研究中,实体瘤患儿入院时营养不良发生率为27.9%,同国外研究基本一致。不同性别、年龄、肿瘤类型及分期的儿童入院时均有较高的营养不良发生率。入院时非霍奇金淋巴瘤营养不良发生率为50.0%,肾母细胞瘤33.3%,神经母细胞瘤33.3%,比其他类型肿瘤营养不良发生率高,尽管差异并不显著。

表2 实体瘤患儿初诊及治疗3个月后BMI-Z、血红蛋白、白蛋白及前白蛋白值变化
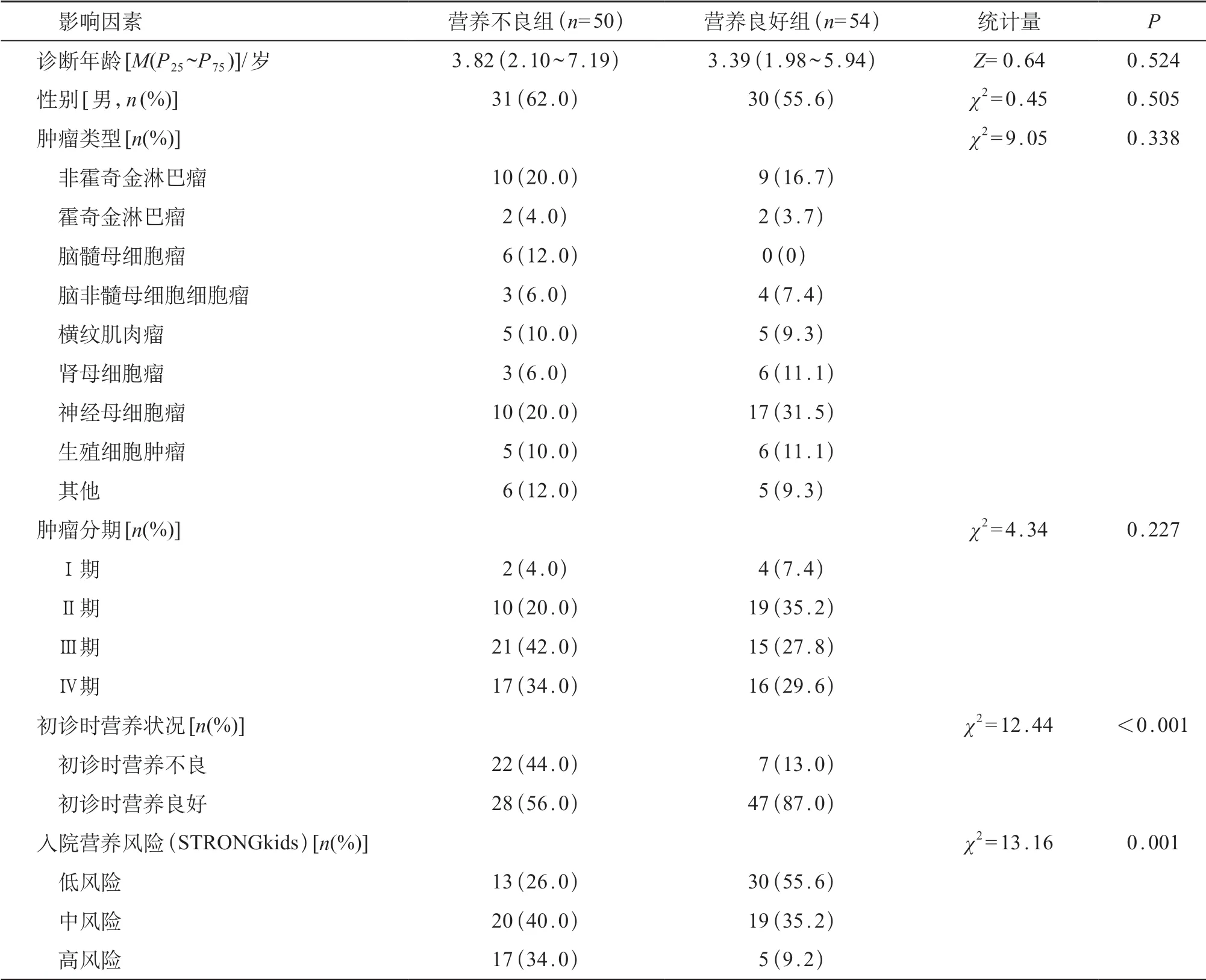
表3 实体瘤患儿治疗后营养不良组和非营养不良组各因素比较

表4 多元logistic回归分析治疗后营养不良发生影响因素
在一项长达42个月的研究中,相对于急性淋巴细胞白血病,在诊断后6 个月内,实体瘤患儿的BMI 下降更明显,6 个月后BMI 逐渐回到基线水平[7]。另有研究证实,患有血液肿瘤的儿童及青少年初诊时营养不良率为5.8%,而在治疗过程中营养不良发生率可达47.0%[8]。本研究中,治疗3 个月后患儿的BMI-Z值明显下降,营养不良发生率由入院时27.9%增加至48.0%;其中,初诊时髓母细胞瘤患儿营养不良发生率为33.3%(2/6),治疗3 个月后营养不良率达100%。髓母细胞瘤治疗过程中营养不良发生率高,这与国外相关研究结果一致[8-9],可能与髓母细胞瘤治疗过程中应用顺铂等细胞生长抑制剂有关;但是本研究中髓母细胞瘤例数较少,因此需要更多样本量来 证实。
血红蛋白、白蛋白、前白蛋白等指标常被用来评估营养状态以及评判营养支持的作用。本研究中肿瘤患儿的血红蛋白含量明显下降,可能是由于一些化疗药物、感染等因素影响叶酸和铁的摄入。本研究中,患儿的白蛋白指标在治疗过程中无明显变化,前白蛋白较治疗前下降,但无统计学意义,可能受脱水、白蛋白输注、肝肾功能、感染及相关血制品输注有关,与相关研究结论一致[10]。本研究中,白蛋白、前白蛋白在实体瘤儿童治疗前后变化并不能完全反映营养状态变化,因此不能作为评价营养状况的可靠 指标。
营养风险是指现存或潜在的与营养因素相关的,进而影响患儿出现不利临床结局的风险。入院时即对患儿进行营养风险筛查,并对有营养风险的患儿进行干预,可改善临床结局[11]。STRONGkids是2010年由Hulst[12]提出的营养风险筛查方法,临床上容易操作执行,费时少。我国相关研究将STRONGkids运用在小儿胃肠外科围手术期,结果显示STRONGkids 能有效评估恶性肿瘤患儿的营养风险,早期干预能明显改善患儿营养状况及术后恢复情况[13]。另有研究对存在高度营养风险的恶性肿瘤患儿入院后早期予以肠内营养干预,患儿术后各项营养指标明显改善,且术后并发症发生率降低[14]。本研究发现,应用STRONGkids 对新诊断的实体瘤患儿进行营养风险筛查,高营养风险患儿治疗后发生营养不良可能更高,提示应警惕高营养风险儿童,动态进行营养风险筛查,及早识别其营养不良状况,早期予以营养 支持。
肿瘤患者营养支持应该遵循五阶梯治疗原则,首先选择营养教育,然后依次向上选择口服营养补充、全肠内营养、部分肠外营养、全肠外营养。参照欧洲肠外肠内营养学会(ESPEN)指南建议,当下一阶梯支持方案不能满足60%目标能量需求3~5天时,应该选择上一阶梯[15]。另有研究认为,实体瘤患儿处于营养摄入不足情况下,应尽早进行营养干预[16]。研究显示,初诊时营养不良血液肿瘤患儿在确诊后的前6 个月改善营养状况,其生存概率可从58.5%显著提高至77.5%,接近于无营养不良患儿(79.8%)[17]。本研究发现,在104 例患儿中,能量达不到目标推荐量60%的有28例,蛋白质摄入达不到目标推荐量的有43例;但是临床中实行营养支持干预仅15例,其中进行肠内营养支持共8例,肠外营养支持7例。由于化疗过程中胃肠道反应明显、肠内营养制剂口味差、家长对管饲接受度较低和液体量受限等因素,导致本研究中肠内和肠外营养支持率并不高。研究表明,合理的肠内及肠外营养干预可以维持患儿体质量稳定、改善营养状况[18]。
实体瘤患儿营养不良发生率在治疗过程中明显升高,入院时营养不良和高营养风险增加了治疗后出现营养不良的风险,目前临床上营养风险筛查及营养支持重视不足,提供营养支持不足,需要动态监测营养状况及营养风险筛查,及时提供营养支持。
目前本研究仅涉及实体瘤儿童治疗3个月后的营养状况,没有长期的营养状况监测,营养状况变化是动态过程,需长期跟踪随访;由于营养干预例数较少,营养干预后患儿营养状况变化未纳入分析,是本研究的不足之处。本研究为单中心研究,今后需要扩大样本量及开展多中心研究。
致谢:感谢中国健康促进基金会“儿科营养支持团队(NST)发展科研公益项目(2019年度)”的支持。

