儿童胰腺实性假乳头状瘤CT 和MRI 征象
崔芷萌 任 刚 蔡 嵘 赵 江 汪心韵
1.上海交通大学医学院附属新华医院放射科(上海 200092);2 .上海交通大学医学院附属瑞金医院 放疗科(上海 200025)
胰腺实性假乳头状瘤(solid pseudopapillary tumor of the pancreas,SPTP)是一种罕见的胰腺外分泌源性肿瘤,约占全部胰腺肿瘤的3%,占所有胰腺囊性肿瘤的10%~15%[1]。SPTP 呈惰性生长,大多数患者术后预后良好。随着国内外报道SPTP 的文献增多,学者们对SPTP 的认识也逐渐提高。SPTP 好发于20~30 岁年轻女性,儿童少见,仅占所有儿童胰腺肿瘤的8.0%~16.6%[2]。SPTP患者无特征性临床表现,癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)199、甲胎蛋白(alpha fetoprotein,AFP)等肿瘤标志物通常未见异常,因此影像学检查对诊断该疾病至关重要。目前,儿童SPTP相关的影像学研究较少,术前诊断率较低。现回顾分析上海交通大学医学院附属新华医院经术后病理证实的21 例SPTP 患儿的临床、病理及影像资料,总结其计算机X线体层摄影(CT)和磁共振成像(MRI)特征,以提高对儿童SPTP的术前诊断准确性。
1 临床资料
收集2010 年5 月—2020 年8 月经术后病理确诊的21 例SPTP 患儿,男2 例、女19 例;平均年龄(11.00±2.66)岁,最小7岁、最大15岁;行CT平扫+增强检查19例,行MRI平扫+增强检查2例,同时行CT平扫+增强及MRI平扫+增强检查5例。
21例患儿的首发临床表现:2例无明显症状,外伤后偶然发现;19例有临床症状,依次表现为腹部包块6例、腹痛13例。17例患儿术前检测血AFP、CA199、CA125、CEA、神经元特异性烯醇化酶(neuronspecif ic enolase,NSE)均无异常升高,3 例CA 199 升高,1 例CA199和CA125均升高。
术前CT检查采用Siemens Somatom Def inition双源64 层螺旋CT 机。患儿采取仰卧位,扫描时嘱患儿屏气,扫描范围为膈顶至盆腔入口水平。扫描参数:层厚5 mm,管电压120 kV,管电流平扫为80 mA,增强为100 mA。对比剂采用欧乃派克(300 mgI/mL),剂量为2 mL/kg,使用高压注射器以2 mL/s的流率经肘前静脉注射,分别于注射对比剂后20 s、70 s采集动脉期、门脉期图像。对原始数据进行1 mm层厚重建及图像后处理。所有CT 图像由2 位经验丰富的放射科医师独立阅片观察,记录一致的观察结果,意见不一致时由第3 位高年资影像科医师阅片,通过讨论达成共识。分别观察,①肿瘤部位:胰腺头部、胰腺颈部、胰腺体尾部;②病灶大小:选取病灶最大横截面的最长径;③肿瘤形态:类圆形、椭圆形或分叶形;④病灶成分:完全实性、完全囊性、囊实混合性,其中囊实混合性分为囊性为主型(囊性区域>70%)、实性为主型(囊性区域<30%)、囊实相仿型(囊性区域30%~70%)[3];⑤动态增强模式;⑥病灶边界及密度:边界是否清楚,有无包膜及包膜是否完整,有无瘤内出血、钙化及钙化位置;⑦胆道、胰管梗阻或扩张情况(主胰管扩张直径>3 mm,胆总管扩张直径≥1 cm),有无胰腺实质萎缩;⑧有无血管侵犯,与周围组织关系及有无转移,并与病理对照分析。
术前MRI 检查采用Signal 3.0 MR 扫描仪。患儿采取仰卧位,扫描序列包括横断面T1WI FIRM序列、横断面RTr fs T 2 WI FRFSE 序列(TR 2 560 ms、TE 85ms),层间距2.0 mm,层厚6.0 mm;横断面DWI(TR 1 825ms、TE minimum)。增强扫描对比剂采用钆塞酸二钠(Gd-EOB-DTPA),剂量为0.1mmol/kg,注射后行横断面、冠状面扫描。
术前影像学检查显示,21 例患儿肿瘤均呈囊实性,其中实性为主型9例(42.9%),囊实相仿型10例(47.6%),囊性为主型2 例(9.5%)。19 例患儿行CT平扫+增强检查,CT平扫呈不均匀等密度-低密度,实性部分其CT(hounsf ield units,HU)值为(38.89±7.39)HU,2例(9.5%)伴有钙化。CT增强扫描实性成分呈渐进性强化,动脉期轻度强化,CT值为(56.95±12.65)HU;门脉期强化更明显,CT 值为(80.63±20.74)HU。以实性成分为主者多表现为边界清楚的实体瘤内部散在不强化小囊变区(图1中B~D);囊实性成分相当者表现为明显不均匀强化,高密度的实性成分呈片状漂浮在低密度无强化的囊性灶中(图2 E),部分患儿的囊性成分位于中央,实性成分呈结节状位于周边;以囊性成分为主者表现为囊壁轻度强化,囊内成分未见明显强化。
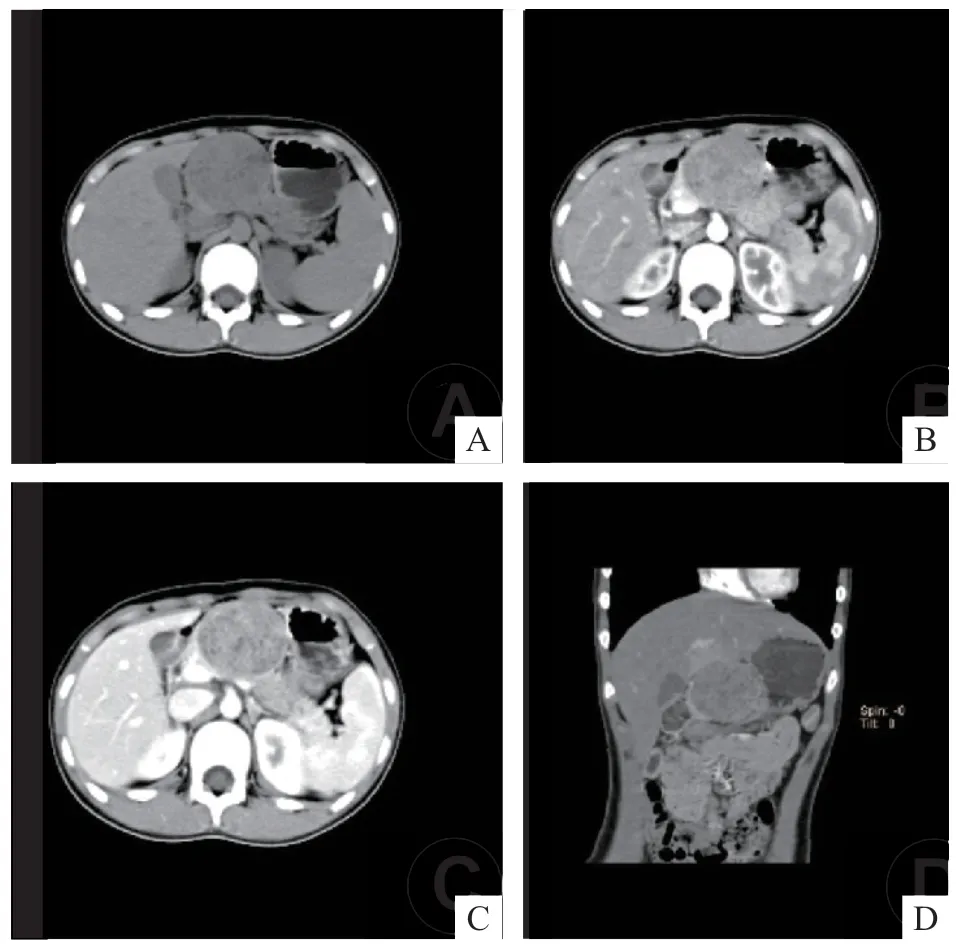
图1 患儿术前CT 检查结果(女,12 岁,因腹部包块就诊)
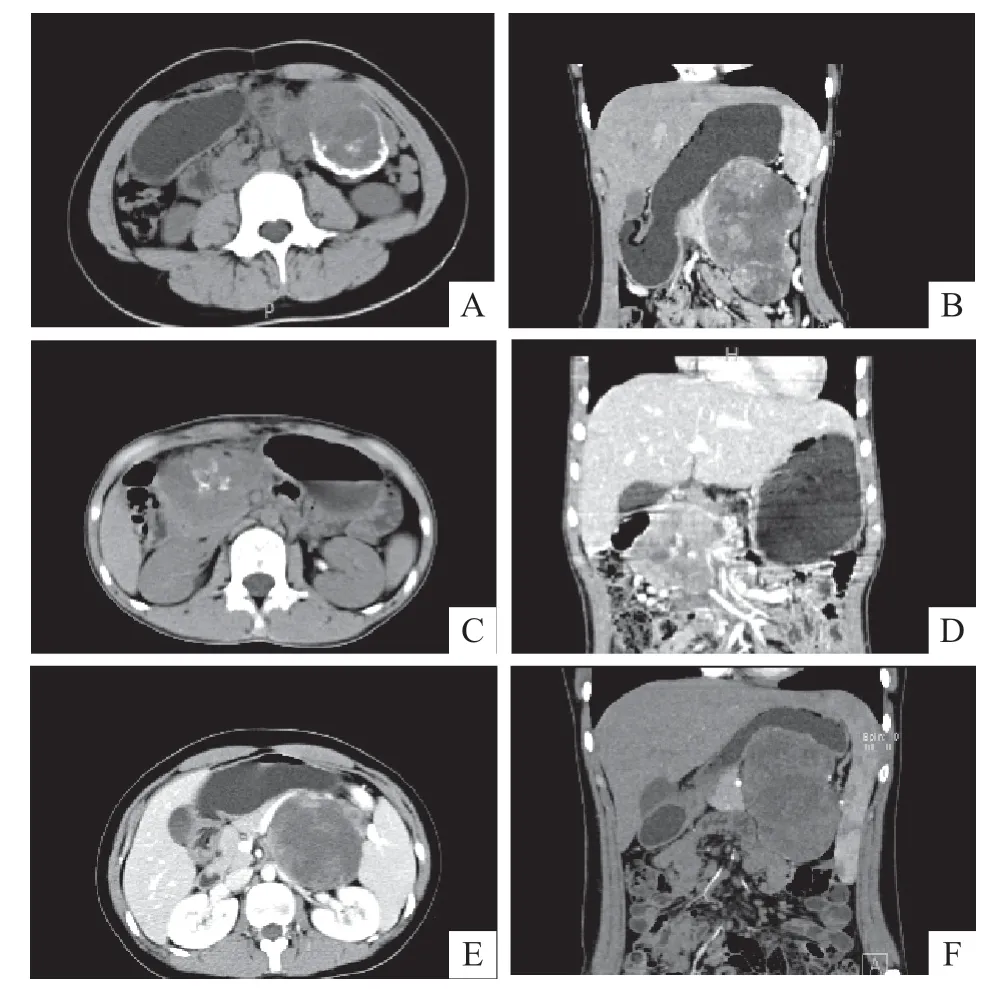
图2 恶性SPTP 患儿CT 检查结果
7例患儿行MRI平扫+增强检查。4例囊实性成分相当,T1WI以低信号为主,其中2例呈高低混杂信号,内见高信号出血灶(图3);T2WI均呈混杂高信号,边缘可见低信号包膜;DWI呈不均匀高信号;增强后为明显不均匀强化,病灶周边及内部实性成分呈渐进性强化,囊性成分不强化。1例以囊性成分为主呈T1WI等低信号,T2WI稍高信号,DWI稍高信号,增强后内部无明显强化,周围见厚壁样强化(图4D)。2例以实性成分为主,呈T1WI稍低信号,T2WI混杂高信号,DWI高信号,增强后轻度强化,内散在斑片状无强化区,1例可见边缘强化。
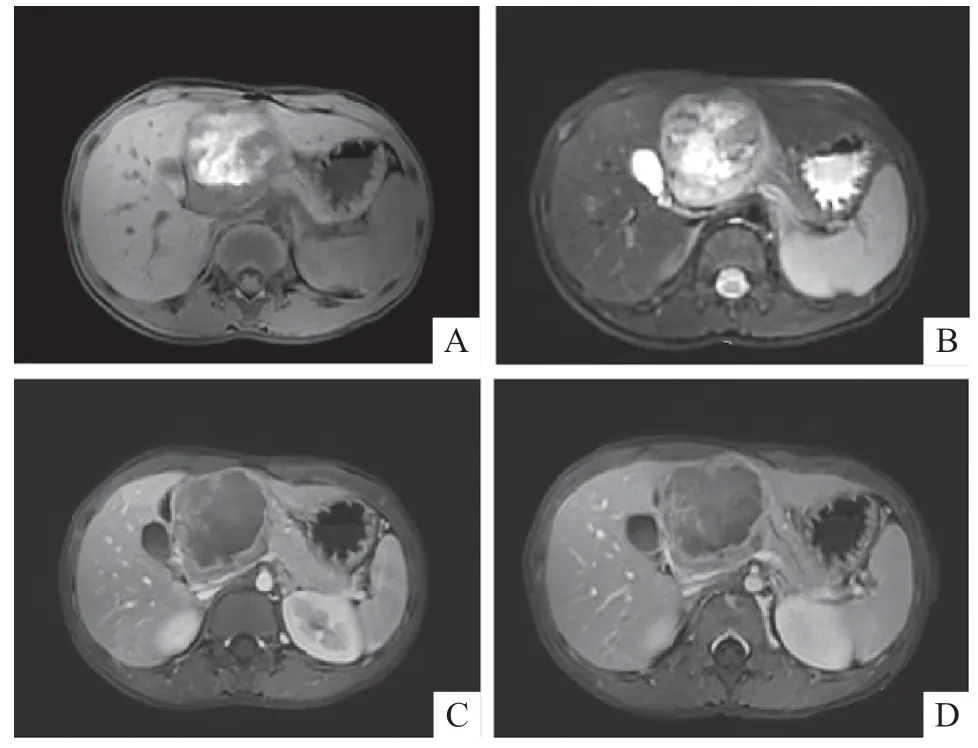
图3 患儿术前MRI 检查结果(女,9 岁,因撞击出现腹部隐痛就诊)
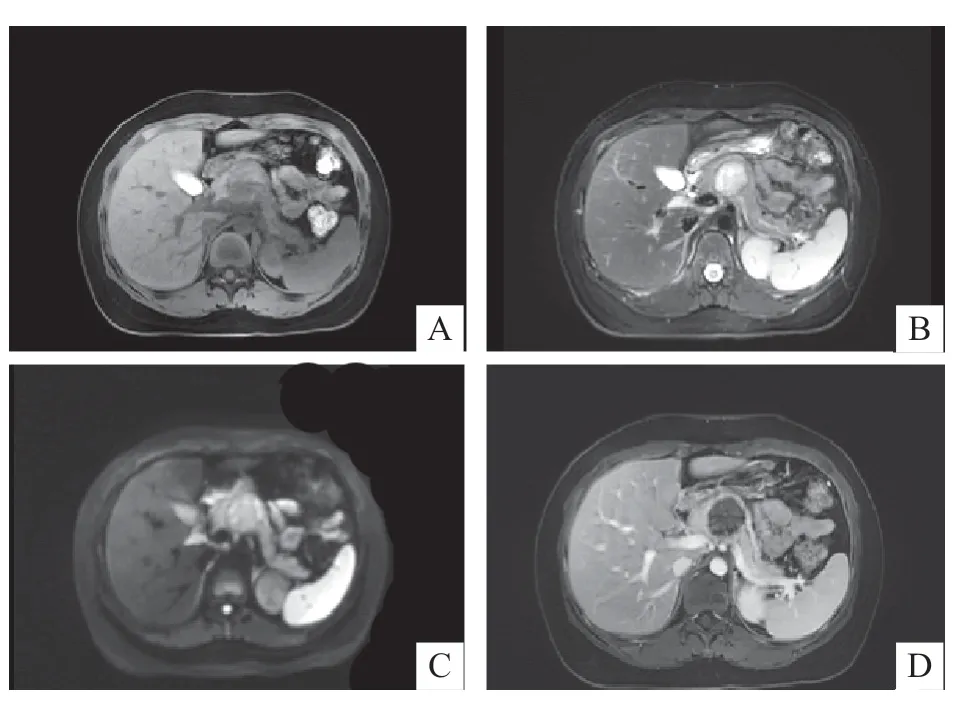
图4 患儿术前MRI 检查结果(男,11 岁,因腹痛就诊)
21 例患儿的病灶均为单发,最大径中位数5.80(5.00~7.31)cm;14例(66.7%)发生于胰腺体尾部,5例(23.8%)位于胰头部,1例位于胰腺尾部、脾脏与左肾之间,1例位于胰颈部。4例(19.1%)患儿出现胆总管或胰管轻度扩张,其中2例位于胰头部,2例位于胰腺体部。1例患儿出现胰腺体尾部萎缩。
21例患儿均接受手术切除,术中见肿瘤侵犯邻近组织、器官5例(23.8%),分别为肝脏转移2例,其中1例患儿术后5年出现肝脏转移;侵犯脾脏血管2例;侵犯脾门及左侧肾上腺1 例。以上5 例患儿的肿瘤最大径均>5 cm,局部包膜不完整,边界欠清;4例位于胰腺体尾部,1 例位于胰头;3 例囊实性成分相当,肿瘤呈分叶状(图2B、D、F),其中2例伴钙化,2例伴瘤体内出血;另2例以实性成分为主。
11 例患儿病理、手术或MRI 提示瘤体内出血。9例术前 CT 未明确诊断出血,术后病理可见出血,其中1 例患儿术中可见肿瘤上极血肿机化,考虑为陈旧性出血。2例SPTP瘤内出血,CT 平扫呈片状稍高密度影,增强未见明显强化;MRI平扫呈 T1WI 稍高信号,T2WI 稍高信号,增强后无强化。
肿瘤经手术完整切除后,进行大体标本观察。肿瘤呈类圆形或分叶状,切面见灰白、灰黄、灰红或暗红色肿块,部分伴出血。病灶切面呈囊性、部分囊性或微囊性,质嫩或质中。包膜完整者,边界清楚。光镜下可见被覆上皮细胞呈实性巢状或围绕血管轴心呈乳头样等结构排列,浸润性生长。肿瘤细胞中等大小,形态较一致,多呈圆形。染色质细腻,胞浆嗜酸性或空泡状,核分裂像不明显,间质局灶透明变性(部分区域黏液变性,部分区域玻璃样变)。部分肿瘤伴间质纤维组织增生。肿瘤大多呈类圆形或椭圆形16例(76.2%),部分呈分叶状5例(23.8%)。包膜完整者12例,边界清晰;7例包膜局部不完整;2例无明显包膜。21例行苏木精-伊红(HE)染色和免疫组织化学染色,观察标本病理组织形态特点,检测孕激素受体(progesterone receptor,PR)、抗体波形蛋白(vimentin,Vim)、白细胞分化抗原10(cluster of differentiation 10,CD10)、α 1-抗胰蛋白酶(α 1-antitrypsin,α 1-AT)、突触素(synaptophysin,SYN)、β连环蛋白(β-catenin,β-CAT)、NSE 等指标阳性表达情况。21 例患儿中,10 例PR、Vim、CD10、α1-AT、NSE均表达为阳性,13例β-CAT表达阳性,8例SYN表达阳性。
2 讨论
目前SPTP 的起源及发病机制尚不清楚,免疫组化结果Vim、CD10、α1-AT、SYN的特征性表达提示其为多潜能干细胞起源[4]。鉴于肿瘤好发于女性,以此推测肿瘤与性激素水平密切相关,并有相关研究观察雌激素和孕激素在肿瘤中的表达。有研究结果显示,瘤体内检测到高表达水平的孕激素受体[5],但是未发现雌激素受体的存在。孕激素受体的存在提示肿瘤可能源自生殖细胞嵴或卵巢始基的相关细胞[6]。大多数研究表明[7-8],几乎所有的SPTP都包含β-CAT基因的变异,β-CAT 在核质中蓄积、E-钙黏蛋白缺失与SPTP 的发生、发展密切相关。由于CTNNBl基因3号外显子变异,导致Wnt-β CAT 信号通路异常激活,β-CAT在肿瘤细胞的细胞核中异常积累,从而促进下游靶基因转录,诱导肿瘤细胞增殖和分化。β-CAT 还可以调节E-钙黏蛋白黏附活性。E-钙黏蛋白缺失,导致瘤细胞间黏附性减低,有利于假乳头结构的形成。
SPTP 是一种少见的具有低度恶性潜能的胰腺原发肿瘤。1959年首次报道SPTP的病理形态特征,并将 其命名为乳头状囊性肿瘤。1996 年世界卫生组织(world health organization,WHO)才统一命名为SPTP。2010 年WHO 则将其归入上皮低度恶性肿 瘤[9]。以往文献报道儿童发病年龄为5~15岁,疼痛或腹部肿块是最常见的临床症状,但约15%患者可能无症状[10]。本组患儿平均诊断年龄为(11.00±2.66)岁,男女比例约1:10,多因腹痛就诊,与文献报道基本相符。研究报道,比较47例成人与12例儿童SPTP发现,成人SPTP 常位于胰腺体尾部,而儿童好发于胰头部;儿童SPTP的平均直径为8.00 cm,明显大于成人[11]。本组患儿的SPTP 以胰腺体尾部多见,最大径中位数为5.80(5.00~7.31)cm。
典型SPTP呈囊实性,CT平扫多表现为等低密度圆形、椭圆形或分叶状软组织肿块,内部密度不均匀,有时可伴钙化。MRI 平扫时,T 1 WI 多呈不均匀低信号,部分可见T1WI高信号出血灶。T2WI呈混杂高信号,DWI 呈不均匀高信号。CT、MRI 增强扫描检查表现相似,增强后表现为:①高密度实性成分悬浮于低密度无强化的囊性灶中,形成“浮云征”。有学者认为镜下实性区肿瘤组织排列成絮状,是形成“浮云征”的病理基础[4]。②部分病例囊性成分位于中央,实性成分位于外周呈壁结节,典型者可出现乳头状突起[12]。SPTP 实性部分呈渐进性强化,强化峰值多位于门静脉期,各期强化程度仍低于胰腺组织,瘤体与正常胰腺交界处呈“杯口征”改变[13]。这种延迟强化与病理学特点相关,镜下可见肿瘤实质部分由实质区、假乳头区及两者过渡区组成[14],过渡区内肿瘤细胞围绕血管形成类似血窦结构[15],此外,肿瘤间质含有大量的胶原纤维[16]导致对比剂在间质与血管之间的弥散较慢。也有学者认为囊性区域内存在尚未完全囊变的部分,如黏液变性、陈旧性出血等,导致造影剂廓清速度 缓慢[17]。
相关研究发现瘤内出血较具特征性,可作为SPTP与其他胰腺肿瘤鉴别的重要征象[18]。光镜下肿瘤细胞围绕纤维血管排列,此类血管壁缺乏支架结构,血管壁很薄,容易出血。在较小的肿瘤中,细胞片状排列占主导地位,出血和坏死发生很少,这解释了成像时相应的实性肿块外观[19]。有学者推测实性肿块可能是SPTP的初始阶段,随着肿瘤体积增大,可能会发生退变或瘤内出血[20]。CT平扫时急性出血呈稍高密度,但CT 对陈旧性出血缺乏敏感性。MRI 对肿瘤出血较敏感,T1WI 呈高信号,T2WI呈高或稍低信号,增强后无强化。本研究2例SPTP患儿的T1WI可见片状高信号,病理证实肿瘤内出血。此外,文献报道SPTP的钙化也不少见,约占30%[3]。钙化分布较具特征性,周边钙化多为肿瘤包膜钙化,呈条状或线状;实质内钙化多呈不规则或点状,属于营养不良性钙化,与间质纤维组织退变及瘤体内出血、坏死有关[16]。本研究19例患儿经CT检查,其中2例伴钙化,仅占10.5%;1例肿瘤可见包膜弧形钙化及瘤内斑点状、环形钙化,1例钙化呈斑片状位于肿瘤内部(图2A、C)。钙化的特点、分布与文献报道相似。
SPTP通常边界清晰,胰腺组织受压形成假包膜,并伴有纤维化改变。大约2/3的病例可见包膜[20]。包膜血管丰富,CT 增强扫描表现为线样稍高密度影;MRI平扫呈T1WI或T2WI低信号,增强扫描后边缘强化[21]。本研究21例患儿,12例显示完整包膜,与文献报道相仿。
SPTP 肿瘤质地柔软,表现出明显外生性生长的特点,即使位于胰头,也较少引起胰胆管扩张和黄疸。本研究4 例患儿有胆总管或胰管轻度扩张(其中2 例位于胰腺头部,2 例位于胰腺体部),可能是由于肿瘤较大、生长时间较长等慢性肿块效应所致,而不是恶性肿瘤侵袭胰胆胰管引起。
文献报道,典型SPTP 体积均>3 cm[16]。不典型SPTP 有两种情况:①肿瘤体积≤3 cm,呈实性表现,位于胰腺近端,边界清晰且无包膜;②肿瘤体积> 3 cm,呈完全实性、完全囊性或实性包含微小囊变(囊性成分小于肿瘤体积的10%)。提示肿瘤大小与肿瘤成分有一定相关性[12,22]。当为完全囊性时,边界清楚,肿块密度或信号均匀,增强后囊壁轻度强化[13]。本研究患儿均为囊实性肿块,囊实性成分比例不一,与报道相符[4]。囊实性成分相当者,具有典型SPTP影像学表现,最大径均>5 cm;以实性成分为主者约占42.9%,最大径范围3~10 cm,常伴散在小囊变区;以囊性成分为主者,类似囊肿改变,但囊壁通常 较厚。
若肿瘤侵及周围组织结构,或发生远处转移,多提示肿瘤恶变[23]。目前为止,关于预测SPTP 恶性潜能的影像学特征还存在争议。研究发现SPTP 体积> 5 cm高度提示肿瘤具有恶性潜能[9]。研究表明缺乏完整包膜、界限不清、形状不规则、呈局灶性或偏心性分叶状是预测侵袭性SPTP的影像学特征[24-25];其中缺乏完整包膜和年龄>40.5岁是侵袭性SPTP的独立危险因素。本研究患儿5例为恶性SPTP,体积均>5 cm,包膜局部显示不清、欠完整,3例呈分叶状,与文献报道一致[25]。包膜不完整提示肿瘤突破包膜向周围组织侵犯。也有文献报道,男性患者也是SPTP具有恶性潜能的预测因子[26]。但是也有发现,SPTP 的恶性潜能不能通过年龄、性别、肿瘤大小、钙化、瘤内出血或肿瘤标志物来预测[27-28]。本研究中2例钙化者均出现在恶性SPTP病灶中,钙化是否提示肿瘤恶性潜能,需要更多的病例验证。
外科手术是SPTP 的主要治疗方法,接受手术切除患者的平均8年存活率达85%[29]。约10%~15%出现远处转移或复发[30],其中以肝转移瘤最为常见,门静脉、脾脏也是常见的转移部位,其余器官(十二指肠、网膜、结肠、肺、腹膜和血管)也可受累[31]。
儿童SPTP 主要需与胰腺假性囊肿、胰母细胞瘤相鉴别。胰腺假性囊肿常有慢性胰腺炎或胰腺创伤的病史,多为单房,无分隔及实性成分,囊内密度均匀,增强后囊壁可强化[32],但SPTP囊壁通常较前者稍厚。胰母细胞瘤平均发病年龄约为5 岁,好发于胰头部。SPTP平均发病年龄较大,好发于胰腺体尾部,有性别差异,女性多发。胰母细胞瘤呈浸润性生长,常伴远处转移[33],而SPTP远处转移罕见,周围胰腺组织很少受累。当胰母细胞瘤囊变、坏死明显时易误诊为SPTP,但胰母细胞瘤易侵犯邻近血管,可见内部或边缘扭曲小血管影,这有助于与SPTP的鉴别。此外,胰母细胞瘤可有AFP、CEA的增高,其中AFP升高对胰母细胞瘤的诊断具有一定的特异性[34]。
综上所述,儿童SPTP好发于女性。影像学表现具有一定特征性,通常表现为类圆形、边界清楚、具有完整包膜的囊实性肿块,可伴有钙化及出血。囊实性成分相当者表现通常较典型,呈“浮云征”;以囊性成分为主者,类似囊肿改变,囊壁较厚,增强后边缘强化;以实性成分为主者,为边界清楚的实体瘤,内部散在无强化小囊变区。肿瘤实性成分呈现渐进性强化,强化程度低于胰腺实质。当肿瘤体积较大、边缘呈分叶状伴包膜不完整时,需考虑其具有潜在恶性。结合CT与MRI检查结果对术前准确诊断SPTP具有重要意义,并且对判断其恶性潜能具有一定价值。

