基于生物信息数据研究肿瘤突变负荷在结肠癌中的临床意义
赵栋燕,孙希珍,姚树坤
结直肠癌是最常见的胃肠道恶性肿瘤之一,其发病率和病死率都很高[1]。近年来结肠癌的经济负担在发展中国家逐渐增长,预计到2030年新发病例将超过220万,死亡人数将达到110万[2]。虽然目前化疗、手术、靶向治疗、放疗等多种治疗方法可提高结肠癌患者的生存率并减少其复发,但晚期结肠癌患者5年生存率仍然很低[1]。因此,迫切需要新的治疗方法来延长患者的生命。最近在实体肿瘤的治疗策略中,以免疫检查点抑制剂为代表的免疫疗法已成为最有前途的方法之一。美国食品药品监督管理局已经批准免疫检查点抑制剂应用于实体肿瘤的治疗,如结直肠癌、肺癌、黑色素瘤等[3-4]。然而,由于肿瘤的遗传异质性,仅有小部分患者对免疫治疗呈现阳性反应。因此亟待可靠的生物标志物来预测免疫治疗的疗效。
肿瘤突变负荷(tumor mutation burden, TMB)是指体细胞基因非同义突变的分布密度,即外显子编码区域内每Mb碱基中编码错误、碱基替换、基因插入或缺失的总数。目前TMB被认为是免疫检查点抑制剂的新型生物标志物,能够预测免疫治疗的疗效[5]。有研究表明,具有较高突变负荷的肿瘤能够在肿瘤细胞表面募集到更多的新抗原,增加肿瘤的免疫原性,从而提高免疫治疗的疗效[6]。然而,结肠癌中关于TMB的研究较少。因此本研究应用癌症基因组图谱(the Cancer Genome Atlas, TCGA)探讨结肠癌的基因突变特征及TMB在结肠癌中的临床意义,报道如下。
1 资料与方法
1.1 资料获取 通过癌症基因组图谱(TCGA)数据库下载结肠癌患者399例的体细胞突变数据、基因表达数据及相关的临床数据(https://portal.gdc.cancer.gov/repository)。体细胞突变数据经过VarScan软件处理,并使用R软件(版本3.6.1)的maftools函数包进行特征性分析与可视化。
1.2 TMB的计算及预后分析 通过基于JAVA8平台的Perl脚本计算每个样本的TMB值,表达为体细胞突变总数/测序区域大小,单位为mutations/Mb。接着对TMB值降序排列,按中位数将所有肿瘤样本分为高TMB组及低TMB组,根据每个样本的临床数据采用Kaplan-Meier法绘制生存曲线,采用log-rank检验分析TMB与总生存率的关系。应用Wilcoxon秩和检验分析TMB值与临床病理参数如性别、年龄、肿瘤分期、体质量指数(BMI)等的关系。
1.3 基因富集分析 根据TMB中位数将基因转录数据分为高低2组,通过基因集富集分析(gene set enrichment analysis, GSEA)软件进行KEGG(kyoto encyclopedia of genes and genomes)和GO(gene oncology)富集分析,设定随机组合次数为1 000 次。当标准化富集分数(NES)>1、标准化显著性水平(NOM)P<0.05和矫正多重假设检验(FDR)q<0.25,则认为富集的基因集有临床意义。
1.4 TMB与浸润性免疫细胞 基于RNA-seq表达数据,本研究使用CIBERSORT函数定量分析每个肿瘤样品中22种浸润性免疫细胞的丰度,阈值设置为P<0.05。应用Wilcoxon秩和检验分析高TMB组与低TMB组浸润性免疫细胞的占比差异,并通过vioplot函数包进行数据可视化,对比分析2组之间CD8+T细胞、调节性T细胞(Treg)、M1巨噬细胞和自然杀伤细胞(NK细胞)表面标记的差异,免疫细胞标记从R&D Systems获取(https://www.rndsystems.com/cn/resources/cell-markers/immune-cells)。
1.5 TMB与免疫检查点分子 应用Wilcoxon秩和检验对比高TMB组与低TMB组之间免疫检查点分子,包括程序性死亡受体1(PD-1)、程序性死亡受体配体1(PD-L1)及细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的基因表达差异,应用Spearman相关性分析研究TMB值与免疫检查点分子表达量之间的关系。
1.6 统计学方法 采用SPSS 26.0软件进行统计学分析。运用Wilcoxon秩和检验分析2组之间的差异,采用Kaplan-Meier法与log-rank检验进行生存分析。应用R软件(版本3.6.1)及GraphPad Prism 8进行图像绘制。P<0.05为差异具有统计学意义。
2 结 果
2.1 结肠癌基因突变数据 399个结肠癌样本中有398个样本存在变异,变异数0~7 278,中位数96。错义突变和单核苷酸多态性是最常见的突变类型,突变率最高的单核苷酸变异是C>T(图1A)。瀑布图显示突变率最高的前10位基因是APC、TP53、TTN、KRAS、SYNE1、PIK3CA、MUC16、FAT4、ZFHX4、RYR2(图1B)。
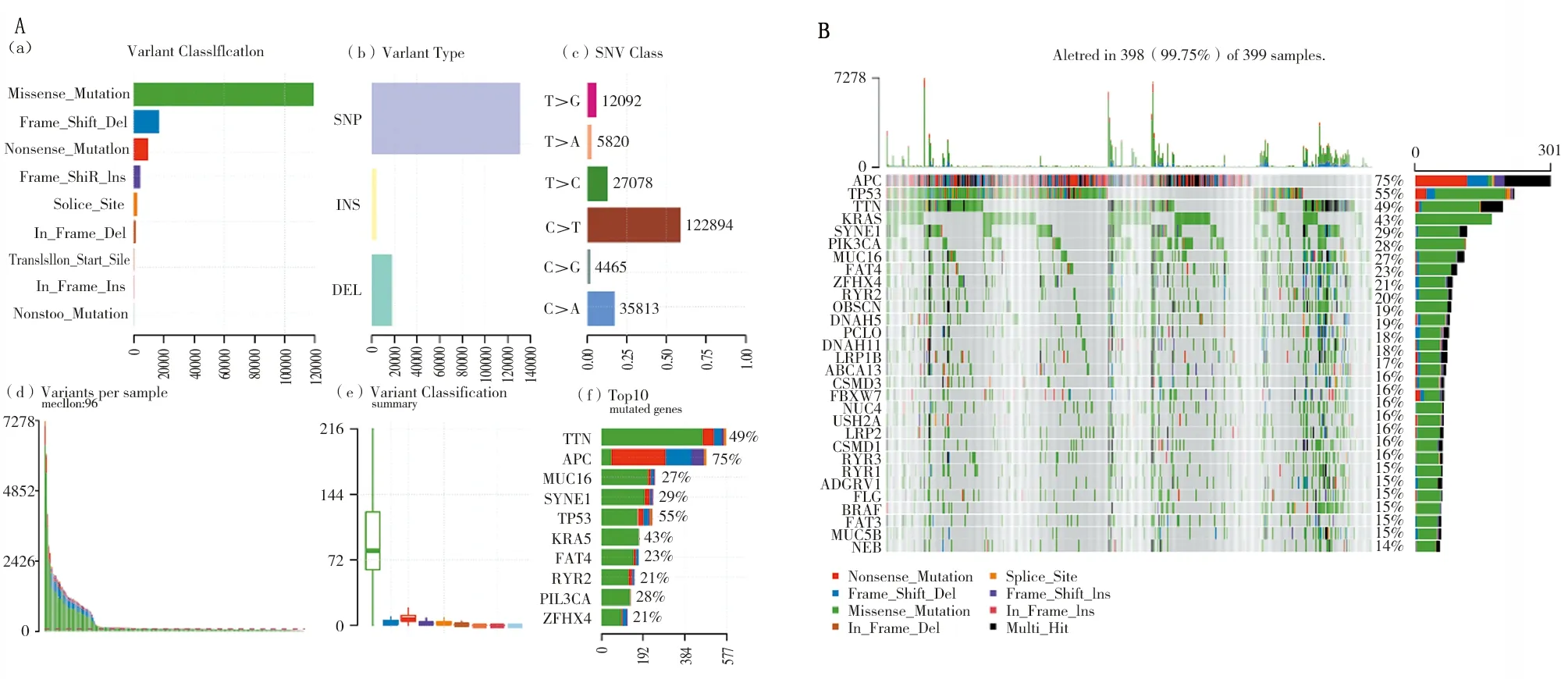
注:A.突变信息概况;(a).突变类别;(b).变异类型;(c).单核苷酸变异类型;(d).每个样本的突变数目;(e).突变类别概况;(f).十大突变基因;B.结肠癌前30个突变基因的瀑布图;SNV.单核苷酸变异;SNP.单核苷酸多态性;INS.插入;DEL.缺失
2.2 TMB在结肠癌中的预后价值 根据TMB中位数(3.132 mutations/Mb)将结肠癌样本分为高TMB组(n=207)和低TMB组(n=192),通过Kaplan-Meier法绘制生存曲线,发现高TMB组患者的生存率明显低于低TMB组患者(χ2= 5.351,P=0.021),高TMB组的5年生存率为0.574(95%CI0.468~0.703),而低TMB组患者的5年生存率为0.632(95%CI0.507~0.789)。另外,比较TMB在不同亚组间的表达差异,结果发现在年龄>65岁、BMI>28 kg/m2、肿瘤TNM分期Ⅰ~Ⅱ期及无淋巴结和无远处转移的患者中TMB表达较高(P<0.05),在性别、T分期中差异无统计学意义(P>0.05),见图2。
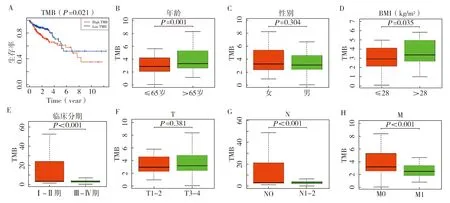
注:A.结肠癌患者TMB与总生存率的关系;B~H.结肠癌患者TMB值与性别、年龄、BMI、临床分期等临床特征的相关性分析
2.3 基因富集分析 GSEA分析提示共有18个KEGG通路(图3A)及336个GO通路(图3B,仅展示前20 个通路)在高TMB组中有不同程度的富集。这些通路及生物过程多与免疫相关:Toll样受体信号通路、产生IgA的肠道免疫网络、自然杀伤细胞介导的细胞毒性、B细胞内稳态、淋巴细胞凋亡过程等。
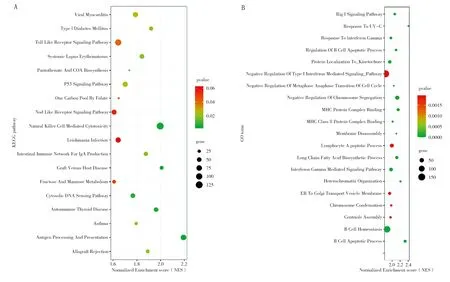
注:A.KEGG通路;B.GO通路
2.4 TMB与浸润性免疫细胞的关系 高TMB组的患者CD8+T细胞、活化的CD4+记忆性T细胞、活化的NK细胞及M1巨噬细胞的浸润程度明显高于低TMB组(Z/P=-2.151/0.032,-1.988/0.047,-3.090/0.002,-2.783/0.005),低TMB组Treg和M0巨噬细胞的浸润程度明显高于高TMB组(Z/P=-2.494/0.013,-2.114/0.035),见图4。为了进一步验证上述结果,分析了高TMB组与低TMB组之间免疫细胞表面标记的基因差异, 发现2组Treg的表面标记FOXP3与CCR8基因表达水平差异无统计学意义(Z/P=-0.309/0.757,-0.732/0.464),M1巨噬细胞的表面标记NOS2、CD80和CD86在高TMB组明显升高(Z/P=-3.006/0.003,-2.710/0.007,-2.167/0.030),CD8+T细胞的表面标记CD8A在高TMB组表达升高(Z/P=-3.242/0.001),NK细胞的表面标记KIR3DL1和CD7在高TMB组的基因表达水平显著高于低TMB组(Z/P=-2.085/0.037,-3.498/<0.001),见图5。

图4 2组22种浸润性免疫细胞的表达比较
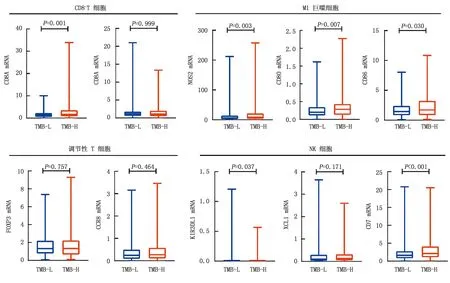
图5 2组CD8+ T细胞、M1巨噬细胞、调节性T细胞和NK细胞基因标记的表达差异
2.5 TMB与免疫检查点分子的关系 在高TMB组中,免疫检查点分子PD-1、PD-L1和CTLA-4的基因表达水平显著高于低TMB组,差异有统计学意义(Z/P=-3.489/<0.001,-4.813/<0.001,-3.363/<0.001)。相关分析结果表明,在结肠癌患者中,TMB值与PD-1、PD-L1与CTLA-4的基因表达水平均呈正相关(r/P=0.24/0.01,0.35/<0.01,0.25/<0.01),但相关性不强,见图6。
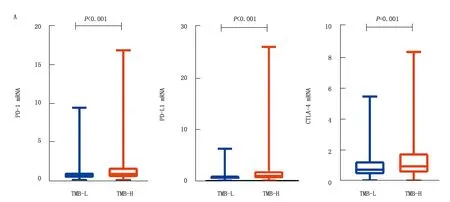
注:A.2组免疫检查点分子的基因表达差异;B.结肠癌患者TMB与免疫检查点分子的相关性分析
3 讨 论
近年来,癌症的治疗策略发生了巨大变化,新型治疗方法包括免疫治疗在内取得了较大成果。随着治疗策略的变化,具有临床可行性的肿瘤生物标志物已经从影像学资料向基因转变。既往研究揭示了几种新型生物标志物用来预测免疫检查点抑制剂的治疗效果,如PD-1/PD-L1表达、错配修复缺陷、肿瘤浸润性淋巴细胞[7]。随着高通量测序技术的发展,肿瘤突变负荷作为一种可能识别免疫治疗反应的潜在生物学标志物受到了巨大的关注。已有研究证实具有高突变负荷的肿瘤如膀胱癌与肺癌对免疫检查点抑制剂有较好的反应[4, 8]。因此,探索肿瘤突变负荷在结肠癌中发挥的作用及其与临床预后的关系具有重要意义。
在本研究中,笔者发现了错义突变、单核苷酸多态性及C>T突变是结肠癌最常见的突变类型,而这些突变类型在肿瘤的发生、发展及预后中发挥着重要作用。突变率最高的前3个基因是腺瘤性结肠息肉病基因(APC)、TP53、肌联蛋白(TTN)。APC与TP53均为抑癌基因,其突变可促进结肠腺瘤向结肠癌转变,被认为是结肠癌发生的关键[9]。TTN是目前已知最长的基因,已经证实TTN与TMB表达水平的高低及免疫治疗的反应密切相关[10]。研究这些高突变的基因在结肠癌中的作用,对于明确结肠癌的发病机制、进展过程有重大意义。
在结肠癌中,TMB与患者的生存状况及临床病理特征之间的关系尚未明确。笔者以TMB的中位数(3.132 mutations/Mb)作为分界线,将结肠癌患者分为高TMB组和低TMB组,在此基础上发现高TMB组的患者预后明显差于低TMB组,并且差异具有统计学意义(P<0.05)。另外,笔者分析了不同临床亚组间TMB的差异。突变负荷升高不仅多见于高龄肥胖的患者,还见于肿瘤早期、无淋巴结与远处转移的患者。肿瘤早期患者生存期应该较长,但此处却出现相反的结果,这可能与患者接受的治疗措施不同有关,遗憾的是此数据库并未提供每个样本的具体治疗方法。微卫星不稳定性(microsatellite instability, MSI)是一种已建立的用来预测免疫治疗效果的生物指标,其特征是错配修复蛋白MLH1、MSH2、MSH6和PMS2的缺陷。有研究表明,在高MSI的结肠癌中,突变负荷越高,患者越容易受益于免疫治疗,患者预后越佳[11]。在一个小样本结肠癌研究中,以6 mutations/Mb为临界线划分高低突变组,结果发现高突变负荷组患者化疗效果优于低突变负荷组,生存期延长[12]。可以看出,在这些研究中,高TMB是结肠癌的良好预后因素。笔者的研究结果与既往研究不同,可能是因为所采取的治疗方法不同。另外,TMB在不同肿瘤的预后价值也存在着较大的争议。在肾透明细胞癌与前列腺癌研究中,同样以中位数为界线划分高低负荷组,高突变负荷组的患者往往伴随着较差的预后[13- 14];在肝细胞癌患者中,突变负荷对患者的预后没有影响[15];而在膀胱癌患者中,突变负荷越高则意味着患者生存时间越长[16]。因此,需要大样本的研究来明确突变负荷在不同肿瘤预后中的影响。
目前,肿瘤突变负荷在结肠癌中的具体调控机制尚不清楚。在基因富集分析的结果中,高突变负荷组的富集通路多与免疫相关。有研究表明,肿瘤细胞的突变负荷表达增加,可促进细胞表面的新抗原积聚,增加其自身免疫原性,从而激活免疫细胞及其介导的抗肿瘤免疫反应[6]。在肿瘤微环境中,浸润性免疫细胞占很大比例,它们通过释放炎性细胞因子和趋化因子与肿瘤细胞相互作用,驱动癌症的生物学行为。因此,有必要探索突变负荷与肿瘤微环境中免疫细胞的潜在联系。在高TMB患者中,CD8+T细胞、CD4+T细胞、NK细胞及M1巨噬细胞的占比显著高于低TMB组,其基因标志的表达在2组之间差异也具有统计学意义,这些细胞均在抗肿瘤免疫中发挥着重要作用。有研究证实,间质细胞表达的免疫检查点分子PD-L1可抑制CD8+T细胞,从而促进结肠癌肿瘤细胞的增殖与转移[17]。CD4+T细胞是抗肿瘤免疫机制中的重要组成部分,并且与抗原处理过程密切相关,被认为是多种肿瘤的独立预后指标[18-19]。NK细胞在高TMB组显著增多,而基因富集结果提示高TMB组在NK细胞介导的细胞毒性通路中明显富集,进一步验证了此结果。巨噬细胞在肿瘤中的作用取决于自身的极化状态。M1巨噬细胞具有抗肿瘤的特性,而M2巨噬细胞则促进肿瘤的增长[20]。在高TMB组患者中,M0巨噬细胞占比下降,而M1巨噬细胞升高,可能的解释是突变负荷升高促进肿瘤细胞释放某些因子诱导M0巨噬细胞向M1极化。Treg与多种肿瘤的不良预后相关,能够有效地抑制抗肿瘤免疫反应[21]。虽然Treg在低突变负荷组显著升高,但是其标志基因在2组之间却无明显差异,因此TMB与Treg之间的关系仍需要进一步研究。从上述可知,在高突变负荷的结肠癌患者中,肿瘤微环境呈现出明显的抗肿瘤免疫状态。未来可以从肿瘤微环境入手,进一步探索TMB在结肠癌中的作用机制。
本研究还探讨了突变负荷与免疫检查点分子之间的关系。免疫检查点分子是一类能够调控免疫细胞,在免疫稳态中发挥重要作用的调节蛋白,其中常见的是PD-1、PD-L1与CTLA-4。免疫检查点分子能够抑制免疫细胞特别是T细胞的活化及其产生的抗肿瘤反应,从而使肿瘤逃避免疫监视[22]。在结肠癌中,笔者发现高TMB组患者免疫检查点分子PD-1、PD-L1与CTLA-4的基因表达均明显增高,提示免疫检查点抑制剂应用于这一类患者可能有效地恢复肿瘤微环境的免疫应答,取得良好的治疗效果。既往研究表明,在大多数肿瘤中PD-L1表达与突变负荷相互独立[8]。在结肠癌中,TMB与免疫检查点分子的基因表达相关性较弱,提示TMB在结肠癌中是独立于PD-L1的生物标志物。
本研究存在一些不足之处,仅纳入了TCGA这一个数据库,没有采用外部数据库如GEO数据库(Gene Expression Omnibus database)或其他大样本的队列进行验证;在本研究中,笔者以中位数为临界值区分高低突变负荷组,然而,如何定义突变负荷的高低水平并没有定论。在一项大样本多肿瘤的研究中,研究者将TMB分为3个亚组:高TMB组(占患者总数的50%)、中TMB组(占比40%)、低TMB组(占比10%)[23]。另外一项大规模研究中,研究人员将前20%TMB的患者定义为高突变负荷组,分析了在多种肿瘤中TMB与免疫疗效之间的关系[24]。TMB的阈值也会受到其他因素的影响,如肿瘤类型、样本类型、检测方法、样本采集过程等[22]。单纯地以中位数作为临界来划分高低突变负荷并不十分科学,需要进行关于免疫治疗的大样本临床研究,以患者的疗效作为评判标准来寻找一个能够在临床上进行推广的临界值。另外,笔者分析了TMB与浸润性免疫细胞的关系,但并没有进行基础实验在细胞和分子水平探索TMB对免疫细胞的调控机制。未来可以从这个方向出发深入研究,可能会为结肠癌的治疗提供新的方向。
综上所述,高TMB患者总生存时间短于低TMB的患者。突变负荷升高可引起肿瘤微环境中浸润性免疫细胞的成分发生明显变化,并产生抗肿瘤免疫反应。另外,突变负荷表达升高伴随着免疫检查点分子PD-1、PD-L1与CTLA-4的基因表达增高,这些结果均提示高TMB患者更有可能受益于免疫治疗。因此,TMB有望成为结肠癌预后及免疫治疗的生物标志物,为结肠癌的免疫治疗提供新的研究方向。
利益冲突:所有作者声明无利益冲突
作者贡献声明
赵栋燕:设计研究方案,统计分析,论文撰写;孙希珍:统计分析,论文修改;姚树坤:课题设计,论文终审

