miR-423-5p调控TGF-β/Smad信号通路对肺癌脑转移模型大鼠的干预作用探究
杨成,王光学,张燕飞,管宏新,魏亮,钟春龙,李钦传
原发性肺癌是我国常见的恶性肿瘤之一,其常见的远处转移部位为脑部,常见部位为大脑半球,其次为小脑和脑干[1]。目前临床上对于肺癌脑转移的发病原因尚无统一定论,认为其与宿主的患病史、个人史、精神史、其他感染等相关[2]。近年来,肺癌脑转移的发生率和诊断率呈逐年上升的趋势,且肺癌脑转移患者预后效果差,自然生存时间仅为1~2个月[3]。肺癌脑转移患者常见的临床症状为呕吐、癫痫、发作性头痛、精神及意识障碍。临床上常将手术、化疗、放疗等综合手段用于肺癌脑转移患者的治疗中,可在一定程度上延长患者生存期,提高其生活质量[4]。微小RNA(miRNA)可由肿瘤细胞主动分泌,其表达量随着肿瘤细胞的生成、凋亡而变化,故miRNA表达量在一定程度上可代表人体内健康或疾病的信息。miRNA是真核生物体内具有良好稳定性的非编码RNA,广泛参与肿瘤细胞的增殖、分化、凋亡等生理过程,还在疾病发生、生物体发育时序、细胞分化凋亡等方面起重要作用[5],但miR-423-5p在肺癌脑转移中的作用机制尚未研究。现探究miR-423-5p调控TGF-β/Smad信号通路对肺癌脑转移模型大鼠的干预作用,报道如下。
1 材料与方法
1.1 材料 (1)动物: SPF级大鼠60只,雌雄各半,由郑州大学实验动物中心提供[动物许可证号:SYXK(豫)2020-0008)],鼠龄3~6(4.75±1.19)个月,体质量226~257(229.43±26.19)g,将大鼠置于室温22~24℃,湿度40%~70%,自然光照、通风的无病原菌干净笼子中饲养,饮用的水和食物均经消毒处理。本实验经医院实验动物伦理委员会批准。(2)试药试剂:miR-423-5p慢病毒载体(滴度为1×108TU/ml)购于无锡莱弗思生物实验器材有限公司;酶联免疫试剂盒购于武汉纯度生物科技有限公司;TGF-β1、COl-1抗体购于上海恒斐生物科技有限公司;Smad2/3、Vimentin抗体购于武汉益普生物科技有限公司。(3)仪器设备: OLYMPUS CX23光学显微镜、Primer 5.0软件上海普赫光电科技有限公司产品。
1.2 实验方法 2019年2月—2020年1月于同济大学附属东方医院转化医学研究中心进行实验,
1.2.1 肺癌脑转移建模:在60只大鼠中随机数字表法选取15只作为空白组,其余大鼠随机分为模型组、上调组、下调组各15只,参照陈愉生等[6]肺癌脑转移模型建立方法造模,除空白组外,其余3组大鼠均经麻醉、仰卧位固定、消毒后,于胸骨左缘第二肋间旁开2 mm处进针3~5 mm,进针前调好BD针头至滞留空气0.05 ml左右,吸取肺癌细胞悬液0.1 ml(1×106个肿瘤细胞),观察到血液喷射涌出作为进入左心室的标准,并在10 s内完成注射,注射完成后快速拔针,棉签按压进针点。参照文献[7]判断肺癌脑转移建模结果(图1):模型组建模成功11例,上调组建模成功12例,下调组建模成功14例。
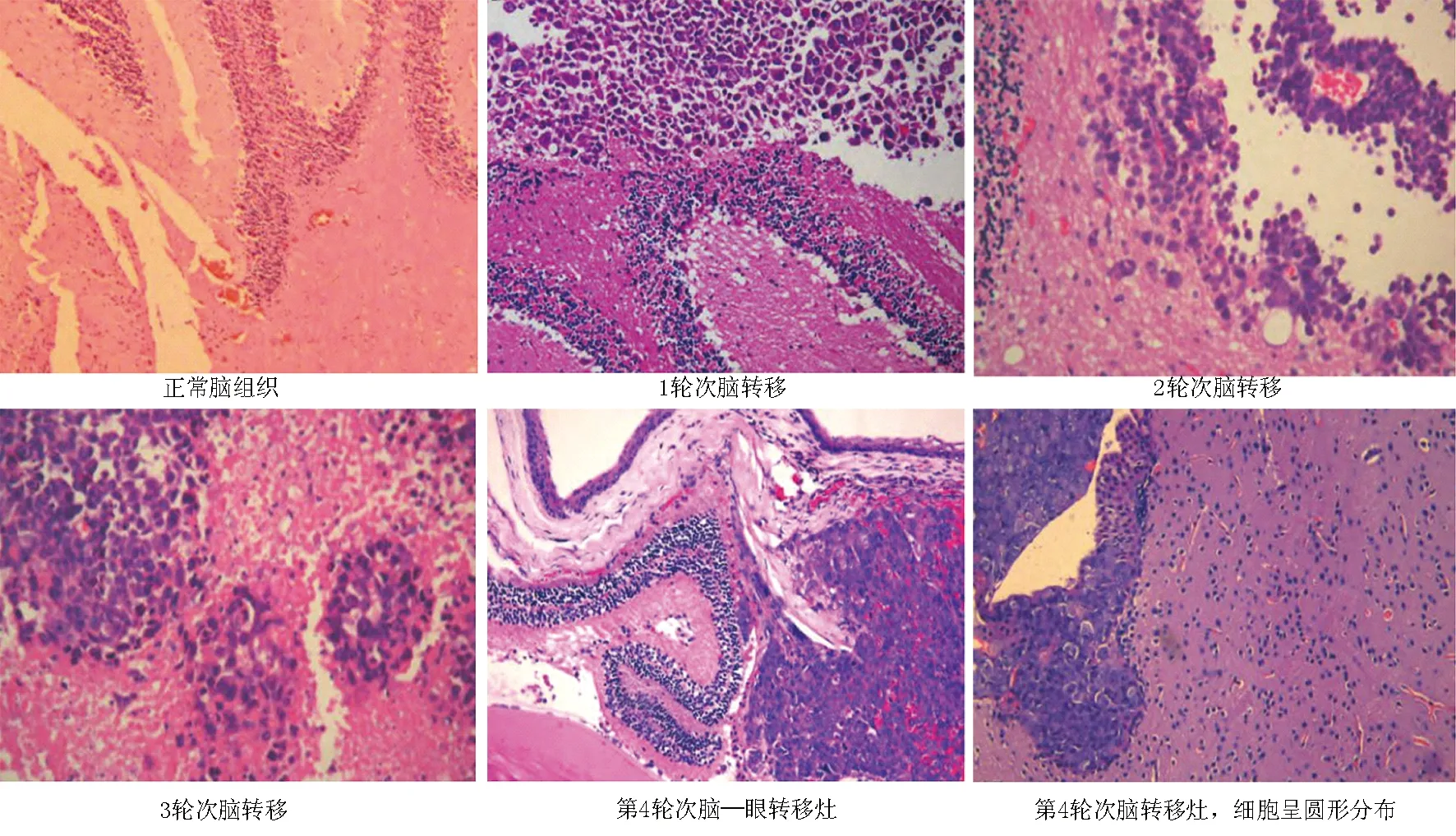
注:1、2、3轮次脑转移,病灶血供随轮次增加而增加;第4轮次脑转移灶提示脑转移模型建立成功
1.2.2 干预方法:建模成功后上调组、下调组大鼠分别尾部静脉注射miR-423-5p mimics control 10 μl、 miR-423-5p mimics 10 μl,空白组、模型组大鼠尾部静脉注射等体积生理盐水,miR-423-5p干预14 d后观察各组大鼠变化。
1.3 观察指标与方法
1.3.1 样本采集:在miR-423-5p干预后取大鼠脑组织行HE染色。抽取大鼠尾部静脉血2 ml,离心留取血清,置于-20℃冰箱待用。将大鼠胸腔打开,夹闭双侧肺门,结扎左右主支气管,在左主支气管近端刺入套针,使用4℃无菌肝素盐水15 ml分3次灌入左肺,每次盥洗2遍,回收肺泡灌洗液10~15 ml,离心待用。游离结扎处大鼠双肺,采用4%多聚甲醛固定左肺下叶组织,15% EDTA脱钙、脱水后进行石蜡包埋,制作厚约3 μm组织切片。
1.3.2 肺组织病理观察:取各组大鼠左肺下叶组织样本进行HE染色处理,在光学显微镜下观察大鼠肺组织病理变化。
1.3.3 采用RT-PCR法检测肺组织中miR-423-5p表达量:将Trizol 1 ml加至肺组织中并研磨为粉末后提取总RNA并检测其纯度和浓度,使用Takara逆转录试剂盒进行逆转录处理后,反应条件:37℃反转录60 min;85℃灭活酶5 s,95℃预变性30 s,95℃变性5 s,60℃退火20 s,40个循环,使用Primer 5.0软件对引物序列进行设计,miR-423-5p引物序列上游:5'-GGGTCTTGGAGTAGGTCATT-3',下游:5'-CAGTGCGTGTCGTGGAG-3';内参基因GAPDH引物序列上游:5'-AACAGCCTCAAGATCATCAGCAA-3',下游:5'-GACTGTGGTCATGAGTCCTTCCA-3'。
1.3.4 血清CEA、SCC-Ag、CYFRA21-1和肺泡灌洗液TNF-α、IL-1β、IL-6检测:采用酶联免疫吸附法检测各组大鼠血清癌胚抗原(CEA)、鳞状细胞癌相关抗原(SCC-Ag)、细胞角蛋白19血清片段21-1(CYFRA21-1)水平,肺泡灌洗液中TNF-α、IL-1β、IL-6水平,将样本置于室温、制备样品;在反应孔上依次加入稀释好的待测样本及标准品100 μl /孔,37℃恒温孵育箱中湿育2 h;用专用洗涤液将反应板清洗3次,加入抗体工作液(1∶100稀释后)100 μl/孔,37℃恒温孵育箱中湿育45 min;反应板清洗4次,在反应孔内加入TMB溶液100 μl/孔,37℃恒温孵育箱中湿育45 min后,将终止液100 μl/孔加入反应孔内终止反应,在450 nm处读OD值;以OD值为纵坐标,以标准品为横坐标,绘制标准曲线,根据样本的OD值可在标准曲线上查出CEA、SCC-Ag、CYFRA21-1、TNF-α、IL-1β、IL-6水平。
1.3.5 TGF-β/Smad信号通路蛋白表达量检测:采用Western-blot法检测TGF-β/Smad信号通路蛋白表达量,将采集到的样本研磨加入蛋白缓冲液,提取各组细胞蛋白并使用BCA法测定浓度,制备电泳样品,上样量50 μg进行SDS-PAGE电泳,蛋白转至PVDF膜,加入脱脂奶粉封闭1 h,一抗4℃ 孵育过夜,洗膜3次(5 min/次),二抗室温孵育1 h,洗膜3次(5 min/次),加入发光液曝光3~4次,取重叠值。采用软件分析蛋白条带灰度值,内参蛋白为Actin。

2 结 果
2.1 各组大鼠肺组织病理变化比较 空白组大鼠肺泡结构完整,肺泡壁薄、间隔正常,未出现炎性细胞浸润、肉芽肿的形成;模型组大鼠肺泡结构损伤,部分肺泡萎陷或消失、间隔增厚,在肺泡腔和肺泡间质中出现显著的单核细胞、巨噬细胞等炎性细胞浸润;上调组大鼠肺间质存在大量的炎性细胞浸润,肺组织损伤严重,大量肺泡出现萎缩、塌陷现象;下调组大鼠肺炎性细胞浸润和肺泡结构损伤减轻,肺隔膜变薄,肺泡浸润基本恢复正常,见图2。
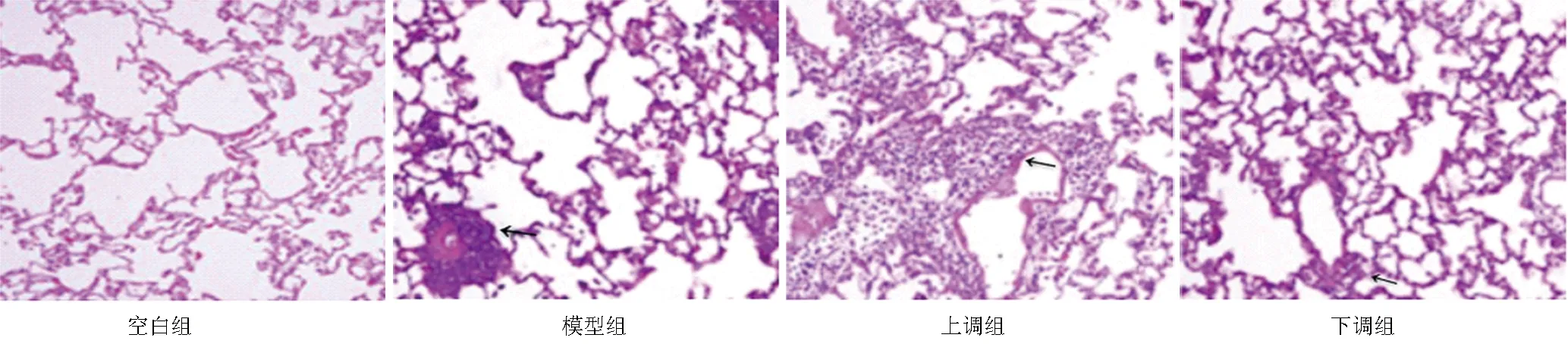
图2 各组大鼠肺组织病理学比较(HE染色,×400)
2.2 各组大鼠miR-423-5p表达量比较 与空白组miR-423-5p表达量(1.08±0.34)比较,模型组(2.34±0.71)升高(t/P=6.026/0.001);与模型组比较,上调组(3.75±1.21)升高,下调组(0.64±0.19)降低(t/P=3.366/0.003、8.620/0.001),且下调组低于上调组(t/P=9.513/0.001)。
2.3 各组大鼠血清CEA、SCC-Ag、CYFRA21-1水平比较 与空白组比较, 模型组CEA、SCC-Ag、CYFRA21-1水平均升高(t/P=10.900/0.001、10.050/0.001、8.267/0.001);与模型组比较,上调组上述指标均升高,下调组均降低(t/P=2.992/0.008、3.521/0.002、2.694/0.014,3.443/0.002、2.416/0.024、2.279/0.032),且下调组均低于上调组(t/P=5.936/0.001、5.819/0.001、4.833/0.001),见表1。
表1 各组大鼠血清CEA、SCC-Ag、CYFRA21-1水平比较
2.4 各组大鼠肺泡灌洗液TNF-α、IL-1β、IL-6水平比较 与空白组比较,模型组TNF-α、IL-1β、IL-6水平均升高(t/P=6.519/0.001、8.841/0.001、10.630/0.001);与模型组比较,上调组上述指标均升高,下调组均降低(t/P=2.277/0.033、2.822/0.010、2.727/0.034,2.622/0.015、5.369/0.001、2.433/0.023),且下调组均低于上调组(t/P=4.465/0.001、7.416/0.001、4.114/0.001),见表2。

表2 各组大鼠肺泡灌洗液TNF-α、IL-1β、IL-6水平比较
2.5 各组大鼠TGF-β/Smad信号通路蛋白表达量比较 与空白组比较,模型组TGF-β1、COl-1、Smad2/3、Vimentin蛋白表达量均升高(t/P=5.921/0.001、7.920/0.001、4.979/0.001、5.236/0.001);与模型组比较,上调组以上指标均升高,下调组均降低(t/P=2.936/0.008、3.666/0.001、2.461/0.023、2.519/0.020,5.443/0.001、3.140/0.005、3.071/0.005、2.455/0.022),且下调组均低于上调组(t/P=7.320/0.001、6.479/0.001、5.504/0.001、4.880/0.001),见表3、图3。
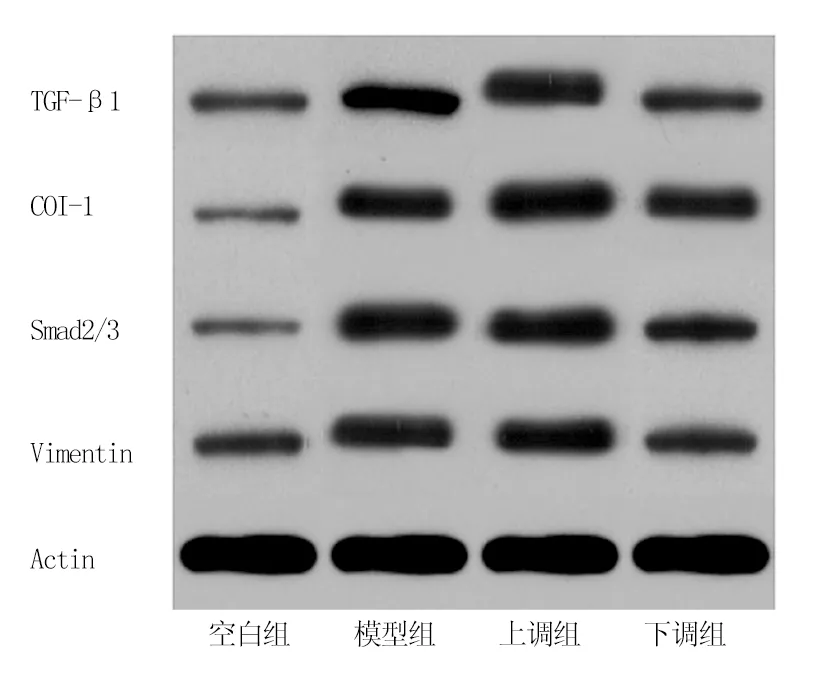
图3 各组大鼠TGF-β/Smad信号通路蛋白印迹比较

表3 各组大鼠TGF-β/Smad信号通路蛋白表达量比较
3 讨 论
肺癌脑转移是临床常见而严重的疾病,其原因多为肺组织淋巴和供血丰富,癌细胞易从邻近的淋巴管或血管转移至远处器官,肺血管和椎静脉间常有吻合支,脱落的肺癌细胞可不经肺部毛细血管的过滤而直接入脑,增大其转移至脑部的几率[7-8]。miRNA是部分哺乳动物体内一类单链分子,对蛋白编码基因具有调控作用。miR-423-5p起初在心力衰竭等疾病中发现,孙丽丽等[9]研究中,miR-423-5p来源于心肌细胞,且在慢性心力衰竭患者体内水平显著升高,提示其可能参与慢性心力衰竭的发生、发展,具有较高敏感度,可作为评估病情严重程度的生物标志物,且其水平越高,提示心力衰竭进展较快。有研究显示[10],miR-423-5p在卵巢癌中呈高表达,其原因可能为其可提高癌细胞的克隆形成率及侵袭细胞比例,促进异种移植瘤的生长。在本研究中,前期工作中发现miR-423-5p与肺癌脑转移密切相关,故深入探究下调miR-423-5p通过作用于TGF-β/Smad信号通路对肺癌脑转移模型大鼠的干预作用,可为肿瘤的早期无创性诊断开辟一条新途径。
CEA属于糖蛋白,结构复杂,可参与不同类型癌症的发病、发展过程[11]。在侯志华等[12]研究中,CEA在非小细胞肺癌伴脑转移患者体内呈高表达,但经治疗后其水平降低,与本研究结果一致。在孙杰等[13]研究中,CEA可作为肺癌的肿瘤标志物,且其水平变化与肿瘤细胞的增殖相关,肿瘤晚期其水平更高。SCC-Ag属于肿瘤相关抗原,分布于肺部肿瘤组织中,且在鳞状细胞癌中分布更为广泛。在覃远静等[14]研究中,SCC-Ag是一种肿瘤抗原,主要存在于肿瘤病灶内,在鳞状细胞癌中的诊断敏感度极高。CYFRA21-1是角蛋白家族成员之一,主要储存在复层肿瘤上皮细胞质内,在细胞癌变、凋亡或溶解后会进入血液中,导致血液中其水平升高[15]。在赵雪莲等[16]研究中,CYFRA21-1是一种具有较高敏感性、特异度的鳞癌标志物,可用于判断肺癌脑转移及监测发展过程。本研究结果显示,CEA、SCC-Ag、CYFRA21-1水平与肺癌脑转移密切相关,其原因可能为上述3个指标均为肿瘤的重要标志物,三者联合对肺癌脑转移的发生发展预测价值更高。
TGF-β/Smad信号通路在调控干细胞活性和器官形成中具有重要作用,当TGF-β信号通路各成员活性未激活时,体内会自发性发生多种癌症,这表明TGF-β定向调节干细胞对癌症形成具有不可或缺的功能[17-18]。TGF-β1在TGF家族中为最经典的转化生长因子。Smad2蛋白在浸润癌细胞、良性肿瘤细胞、癌前病变上皮细胞中呈低表达,但在结肠癌、乳腺癌等恶性肿瘤中呈高表达,且其水平随肿瘤分化程度增高而增高[19-20]。在王春刚等[21]研究中,TGF-β可通过与其受体相结合,将细胞外信号传递至细胞内,进而活化Smad2、Smad3与Smad4形成复合物移位至细胞核作为基因转录反应,调控肿瘤细胞的生物功能。有研究显示[22],上调Vimentin的表达,肺癌细胞系的迁移能力显著增强,促进非小细胞肺癌的浸润和转移。在甘声通等[23]研究中,TGF-β信号通路可促进上皮—间质转化和血管生成,促使非小细胞肺癌侵袭转移,抑制此信号通路具有良好的临床应用前景。本结果显示,下调miR-423-5p可通过作用于TGF-β/Smad信号通路,阻断延缓肺癌脑转移的发生发展,其原因可能为下调miR-423-5p对TGF-β/Smad信号通路相关信号分子具有抑制作用,阻碍此信号通路的激活、细胞外信号传递至细胞内,抑制肿瘤细胞生物活性。
综上所述,下调miR-423-5p可能通过作用于TGF-β/Smad信号通路,下调TGF-β1、COl-1、Smad2/3、Vimentin蛋白表达量,减轻炎性反应,抑制肺癌脑转移的发生发展。
利益冲突:所有作者声明无利益冲突
作者贡献声明
杨成、魏亮:设计研究方案,实施研究过程,论文撰写;王光学、张燕飞:提出研究思路,分析试验数据,论文修改;管宏新:实施研究过程,资料搜集整理,论文撰写,统计学分析;钟春龙、李钦传:课题设计,论文审核

