DC-CIK联合化疗对结直肠癌根治术后肝转移患者疗效及对TRF1和TRF2表达的影响
朴龙镇,金兰,李滕,胡乌云,梁雪
结直肠癌是临床最常见的恶性肿瘤,具有较高的发病率和病死率,并呈逐年增长趋势,已成为威胁人类健康的杀手之一[1-2]。结直肠癌根治术是临床上重要治疗手段之一,一般患者预后较好,但约50%患者会发生术后转移,其远处转移最常见部位为肝脏,若不采取有效治疗,其5年生存率不足10%,因此提高其生存率,控制肝转移是临床的重大挑战[3-4]。端粒功能失调是引发癌症的重要分子机制之一,端粒长度与结构的改变在直肠癌根治术后肝转移发生发展过程中具有重要作用[5]。端粒重复序列结合因子1(TRF1)和TRF2对维持端粒的结构及实现其功能具有重要意义[6]。树突状细胞—细胞因子诱导的杀伤细胞(DC-CIK)免疫技术是一种细胞生物免疫治疗方法,是一种新抗肿瘤模式,目前已成为应用最为广泛的生物治疗手段之一[7]。现对结直肠癌根治术后肝转移患者给予DC-CIK联合化疗,观察其疗效及对TRF1和TRF2表达的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2014年1月—2015年3月延边大学附属医院肿瘤科收治晚期结直肠癌伴肝转移患者98例,按随机数字表法分为对照组(49例)和观察组(49例),2组患者性别、年龄、BMI、肿瘤原发部位、肝转移灶大小、数目比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会审核批准,患者及家属知情同意并签署知情同意书。

表1 2组患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①符合结直肠癌的诊断标准[8];②患者均发生肝转移;③生存期>8周,均为单侧病灶。(2)排除标准:①伴有精神类疾病者;②拒绝配合,依从性极低者。
1.3 治疗方法 对照组患者采用XELOX方案(奥沙利铂+卡培他滨)化疗:奥沙利铂(江苏恒瑞医药股份有限公司生产)130 mg/m2,d 1;卡培他滨(江苏恒瑞医药股份有限公司生产)1 g·m-2·d-1,2次/d,d 1~21,21 d为1个周期。观察组在对照组基础上,第2次静脉化疗结束后第7天连续3 d采用静脉回输自体DC-CIK细胞,每次输注>3×109个DC-CIK细胞,每疗程输注细胞总数>1×1010个。回输完毕后,再次使用生理盐水冲管,确保细胞回输数量。
1.4 观测指标与方法
1.4.1 CD3+、CD4+、CD8+T细胞测定:治疗前后,采集患者空腹肘静脉血3~5 ml,分离提取血清,采用流式细胞仪(美国BD公司生产)测定CD3+、CD4+、CD8+T细胞。
1.4.2 肝脏TRF1和TRF2表达检测:治疗前及治疗后1个月,穿刺患者肝脏活检,采用免疫组化染色法检测肝脏TRF1和TRF2表达水平,相关试剂由美国Novus Biologicals公司提供。显微镜下细胞呈棕黄色则判断为阳性。随机抽取每张切片4个视野(400倍),计算阳性细胞所占百分比,并进行百分比评分(PP):0分,无阳性细胞;1分,阳性细胞百分比<5%;2分,阳性细胞百分比5%~20%;3分,阳性细胞百分比>20%。对染色强度进行评分(SI):0分,无染色;1分,淡黄色;2分,棕黄色;3分,棕褐色。最终计算出免疫反应评分(IRS)=PP×SI[9],分值范围0~9分,得分越高说明阳性表达强度越高。
1.4.3 生活质量评分:治疗后,采用QLQ-C30生活质量评分标准(包括社会、情绪、认知、角色、躯体及总健康状况等6个功能性领域)对2组患者术后生活质量进行评价,将各项得分转换为百分制,得分越高说明生活质量越好[10]。
1.5 临床疗效评价 依据实体瘤疗效评价标准[11],分为:完全缓解、部分缓解、疾病稳定和疾病进展,以完全缓解+部分缓解为客观缓解率。

2 结 果
2.1 2组临床疗效比较 观察组的客观缓解率明显高于对照组(67.35%vs.36.73%,χ2=13.848,P=0.003),见表2。

表2 2组患者临床疗效比较 [例(%)]
2.2 2组治疗前后T淋巴细胞亚群水平比较 治疗前2组各T细胞亚群水平比较差异均无统计学意义(P>0.05);与治疗前相比,治疗后,观察组CD3+、CD4+、CD4+/CD8+水平升高,CD8+水平下降,且观察组各指标优于对照组(P<0.01),见表3。

表3 2组患者治疗前后T细胞亚群变化情况比较
2.3 2组治疗前后肝脏TRF1和TRF2表达水平比较 治疗前,2组TRF1和TRF2表达水平比较差异无统计学意义(P>0.05);治疗后,观察组肝脏TRF1表达水平高于治疗前,且高于对照组,TRF2表达水平低于治疗前,且低于对照组(P<0.01),见表4。
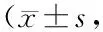
表4 2组患者治疗前后肝脏TRF1和TRF2表达水平比较分)
2.4 2组生活质量评分比较 治疗后,观察组生活质量各项维度评分明显高于对照组(P<0.01),见表5。
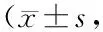
表5 2组患者治疗后生活质量情况比较分)
2.5 2组生存率比较 随访5年,应用Kaplan-Meier对2组患者进行生存率分析,观察组患者生存率明显高于对照组(χ2=4.513,P=0.023),见图1。
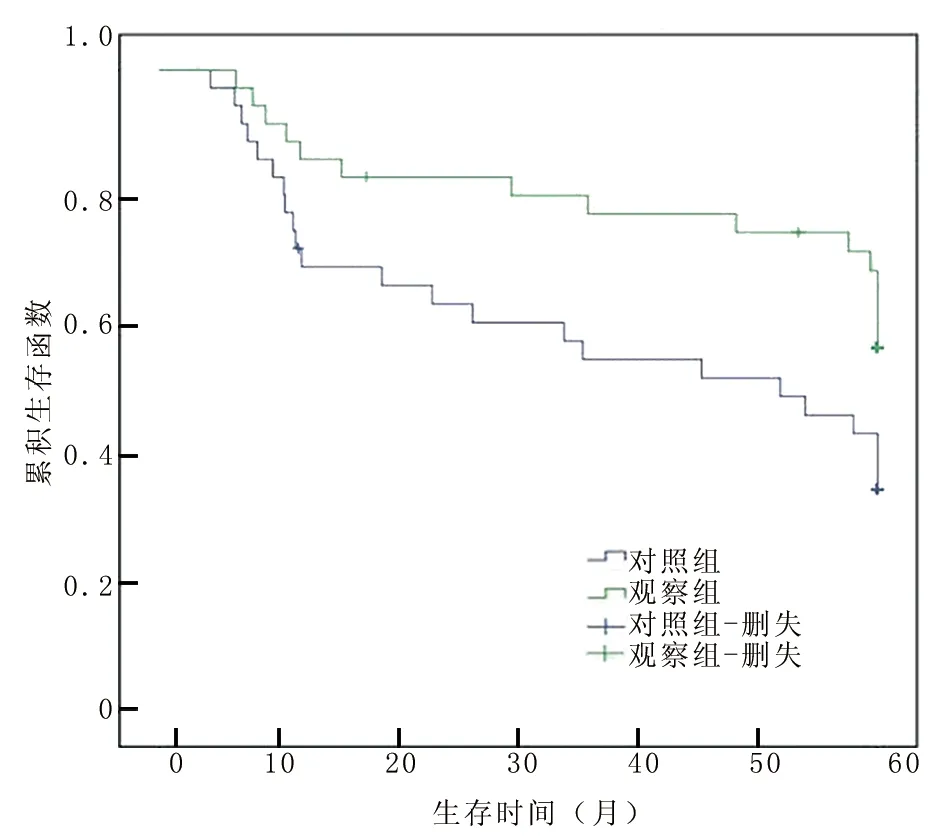
图1 2组患者生存率分析
3 讨 论
随着我国居民生活习惯的改变及环境污染加重,结直肠癌的患病率不断增长,其发病机制是多种因素协同作用所致,如消化道疾病(幽门螺杆菌感染、溃疡性结直肠炎及克罗恩病)、生活习惯(肥胖、药物、吸烟、饮酒及心理精神因素)、饮食(高脂、高蛋白饮食、微量元素摄入)及遗传因素等[12-13]。手术治疗是早期结直肠癌唯一可以治愈的手段,但25%~50%患者根治术后因肝转移而复发,其肝转移的可能机制为根治术后,患者腹腔内损伤的淋巴管和累积的残留微小癌灶进入血液或淋巴液中,从而造成癌细胞的远处转移[14-16]。常规术后化疗虽然可短时间内抑制肿瘤的生长,但却无法从根本上解决其转移及扩散的问题,且化疗毒副作用导致患者自身免疫力降低,进而导致残存的癌细胞迅速生长,加速病情的发展,因此如何预防、治疗结直肠癌根治术后肝转移成为临床研究的热点。
癌细胞缺少可激活T细胞的分子,不被T细胞识别,无法启动主动免疫,因此导致结直肠癌在体内发生转移,CIK细胞可激活T细胞因子,完成主动免疫过程[17-18]。CIK具有超广的杀瘤谱,对癌细胞的识别能力极强,可增强化疗的敏感性,直接精准的杀伤癌细胞,同时不会影响正常的组织与器官。DC是目前已知唯一能激活初始性T细胞的抗原递呈细胞,其功能最强、最有效,与CIK协同作用,可解除部分结直肠癌患者术后T细胞的免疫无能,快速有效防止肿瘤局部复发和转移,达到协同抗肿瘤作用。
结直肠癌根治术后肝转移的发生与发展与免疫功能关系密切[19-20]。CD3+代表全部T淋巴细胞,CD4+对免疫起正调节作用;CD8+会破坏并杀伤感染细胞,对CD4+具有抑制作用,使免疫功能发生紊乱;CD4+/CD8+可反映机体的细胞免疫状态[21]。本结果显示,通过DC-CIK联合化疗,不仅可直接杀伤癌细胞,还能激活CD4+,同时抑制CD8+表达,增强人体免疫能力,有效调动和增强机体自主的抗肿瘤免疫反应。
端粒是存在于真核细胞内,用来稳定细胞染色体功能的一种特殊帽状结构,其长度与细胞癌变相关度高[22]。TRF1和TRF2是2种不同的端粒结合因子,两者广泛参与细胞核DNA复制及其损伤修复、维系端粒酶活性和调控端粒长度等生物学活动。TRF1蛋白可调节端粒长度,且这种调节为负性调节,TRF1基因可能作为抑癌基因[23]。TRF2蛋白对端粒的长度具有正相性,TRF2基因则具有癌基因活性,可导致机体肿瘤易感性增加[24]。本结果显示, DC-CIK联合化疗可将TRF1和TRF2作为潜在靶点,刺激TRF1表达增加,使细胞内染色体端粒的长度缩短,进而抑制乃至阻止癌细胞的增殖;同时下调TRF2表达,阻断其对端粒DNA闭环结构的稳定作用,进而导致端粒的长度缩短,促进癌细胞凋亡,从而有效防治结直肠癌根治术后伴肝转移,提高患者的生存质量,并延长其生存期。
综上所述,DC-CIK对结直肠癌根治术后肝转移具有较好的疗效,可通过调节肝转移病灶处TRF1与TRF2表达水平,抑制癌细胞生长,延长患者生存时间,值得临床推广应用。
利益冲突:所有作者声明无利益冲突
作者贡献声明
朴龙镇:设计研究方案,实施研究过程,论文撰写;金兰:图表设计,整理资料;李滕、胡乌云:资料搜集整理,论文修改,查找文献及参考书籍;梁雪:进行统计学分析

