术中瑞芬太尼持续泵注对胃肠术后镇痛的影响
李璐宏,罗 艳
上海交通大学医学院附属瑞金医院麻醉科,上海200025
术后急性疼痛是术后最常见的一种不适体验。80%以上的患者在术后经历了急性疼痛的阶段[1],控制不佳的术后疼痛与多种不良预后相关[2]。因此,术后疼痛问题一直被广泛关注。在过去的几十年中,镇痛策略不断优化,各种各样的镇痛策略用于临床以期获得满意的镇痛效果,但实际上,术后镇痛效果并未得到明显的改善[3-4]。阿片类药物因其具有强效镇痛作用,仍是目前广泛用于围术期急性疼痛管理的一线药物,但其药物相关的不良反应一直受到关注。围术期暴露于大量的阿片类药物引起的痛觉敏化(opioid induced hyperalgesia,OIH)和/或急性阿片类药物耐受(acute opioid tolerance,AOT)[5-6],被认为是影响术后镇痛效果的重要因素[7],也一直是临床研究的热点。
瑞芬太尼具有快速起效和快速消退的药理学特性,不会因长时间持续泵注而存在药物蓄积,不影响拔管时间和苏醒室停留时间,因而被广泛用于镇静/镇痛的维持。但临床研究[5]表明,术中使用瑞芬太尼引起术后痛觉过敏/药物耐受更为明显。既往研究[8]表明,瑞芬太尼相关的OIH 和/或AOT 具有明显的剂量依耐性:当术中瑞芬太尼泵注速度大于0.2 μg/(kg·min),患者术后疼痛评分与镇痛药物的消耗明显增加。而持续泵注较低剂量的瑞芬太尼与未给与瑞芬太尼相比是否获益鲜有研究。如何在围术期合理使用瑞芬太尼,平衡药物使用的风险与收益,值得进一步探讨。因此,本研究拟探讨胃肠术中瑞芬太尼持续低剂量[0.05~0.15 μg/(kg·min)]泵注对术后镇痛效果的影响。
1 对象与方法
1.1 研究对象
本研究纳入2019 年4 月—12 月在上海交通大学医学院附属瑞金医院行择期胃肠手术的患者。纳入标准:①年龄>18岁。②术前无长期阿片类药物使用史。③美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级≤3 级。④择期行胃肠道手术。⑤术后镇痛采用布托啡诺患者自控静脉镇痛(patient-controlled analgesia,PCIA)。排除标准:①接受了神经阻滞或硬膜外镇痛的患者。②术后采用非布托啡诺PCIA 的患者。③术后随访期内转入ICU 的患者。根据术中是否使用瑞芬太尼持续泵注分为瑞芬太尼组和对照组。通过院内病历管理系统采集术前患者人口学特征数据,手术麻醉管理系统采集手术类型、手术时长及术中麻醉用药等术中资料,术后随访记录采集患者镇痛补救以及PCA 按压等术后资料。本研究经上海交通大学医学院附属瑞金医院伦理委员会批准(批件号:2020临伦审第54号)。
1.2 围术期管理
所有患者术前静脉滴注右美托咪定20~50 μg,采用舒芬太尼(2~4 μg/kg)、丙泊酚、顺式阿曲库铵或罗库溴铵快速诱导,气管插管静脉-吸入复合麻醉。瑞芬太尼组患者手术开始后按照0.1 μg/(kg·min)的速度予泵注瑞芬太尼,术中根据患者血流动力学情况调整泵速:平均动脉压<65 mmHg(1 mmHg=0.133 kPa),且持续10 min 内需使用血管活性药干预>3 次,泵速下调至0.05 μg/(kg·min);平均动脉压高于术前水平持续大于10 min,上调至0.15 μg/(kg·min)。对照组患者术中不使用瑞芬太尼。2组麻醉维持均采用地氟烷(5.0%~7.0%) 或七氟烷(2.0%~3.0%) 维持最低肺泡有效浓度(minimum effective alveolar concentration,MAC) 0.8~1.0;每间隔30 min,追加舒芬太尼5~10 μg 以及顺式阿曲库铵或罗库溴铵。主管麻醉医师自主选择术中是否予氟比洛芬酯辅助镇痛。术毕关闭切口时2 组均予舒芬太尼5~10 μg,瑞芬太尼组于追加舒芬太尼5 min后停止泵注。
术后PCIA配方为10~15 mg布托啡诺至100 mL生理盐水,背景剂量1~2 mL/h,患者自控镇痛(patient-controlled analgesia,PCA)剂量1 mL,间隔时间15 min。术毕连接PCIA泵,并指导患者疼痛程度加剧时按压PCA键予追加单次剂量,镇痛泵使用时间为术后2 d。疼痛补救方案:患者自主报告疼痛剧烈,经病房主管医师使用数字评分量表(Numerical Rating Scale,NRS)评估,若评分≥5,予杜冷丁50~100 mg或曲马多50~100 mg单次肌内注射。
1.3 统计学方法
采用SPSS 26.0 软件进行数据分析。使用倾向性评分匹配法对瑞芬太尼组和对照组病例术前人口学特征及术中情况进行1∶1 匹配,卡钳值设定为0.02。术中暴露于持续泵注瑞芬太尼与出现术后镇痛补救之间的相关风险性用相对危险度(risk ratio,RR)及其95%CI表示。模型的敏感性检验根据术后镇痛补救结局将匹配前的患者分为镇痛补救组和未补救组,采用多因素Logistic 回归分析,使用比值比(odds ratio,OR)表示术后镇痛补救与术中是否持续泵注瑞芬太尼的相关性。定性资料采用n(%)表示;符合正态分布的定量资料采用±s表示,不符合正态分布的定量资料采用M(Q1,Q3)表示。定性资料的比较采用χ2检验或Fisher确切概率法。定量资料符合正态分布且方差齐性,采用独立样本t检验;非正态分布或方差不齐,采用Wilcoxon秩和检验。α=0.05,双侧检验。
2 结果
2.1 瑞芬太尼暴露分组及倾向性评分匹配结果
本研究共纳入695例行择期胃肠手术患者,其中瑞芬太尼组335 例,对照组360 例。匹配前,2 组之间性别(P=0.033)、年龄(P=0.029)、手术时长≥3 h(P=0.015)以及是否进行腹腔镜手术(P=0.014)的差异均存在统计学意义。建立倾向性评分匹配模型,设定卡钳值为0.02进行匹配,最终286 对患者匹配成功,2 组术前人口学资料以及术中情况差异无统计学意义(表1)。
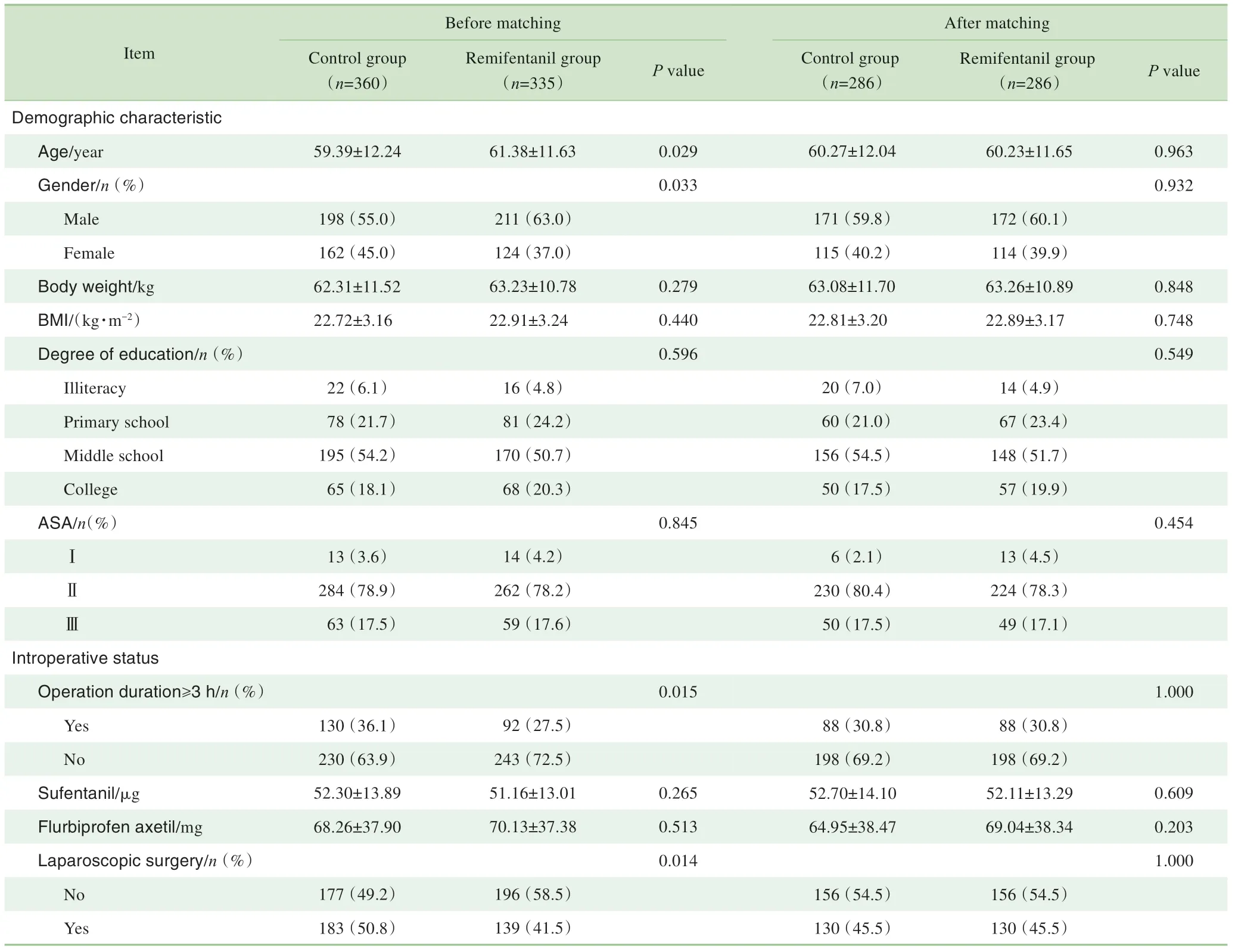
表1 匹配前及匹配后患者人口学特征和术中情况比较Tab 1 Comparison of demographic characteristics and intraoperative status of patients before and after propensity score matching
2.2 术后镇痛效果比较
瑞芬太尼组中接受镇痛补救患者占比明显低于对照组(32.5% vs 40.9%,P=0.037),且瑞芬太尼组术后出现PCIA 镇痛效果不佳且需镇痛补救的风险是对照组的69.6%(RR=0.696,95%CI 0.495~0.980)。对倾向性评分匹配模型进行敏感性分析,将匹配前的695例患者根据术后是否接受镇痛补救分为2组,将瑞芬太尼和术前患者方面以及术中手术方面等相关混杂因素纳入多因素Logistic分析,结果显示术中使用瑞芬太尼OR 为0.709(95%CI 0.513~0.979,P=0.037),即术中使用瑞芬太尼与术后接受镇痛补救存在负相关性,术中使用瑞芬太尼可能有助于改善镇痛补救结果,与匹配后结果一致。术后PCIA 使用情况显示(表2),2组患者之间PCA 总按压次数[5.00(1.00,13.00) vs 5.00 (1.00,12.00),P=0.568]和按压比[1.00(1.00,1.20) vs 1.00(1.00,1.17),P=0.386]的差异均无统计学意义。瑞芬太尼组中PCA按压次数>13次的患者占比少于对照组(21.3% vs 24.5%,P=0.426),虽然该差异无统计学意义,但提示术中使用瑞芬太尼的患者存在术后较少需要频繁按压PCA 以获得满意镇痛效果的趋势。
3 讨论
阿片类药物对镇痛的两面性使得该药物在围术期的使用具有极大的争议。阿片类药物大量使用可引起OIH和/或AOT,以及其他不良反应(如呼吸抑制、恶心呕吐、皮肤瘙痒等),但阿片类药物以其镇痛效果确切、使用简单方便等优势,具有不可替代性。因此,如何合理使用阿片类药物改善术后镇痛效果具有重要的临床意义。
瑞芬太尼因其作用时间短,可被组织与血液中的非特异酶降解,不依赖肝肾功能,不会出现药物蓄积而影响术后苏醒,因此被广泛用于术中镇痛管理。但大量的临床研究[5,8]表明,术中使用瑞芬太尼引起术后痛觉过敏/药物耐受更为明显。在Fletcher 等[5]的meta 分析中发现术中大剂量瑞芬太尼与术后24 h 内静息疼痛评分以及吗啡的消耗量明显相关,而该研究中的数据未能证明术中使用舒芬太尼具有类似的表现。

表2 术后镇痛补救和PCA按压比较Tab 2 Comparison of postoperative analgesic remedy and PCA pressing
瑞芬太尼诱导的术后痛觉敏化具有明显的时间依赖性。既往研究[9]表明,暴露时间<1 h,术后出现痛觉过敏的风险较小,而暴露时间大于2 h 提示明显的术后痛觉敏化风险。本研究中将手术时长作为混杂因素进行了倾向性评分匹配,消除了瑞芬太尼组与对照组之间手术时长的差异,未成功匹配的患者也具有明显的时间差异性,表现为瑞芬太尼组未匹配患者手术时间较长,对照组未匹配患者手术时间较短。因此本研究未能说明瑞芬太尼暴露时间与术后镇痛效果之间的影响。
瑞芬太尼诱导的OIH和/或AOT呈现剂量依赖性,术中使用大剂量的瑞芬太尼可导致术后疼痛评分以及镇痛药物消耗增加。在Kim 等[10]的综述中,大多数研究认为瑞芬太尼泵注速度>0.1 μg/(kg·min)即可引起OIH和/或AOT,而术中使用大剂量的瑞芬太尼[(0.3±0.2)μg/(kg·min)或0.4 μg/(kg·min)],术后需要更早镇痛干预以及吗啡消耗量的增加更为明显。Fletcher等[5]的meta分析同样发现较高剂量的瑞芬太尼与术后24 h内静息疼痛程度增加以及吗啡消耗增加相关;该研究纳入的试验中术中瑞芬太尼维持速度在0.05~0.90 μg/(kg·min),并未对不同的瑞芬太尼泵注速度进行进一步的分析。随后,Yu等[8]的meta分析中对术中瑞芬太尼输注情况进行了定量分析,发现术中瑞芬太尼输注速度>0.25 μg/(kg·min)与术后阿片类药物需要量增加相关,提示可能出现急性阿片类药物耐受;而输注速度>0.20 μg/(kg·min)则出现较低的伤害性刺激阈值,这可能表明痛觉过敏的出现[8]。
由于既往研究样本量均较小,术中瑞芬太尼的输注方案、输注时间、手术类型、麻醉和镇痛干预等具有较大的异质性,所得结论中引起OIH 和/或AOT 的瑞芬太尼泵注速度波动范围较大,因此,多个系统回顾与meta 分析都很难得到更为准确的结果。最近,Niedermayer等[11]的一项回顾性队列研究,纳入了55 693 例接受腹部手术的患者;该研究发现术中使用瑞芬太尼与未使用瑞芬太尼相比,术后疼痛评分明显升高,术后接受非阿片类药物镇痛的频率与平均剂量均增高。该试验中瑞芬太尼的平均输注剂量为0.13 μg/(kg·min),最大输注速度平均值为0.21 μg/(kg·min),不同个体之间瑞芬太尼的泵注速度存在较大差异;而该研究未对不同输注速度进行比较,尚不能说明输注速度与OIH 间的关系。一项健康志愿者试验[12]发现,当瑞芬太尼以0.08 μg/(kg·min)持续泵注,未能检测出温度与电刺激诱导的急性伤害性感受耐受。另一项接受腹部手术患者的随机对照试验[13]中,术中瑞芬太尼输注速度<0.05 μg/(kg·min)时未出现术后疼痛增加或镇痛药物消耗增多。
基于以上研究,可认为高剂量泵注瑞芬太尼[>0.20 μg/(kg·min)]可出现明显的术后疼痛增加和镇痛药物消耗增加,低泵注速度[<0.05 μg/(kg·min)或0.08 μg/(kg·min)]则未表现出不良术后镇痛,而0.10 μg/(kg·min)的泵注速度似乎存在于较为模糊的灰色区间。因此,本研究中的术中瑞芬太尼泵注初始速度设定为0.10 μg/(kg·min),泵速调整范围限定于0.05~0.15 μg/(kg·min),以探索该剂量范围的持续泵注对术后镇痛的影响。
本研究结果显示,瑞芬太尼组术后需要镇痛补救的患者占比显著少于对照组,瑞芬太尼组与对照组患者术后PCA 按压次数差异无统计学意义,但瑞芬太尼组中PCA按压次数>13次的患者少于对照组。上述发现提示术中以0.05~0.15 μg/(kg·min)持续泵注瑞芬太尼的患者术后镇痛需求更低。对于此结果,我们认为:术中伤害性感受的传导可以易化中枢疼痛感受,术中持续泵注瑞芬太尼能更有效、平稳地抑制伤害性感受传导,避免间断给药期间出现的镇痛空白期使中枢疼痛感受易化从而导致术后痛觉敏化的形成,同时提供更加完善的镇痛;瑞芬太尼因代谢快,停药后镇痛效果可快速消退,因此,瑞芬太尼的突然撤离容易出现镇痛空白期也被认为是瑞芬太尼相关OIH 的重要因素。本研究中,停止瑞芬太尼泵注前5 min 内追加长效阿片类药物舒芬太尼5~10 μg 以覆盖瑞芬太尼撤离后可能出现的镇痛空白,可减少出现术后痛觉过敏的发生。
除合理使用瑞芬太尼外,其他一些防治痛觉过敏或痛觉耐受的措施也被大量探索与研究。目前研究认为N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂(如氯胺酮)、环氧化酶抑制剂、α-2 受体激动剂(如右美托咪定)、阿片受体拮抗剂、阿片类受体部分激动/拮抗剂等均可有效抑制瑞芬太尼相关OIH 的出现[14-15]。布托啡诺作为一种阿片类受体部分激动拮抗剂,以激动κ 受体为主[16],已有研究[15,17]表明,围术期使用布托啡诺可改善术中使用瑞芬太尼患者的术后镇痛效果。夏晶等[18]的研究发现,术中泵注瑞芬太尼的患者在手术结束时应用布托啡诺较手术结束前30 min 以及术后拔管时给药预防术后早期急性疼痛的镇痛效果更为理想,且不会影响其麻醉苏醒的效果。本研究中的患者术后均采用布托啡诺用于PCIA,与μ 受体阿片类药物作用机制存在不同,可能在一定程度上减少了药物耐受或痛觉过敏的出现。
本研究仍存在一些不足与局限。首先,本研究为回顾性队列研究,数据来源于病史记录;病史资料记录的准确性与完整性可能对本研究产生一定的偏倚。其次,患者术后镇痛结局以PCA 按压次数以及镇痛补救发生率作为评估,无法区分患者术后镇痛需求增加是因为痛觉过敏或药物耐受引起;直接的定量敏感性测试相较于临床间接指标(如疼痛评分、镇痛药物消耗)可区别OIH与AOT。再次,本研究对手术类型进行了开放手术和腔镜手术的分类和匹配,但未进一步对胃部手术和结直肠手术进行区分和讨论,可能存在混杂因素影响。
综上所述,术中持续低剂量瑞芬太尼背景泵注提供了更稳定、有效的镇痛,避免术中镇痛效果出现中断,并且在手术结束暂停瑞芬太尼泵注前追加长效阿片类药物覆盖其快速撤离后可能出现的镇痛空白期;术后采用布托啡诺防治痛觉过敏,可能有助于合理使用瑞芬太尼,获得术中平稳镇痛的同时,减少术后痛觉过敏,改善术后镇痛效果。本研究结果发现0.05~0.15 μg/(kg·min)的术中瑞芬泵注剂量可能改善术后镇痛效果,减少术后镇痛需求,但该泵注速度是否为最佳泵注剂量仍需更严谨的研究予以论证。
参·考·文·献
[1] Wu CL, Raja SN. Treatment of acute postoperative pain[J]. Lancet, 2011,377(9784):2215-2225.
[2] Hurley RW,Elkassabany NM,Wu CL.Acute postoperative pain[M]//Gropper MA. Miller's Anesthesia. 9th ed. Canada:Elsevier,Inc.,2019:2614-2638.
[3] Small C, Laycock H. Acute postoperative pain management[J]. Br J Surg,2020,107(2):e70-e80.
[4] Hay D, Nesbitt V. Management of acute pain[J]. Surgery (Oxford), 2019,37(8):460-466.
[5] Fletcher D,Martinez V. Opioid-induced hyperalgesia in patients after surgery:a systematic review and a meta-analysis[J]. Br J Anaesth,2014,112(6):991-1004.
[6] Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioidinduced hyperalgesia[J]. Pain Physician,2011,14(2):145-161.
[7] Cachemaille M, Grass F, Fournier N, et al. Pain intensity in the first 96 hours after abdominal surgery: aprospective cohort study[J]. Pain Med,2020,21(4):803-813.
[8] Yu EH, Tran DH, Lam SW, et al. Remifentanil tolerance and hyperalgesia:short-term gain,long-term pain?[J]. Anaesthesia,2016,71(11):1347-1362.
[9] Vinik HR, Kissin I. Rapid development of tolerance to analgesia during remifentanil infusion in humans[J]. Anesth Analg,1998,86(6):1307-1311.
[10] Kim SH, Stoicea N, Soghomonyan S, et al. Intraoperative use of remifentanil and opioid induced hyperalgesia/acute opioid tolerance:systematic review[J]. Front Pharmacol,2014,5:108.
[11] Niedermayer S, Heyn J, Guenther F, et al. Remifentanil for abdominal surgery is associated with unexpectedly unfavorable outcomes[J]. Pain,2020,161(2):266-273.
[12] Gustorff B, Nahlik G, Hoerauf KH, et al. The absence of acute tolerance during remifentanil infusion in volunteers[J]. Anesth Analg, 2002, 94(5):1223-1228.
[13] Joly V, Richebe P, Guignard B, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine[J]. Anesthesiology,2005,103(1):147-155.
[14] 刘艳, 么金明, 吕湘琪. 瑞芬太尼诱发术后痛觉过敏的机制及防治进展[J]. 临床与病理杂志,2019,39(10):2298-2303.
[15] 李新友, 屠伟峰. 术中应用瑞芬太尼维持麻醉患者术后的疼痛管理[J].实用疼痛学杂志,2009,5(5):388-391.
[16] 黄宇光,黄文起,李刚,等. 酒石酸布托啡诺镇痛专家共识[J]. 临床麻醉学杂志,2011,27(10):1028-1029.
[17] 王旭,王健. 一种新型镇痛药:布托啡诺的研究进展[J]. 中国药师,2006,9(11):1044-1045.
[18] 夏晶. 用瑞芬太尼进行手术麻醉的患者在不同时间应用布托啡诺预防术后早期急性疼痛的效果[J]. 当代医药论丛,2019,17(7):138-140.

