基于电子舌和气相色谱-离子迁移谱分析坛紫菜与条斑紫菜的风味特征
曹 荣,胡梦月,谭志军,3,王联珠,刘 淇,*
(1.中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东 青岛 266235;3.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
紫菜属于红藻门(Rhodophyta)、原红藻纲(Protoflorideophyceae)、红毛菜目(Bangiales)、红毛菜科(Bangiaceae),是全世界尤其是亚洲区域一种重要的经济藻类[1]。坛紫菜(Porphyrahaitnensis)和条斑紫菜(P. yezoensis)是我国最主要的两大紫菜养殖品种。其中,坛紫菜的主产区在南方,以福建产坛紫菜最为有名;而条斑紫菜主要产自北方地区。坛紫菜和条斑紫菜在遗传[2]、育种[3]、养殖[4]以及营养[5]等方面的异同及其产生机制一直是科研工作者的研究热点。
紫菜具有的独特风味是其深受消费者喜爱的最主要原因[6]。水产品的风味主要由滋味和气味两个方面构成[7]。滋味物质大多具有水溶性和非挥发性的特点,分子质量一般较低,如游离氨基酸、呈味核苷酸、有机酸、无机离子以及一些呈味肽等[8]。目前有关水产品滋味的研究主要集中在水产动物原料[9-12],有关经济藻类滋味的研究还较少。在水产品挥发性气味物质研究方面,气相色谱-质谱联用法、气相色谱-吸闻法以及电子鼻是目前普遍采用的方法,国内外学者运用这些技术手段在水产品挥发性成分研究方面取得了重要进展[13-16]。气相色谱-离子迁移谱法是近年来新兴的一种分析方法,具有选择性好、灵敏度高、分析速度快、体积小、能耗低等优点,为水产品挥发性成分的检测提供了一种更为便捷的技术手段[17-18]。已有研究证实,生长海域、采收期等因素对紫菜气味组成有显著影响[19-21],而有关坛紫菜和条斑紫菜特征性挥发性物质的对比研究还较少。
本实验以采自福建漳州海域的坛紫菜和采自山东半岛靖海湾的条斑紫菜为研究对象,采用电子舌、气相色谱-离子迁移谱仪等技术手段对其滋味和气味物质进行分析,以期了解不同品种紫菜的品质特点,为其加工利用提供参考。
1 材料与方法
1.1 材料与试剂
坛紫菜样品由福建省远扬藻业有限公司提供,2017年1月采集自福建省漳州海域。条斑紫菜由威海市科蓝海洋科技有限公司提供,2017年1月采集自山东省靖海湾海域。上述两份紫菜样品均为“头水”紫菜(紫菜在一个养殖周期内可以收割多次,首次采收的称为头水或一水紫菜,后续采收的依次称作二水、三水等),样品采收后,在生产车间经初次清洗、切割、二次清洗、调和、制饼、脱水、烘干、分级、包装等工序加工成干紫菜。随机采集该生产批次的干紫菜样品,粉碎后真空包装,于低温干燥的条件下保存备用。
氨基酸混样标准品、腺苷酸(adenosine monophosphate,AMP)、肌苷酸(inosine monophosphate,IMP)、鸟苷酸(guanosine monophosphate,GMP)(纯度>99%) 美国Sigma公司;盐酸、磺基水杨酸、柠檬酸、乙酸、氯化钾(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TS-5000Z型味觉分析系统 日本Insent公司;FlavourSpec®气相色谱-离子迁移谱仪 德国G.A.S.公司;L-8800型氨基酸自动分析仪 日本日立公司;1260型高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 游离氨基酸测定
样品前处理采用磺基水杨酸法,准确称取粉碎的紫菜样品5.0 g,用0.01 mol/L的盐酸浸提30 min,过滤;取5 mL滤液于离心管中,加入质量分数为8%的磺基水杨酸5 mL,静置20 min后8 000 r/min离心10 min;取上清液,过0.45 μm滤膜后上机。参照GB 5009.124—2016《食品中氨基酸含量的测定》[22],采用氨基酸自动分析仪进行测定。
1.3.2 呈味核苷酸测定
取样品5.0 g,加入质量分数为10%的过氯乙酸溶液25.0 mL均质,离心后收集上清液,中和至pH 6.5,过0.45 μm滤膜,收集滤液。滤液用高效液相色谱仪进行测定,进样量10 μL,C18色谱柱,流动相为柠檬酸(20.0 mmol/L)、乙酸(20.0 mmol/L)、三乙胺(40.0 mmol/L)混合溶液,流速0.8 mL/min,检测波长260 nm。通过比对标准化合物色谱图确定AMP、IMP、GMP含量。
1.3.3 滋味活性值计算
滋味活性值(taste active value,TAV)按照式(1)[23]计算:

1.3.4 味精当量计算
味精当量(equivalent umami concentration,EUC)以谷氨酸单钠(monosodium glutamate,MSG)计算,公式[23]如下:
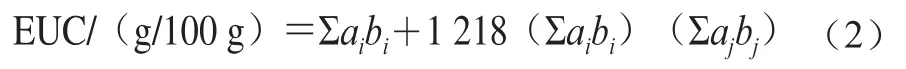
式中:1 218为协同作用常数;ai为鲜味氨基酸的含量/(g/100 g),以MSG计算;bi为鲜味氨基酸相对于MSG的鲜味系数(Glu为1.0;Asp为0.077);aj为呈味核苷酸的含量/(g/100 g);bj为呈味核苷酸相对于IMP的鲜味系数(IMP为1.0;AMP为0.18;GMP为2.3)。
1.3.5 电子舌检测
取5.0 g紫菜干粉,加入100 mL加热至沸腾的去离子水,浸泡5 min后3 000 r/min离心10 min,取上清液,冷却至室温后上机检测。采用TS-5000Z型电子舌,加载鲜、咸、苦、涩、酸5 种传感器电极,按照默认程序进行检测。以氯化钾和酒石酸混合溶液模拟人体唾液,并作为参比溶液。每个样品检测6 次,采用设备自有数据库及软件对数据进行分析。
1.3.6 挥发性成分检测
取0.5 g紫菜干粉置于20 mL顶空进样瓶中,孵化温度设置为60 ℃,10 min后进样气相色谱-离子迁移谱仪进行检测。通过比对气相保留指数数据库与离子迁移时间数据库对采集到的挥发性成分进行定性,采用设备自带的LAV软件进行数据分析,使用Gallery Plot功能绘图。
1.4 数据处理
2 结果与分析
2.1 游离氨基酸与呈味核苷酸含量
游离氨基酸对水产品的滋味形成有重要贡献[9]。坛紫菜和条斑紫菜的游离氨基酸组成情况及其对应的TAV见表1。坛紫菜的游离氨基酸总量为3 497.08 mg/100 g,含量较高的种类依次是Arg、Glu、Ala、His和Asp。Glu和Asp是鲜味氨基酸,二者总量达到1 040.06 mg/100 g,占游离氨基酸总量的29.7%,是坛紫菜鲜味的重要来源。条斑紫菜的游离氨基酸总量为4 237.62 mg/100 g,极显著高于坛紫菜(P<0.01),在氨基酸比例方面与坛紫菜也有所不同。条斑紫菜中含量较高的种类依次是Ala、Glu、Asp和Val,其中鲜味氨基酸总量为1 686.76 mg/100 g,占游离氨基酸总量的39.8%。2 种紫菜在游离氨基酸组成和含量方面的差异与品种、生长环境有关[24]。呈味物质的量及其味道阈值共同决定了其滋味强度,通常用TAV表示[25]。TAV越大,对滋味的贡献度越大。坛紫菜中对滋味贡献大的氨基酸依次是Glu(鲜味)、Arg(苦/甜)、His(苦)和Ala(甜)。条斑紫菜中对滋味贡献大的氨基酸为Glu(鲜味)和Ala(甜)。
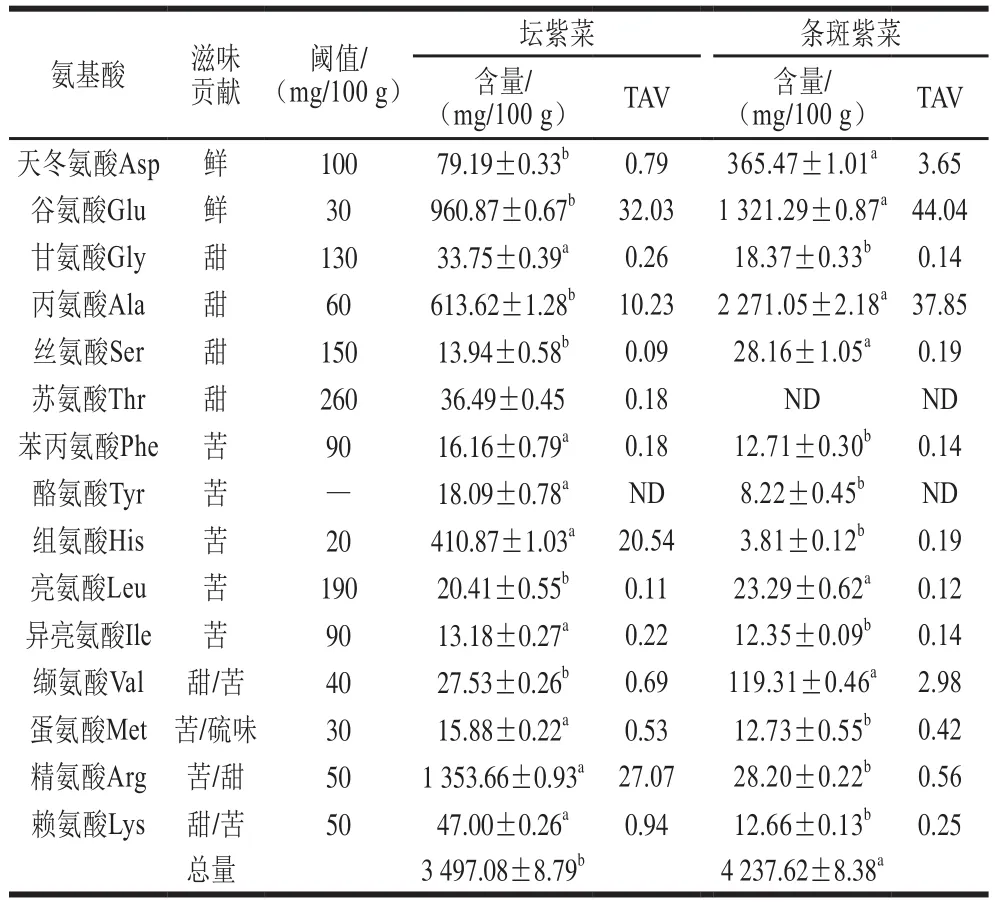
表1 坛紫菜与条斑紫菜游离氨基酸组成Table 1 Compositions of free amino acids in P. haitanensis and P. yezoensis
AMP、IMP和GMP是呈鲜味的核苷酸,其在坛紫菜和条斑紫菜中的含量及其对应的TAV见表2。坛紫菜中未检测到AMP,条斑紫菜中AMP含量为22.18 mg/100 g,但对应的TAV仅为0.44,说明AMP对紫菜的滋味贡献不大。坛紫菜的IMP和GMP含量均极显著高于条斑紫菜(P<0.01),对应的TAV也较大。呈味核苷酸与鲜味氨基酸可产生鲜味协同效应,这种交互作用可以用EUC衡量[23]。经计算,坛紫菜和条斑紫菜的EUC分别为382.26 g/100 g和316.94 g/100 g,说明坛紫菜的鲜味强度较条斑紫菜更高,且该差异主要是由呈味核苷酸造成。
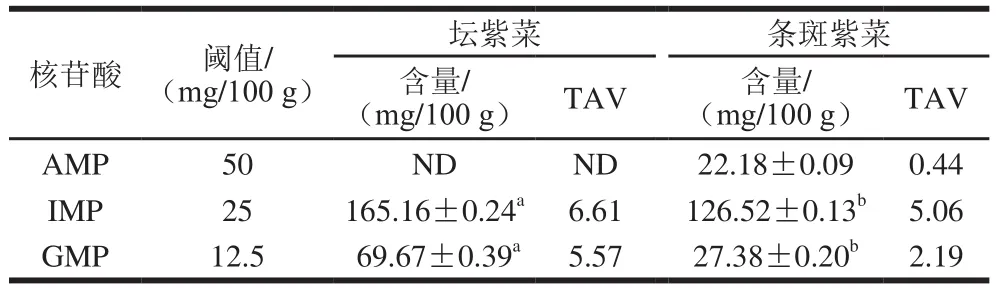
表2 坛紫菜与条斑紫菜呈味核苷酸含量Table 2 Contents of flavor nucleotides in lavers and their TAVs
2.2 基于电子舌的紫菜滋味轮廓
图1是采用电子舌绘制的坛紫菜与条斑紫菜的滋味轮廓。雷达图中坐标轴标注的是味道强度值,该值是电子舌基于Weber-Fechner定律将呈味物质20%的强度变化定义为一个味道单位。以参比溶液对应的值作为无味点(0点),紫菜的酸味值在无味点以下,涩味回味和苦味回味对应的值与无味点接近,表明酸味、涩味回味和苦味回味对紫菜的滋味基本无贡献。鲜味、鲜味回味、咸味、苦味和涩味均在无味点以上,共同构成紫菜的滋味。
鲜味和鲜味回味是紫菜最重要的滋味特征。坛紫菜和条斑紫菜的鲜味值分别为7.27和6.31,具有显著差异(P<0.05),这与EUC的分析结果一致。鲜味回味指鲜味的持久性和丰富程度,不仅与呈味物质的量有关,与种类也密切相关。坛紫菜和条斑紫菜的鲜味回味有极显著差异(P<0.01),这可能主要与两种紫菜游离氨基酸以及呈味核苷酸的组成差异有关。苦味和涩味也是紫菜滋味的重要组成部分。坛紫菜的苦味值和涩味值均极显著高于条斑紫菜(P<0.01),这可能与坛紫菜含有较多的Arg和His有关。总体上,坛紫菜的鲜味、鲜味回味等令人愉悦的滋味强度更高,但同时苦味、涩味值也较大,在滋味方面比条斑紫菜更为丰富。
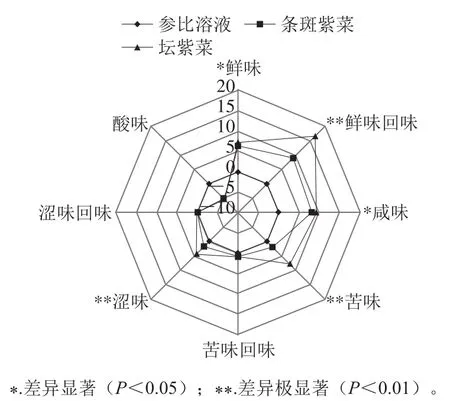
图1 基于电子舌的坛紫菜与条斑紫菜滋味轮廓Fig. 1 Taste profiles of P. haitanensis and P. yezoensis as determined byelectronic tongue
2.3 挥发性成分
采用气相色谱-离子迁移谱仪可以从紫菜中分离并鉴定出36 种挥发性物质,包括11 种醇类、8 种醛类、5 种酮类、5 种酸类、3 种酯类以及酚类、硫醚类、呋喃类、吡咯类各1 种,结果见图2。
坛紫菜和条斑紫菜的挥发性成分含量有明显差异。坛紫菜的挥发性物质总体含量相对较低,这与坛紫菜气味清淡的现象一致。坛紫菜中仅丁酮、丁二酮、2-乙基呋喃、丙醛、丙酮的含量显著高于条斑紫菜,其中酮类化合物的阈值一般较高[17],2-乙基呋喃可呈现出豆香或麦芽香,但同样阈值较高(8 000 μg/kg)[26],因此这2 类物质对气味贡献较小。丙醛具有青草气味或可可香气,且阈值较低(37 μg/kg)[27],对坛紫菜的气味有较大贡献。
条斑紫菜的挥发性物质总体含量相对较高,这与其气味更为浓郁的现象一致。条斑紫菜中的香茅醇、氧化芳樟醇、正己醇、丁内酯等含量显著高于坛紫菜,然而饱和醇类和酯类的阈值一般较高,因此这些成分对条斑紫菜的气味贡献不大[28]。醛类化合物阈值一般较低,又具有叠加效应,往往在食品风味中起重要作用[29]。条斑紫菜中苯乙醛(阈值为4.0 μg/kg)、壬醛(阈值为1.0 μg/kg)含量相对较高,其中苯乙醛可产生青草香或花香,壬醛具有蜡香、甜橘香或脂肪香气,对条斑紫菜的整体愉悦气味有较大贡献。
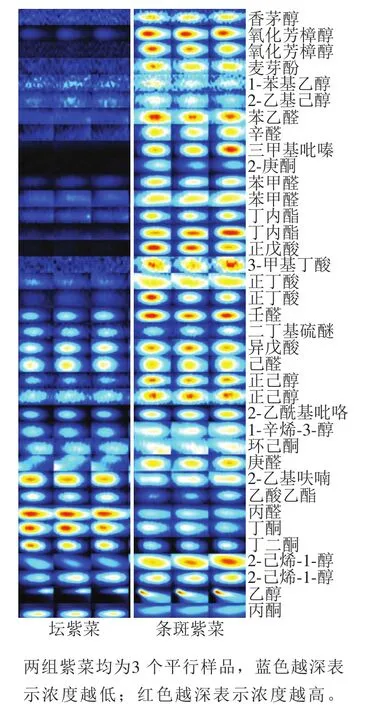
图2 坛紫菜与条斑紫菜的气味指纹图谱Fig. 2 Major volatile components in P. haitanensis and P. yezoensis identified by GC-IMS
3 讨 论
随着社会的进步和经济的发展,消费者对食品的需求已不再仅满足于营养、安全,对食品风味有了更高的追求。在对食品风味进行评价时,感官评定直观、快速,但易受主观因素的影响。采用生化指标检测的方法,结果准确、客观,但过程相对繁琐。近年来,以快捷、准确、无损为特征的食品品质评价新技术得以快速发展,如电子舌、电子鼻等[30-31]。气相色谱-质谱联用法、气相色谱-吸闻法、气相色谱-质谱/吸闻法等是目前研究水产品挥发性成分通常采用的技术手段[32-34]。这些方法存在检测时间长、设备昂贵、维护成本高等缺点。本实验中采用的气相色谱-离子迁移谱法具有选择性和灵敏度高、分析速度快、设备体积小、能耗低等优点。此外,由于离子迁移谱是基于离子的移动性而不是质量进行分离,因此可以很好地分辨出质量相同但结构不同的化合物。
经济藻类特有的风味正逐渐引起国内外科研工作者的关注。目前研究主要集中在挥发性物质方面,如Miyasaki等[35]研究发现高品质的紫菜中辛醛含量普遍较高;应苗苗等[19]研究发现不同采收期坛紫菜的挥发性成分有显著差异;李微等[20]认为坛紫菜的挥发性成分与养殖海域有密切关系等。本实验对坛紫菜和条斑紫菜的气味成分进行对比分析,发现条斑紫菜总的挥发性物质更为丰富,尤其是苯乙醛、壬醛等低阈值的醛类化合物含量极显著高于坛紫菜(P<0.01),这与Miyasaki等[35]的研究结果基本一致。坛紫菜和条斑紫菜在挥发性成分方面的差别不仅与品种有关,南、北海域不同的温度、盐度、光照强度等生态环境条件也是重要的影响因素。
目前有关紫菜滋味方面的研究还较少。本实验采用电子舌技术绘制了坛紫菜和条斑紫菜的滋味轮廓,并通过检测游离氨基酸、呈味核苷酸等成分探究了两种紫菜在鲜味方面存在差异的原因。本实验使用的TS-5000Z型电子舌是目前国际上为数不多的商品化味觉分析系统之一[36]。该系统加载具有选择特异性的人工脂膜传感器,通过检测各种滋味化合物与脂膜之间的静电或疏水作用产生的膜电势的变化,实现对滋味的量化评价。电子舌在食品工业领域得到了广泛应用,如不用产品之间的风味对比、产品研发、产品质量控制等[16,37]。然而,水产品的滋味形成机制比较复杂,不仅与呈味物质的种类和含量有关,不同类别的化合物之间可能存在的相互作用对滋味也有很大影响。另外,电子舌目前还无法将与人类味觉相关的所有感官、生理和心理因素整合到单一的分析程序中。因此,在对食品进行滋味分析时仍需结合感官评定、滋味物质的定性定量分析等多种手段进行综合评价。
4 结 论
坛紫菜和条斑紫菜在滋味方面存在显著差异,坛紫菜的整体滋味更为丰富,鲜味、鲜味回味、苦味、涩味的强度值均高于条斑紫菜,这与游离氨基酸、呈味核苷酸以及EUC的分析结果基本一致。2 种紫菜在气味方面同样差异明显,条斑紫菜中气味物质的总体含量更高,尤其是苯乙醛、壬醛等低阈值的化合物对其整体愉悦气味有较大贡献。在研发或生产紫菜产品时,应充分考虑不同品种原料的风味特点,实现紫菜资源的高值化、高质化利用。

