LPS激活中脑胶质细胞条件性培养液对神经元损伤及淫羊藿素的神经保护作用
杨叶,姜国弈,金明睿,李俊洁,刘志美,陈文芳
(青岛大学基础医学院生理学与病理生理学系,山东 青岛 266071)
帕金森病(PD)的发病机制与神经炎症密切相关[1-2]。在微环境发生变化或病理损伤以后,小胶质细胞迅速活化,而活化的小胶质细胞分泌的白细胞介素1α(IL-1α)、肿瘤坏死因子α(TNF-α)以及补体1q(C1q)等能进一步诱导星形胶质细胞释放炎性因子,造成神经元的损伤[3-4]。而受损的神经元通过释放神经毒性因子与死亡相关的分子,例如神经黑色素、β肽和细胞碎片,进一步引起胶质细胞活化,从而在胶质细胞的炎症反应以及神经元的损伤之间形成恶性循环[5-7]。因此,有效抑制胶质细胞的过度活化是PD防治的有效策略。研究表明,雌激素可通过雌激素核受体(ER)、雌激素膜受体(GPER)及其与胰岛素样生长因子1受体(IGF-1R)信号途径的交互作用发挥神经保护作用[8-10]。淫羊藿素(ICT)是提取自小檗科植物淫羊藿的一种植物雌激素,能够与雌激素受体结合,具有抗炎、骨保护、抗癌等多种功效[11-13]。本课题组前期实验表明,10 μmol/L ICT能够通过ER信号途径,抑制星形胶质细胞的炎症反应[14],但其抗炎神经保护作用是否与GPER和IGF-1R介导的信号途径有关尚不清楚。本研究在前期工作的基础上,观察脂多糖(LPS)激活的中脑胶质细胞条件性培养液对神经元的损伤作用,探讨ICT抗炎神经保护作用是否与GPER和IGF-1R信号途径有关。
1 材料与方法
1.1 实验材料
ICT购自上海同田生物技术有限公司;LPS、GPER特异性阻断剂G15以及IGF-1R特异性阻断剂JB-1均购自美国Sigma公司;四甲基偶氮唑蓝(MTT)购自Silarbio(北京)公司;新生SD大鼠购自青岛即墨大任富城畜牧有限公司。
1.2 原代胶质细胞培养
取新生1 d的SD大鼠,用体积分数0.75的乙醇溶液消毒,在超净工作台中取出其中脑组织,置于DF12基础培养液(冰浴)中,用枪头将组织吹打为均匀分散的细胞。离心,弃去培养液,加入适量含有100 kU/L青霉素、100 mg/L链霉素和体积分数0.10胎牛血清(FBS)的DF12全培养液,置于用20 g/L多聚-D-赖氨酸(Poly D)预处理4 h以上的培养瓶中(培养瓶用高压灭菌水清洗2~3次),在细胞培养箱中培养1周左右,每隔2~3 d换液。光镜下观察,星形胶质细胞紧密相连位于底层,体积较小、折光性强、呈圆形的小胶质细胞在其上层。
1.3 腹侧中脑神经元培养
在取神经元的前1 d,用Poly D溶液铺满培养板底部,过夜,弃掉Poly D溶液,将培养板用无菌水洗3次,在超净工作台中晾干。选取妊娠14 d左右的大鼠,麻醉后进行全身消毒,腹侧朝上摆放大鼠,用大剪刀剪开大鼠腹部皮肤及肌肉,用镊子夹出胎鼠,用小剪刀剪断与大鼠之间的连接,迅速放入培养皿中。剪开胎衣,将胎鼠放入新的培养皿中。剪开羊膜,去除胎盘,放入新的培养皿中。剪下头颅,放入新的带有DF12基础培养液(冰浴)的培养皿中,在体视显微镜下用眼科镊将头颅皮肤及头盖骨撕开剥离大脑,然后将中脑与其余部分分离,去除中脑脑膜,将中脑背侧去除得到蝴蝶形的中脑腹侧,将中脑腹侧移入新的带有DF12基础培养液(冰浴)的培养皿中,用微量移液枪轻轻吹打组织直至细胞均匀离散,移入离心管中,以1 000 r/min离心5 min。离心完成后,用吸管将上清吸除,向离心管中加入中脑腹侧神经元培养液,用吸管轻轻吹匀并调节细胞密度至1×109/L,之后种板。放置于细胞培养箱中,2~3 d换1次液,培养7 d后用于下一步实验。
1.4 实验分组及处理
将小胶质细胞和星形胶质细胞混合接种于12孔板,置于含体积分数0.05 CO2的37 ℃无菌培养箱中,应用高糖DMEM培养液(含100 kU/L青霉素、100 mg/L链霉素和体积分数0.10 FBS)常规培养。光镜下观察当细胞融合度达到80%~90%时进行分组和加药处理。将细胞分为对照组(A组)、LPS 组(B组)、ICT+LPS 组(C组)、G15+ICT+LPS组(D组)和JB-1+ICT+LPS组(E组)。对照组细胞给予1 μL二甲基亚砜(DMSO)处理;LPS 组细胞则加入LPS(0.5 mg/L)作用24 h;ICT+LPS 组细胞加LPS前先用ICT(10 μmol/L)预保护1 h;G15+ICT+LPS组和JB-1+ICT+LPS组细胞分别先加入G15(1 mmol/L)、JB-1(1 mg/L)作用1 h,然后加入 ICT预保护1 h,再加入 LPS 共同作用24 h。将12孔板中的条件性培养液(100 mL)转移至培养神经元的96孔板中,作用24 h。
1.5 细胞活力检测
采用MTT法检测细胞活力。弃掉96孔板中的培养液,每孔加入5 g/L的MTT溶液20 μL,置细胞培养箱内孵育 4 h,弃掉MTT溶液,每孔加入 200 μL的DMSO,用铝箔纸包好培养板避光,然后放在室温摇床上约 10 min,用酶标仪检测吸光度。实验重复3次。
1.6 统计学分析
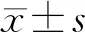
2 结 果
与对照组比较,LPS组神经元细胞活力明显下降(F=15.88,q=10.040,P<0.01),表明中脑原代胶质细胞条件性培养液能够明显降低中脑原代神经元的活力。ICT(10 μmol/L)预处理能够明显抑制LPS诱导的胶质细胞炎症反应进而保护中脑神经元(q=7.457,P<0.01),此作用可以被IGF-1R特异性阻断剂JB-1所阻断(q=5.098,P<0.05);而GPER特异性阻断剂G15预处理对ICT的神经保护作用虽有阻断趋势,但差异无统计学意义(P>0.05)。见表1。

表1 各组神经元细胞活力比较
3 讨 论
PD的病理特征主要表现为黑质致密带多巴胺能神经元变性死亡[15]。神经炎症一直被认为与神经退行性疾病的发生与发展密切相关[16]。小胶质细胞在中枢神经系统内充当免疫细胞的角色,是中枢神经系统的第一道防线,其过度激活是发生神经炎症的主要原因[7,17]。小胶质细胞活化导致促炎细胞因子如白细胞介素1(IL-1)、白细胞介素6(IL-6)和TNF-α等大量释放,进而损伤神经元[18]。星形胶质细胞是神经系统数量最多、分布最广的神经胶质细胞,可调节突触活动、神经元代谢和局部血液供应等,已有研究表明其功能失调在神经退行性疾病发生中发挥重要作用[19-21]。星形胶质细胞衍生的细胞外囊泡可通过传播和放大神经炎症反应,充当炎症信号的胞间传递者,降低神经元的存活率[22]。
ICT是一种黄酮类化合物,主要来源于小檗科淫羊藿属植物,具有抗炎、抗氧化以及骨保护等功效[23-24]。已有研究表明,ICT可以通过GPER介导的EGFR-MAPK信号通路调节刺激SKBr3细胞增殖[25]。本课题组在前期工作中已证实,IGF-1R参与了ICT在1-甲基-4-苯基-吡啶离子(MPP+)诱导的MES23.5细胞中的神经保护作用[26],单独使用GPER阻断剂G15和IGF-1R阻断剂JB-1并不影响小胶质细胞和星形胶质细胞炎性因子的释放,因此推测阻断剂单用可能不影响神经元的细胞活力。为探讨ICT的抗炎神经保护作用是否与GPER和IGF-1R有关,本研究利用LPS诱导混合培养的小胶质细胞和星形胶质细胞炎症反应,观察ICT是否能够发挥抗炎作用进而保护神经元,以及GPER特异性阻断剂G15和IGF-1R特异性阻断剂JB-1的阻断作用。结果显示,LPS处理混合培养的小胶质细胞和星形胶质细胞24 h后,其条件性培养液能使神经元的细胞活力明显下降,应用ICT预处理能明显对抗LPS诱导的神经元损伤,此作用可以被JB-1所阻断,虽然G15有一定的阻断效果,但差异无统计学意义。文献报道,IGF-1R与ER共表达并参与交联,涉及多方面的协同作用,例如,IGF-1刺激髓核细胞,能通过IGF-1R与ERα之间的相互作用调节增殖和抗炎反应[27];淫羊藿苷刺激成骨细胞,能快速诱导IGF-1信号通路激活ERα和Akt,促进成骨作用[28]。在前期工作中,本课题组应用原代培养的中脑星形胶质细胞证明ICT能够通过ER发挥其抗炎作用,应用中脑原代小胶质细胞证明ICT能够通过IGF-1R和GPER发挥抗炎作用,结合本次研究的实验结果,我们推测ICT的抗炎神经保护作用可能与ER、GPER和IGF-1R等3条信号通路有关,但具体机制还需进一步研究。
综上所述,ICT能够通过抑制LPS诱导的中脑胶质细胞炎症反应保护神经元,此作用与IGF-1R介导的信号途径有关。本研究结果为探究ICT抗PD的机制提供了实验依据。

