种植体周围牙周致病菌早期定殖临床研究
徐 典,朱明慧
(空军军医大学第三附属医院急诊与综合临床科,陕西 西安710032)
种植义齿作为一种修复方式近年发展迅速,种植修复的长期效果已被广大患者和口腔医师肯定[1]。但随着种植义齿在临床上的广泛应用,种植修复失败的病案也逐渐增多[2]。有研究显示种植义齿失败率约为3.0%~15.8%[3]。目前大多数学者认为的种植失败原因为机械性刺激或牙周感染所致的种植体周围组织的损伤[4]。国内外许多学者对牙周致病菌在种植体周围定殖进行了研究,认为牙龈卟啉菌(Porphyromonas gingivalis,Pg)、中间普氏菌(Prevotella intermedia,Pi)、伴放线放线杆菌(A.actinomycetemcomitans,Aa)等致病菌定殖与种植体周围龈沟深度高度相关[5]。这些牙周致病菌定殖于种植体周围的龈沟中,刺激机体释放一系列炎性因子,诱发炎症反应[6],影响并破坏骨整合过程,导致种植体修复失败[7]。本研究选择以上三种种植体周围炎和牙周炎的共同主要致病菌作为研究对象,在早期种植体周围进行细菌学纵向检测和鉴定,对早期种植体周围牙周致病菌的定殖,及其与时间的关系进行研究,探讨种植体植入后牙周致病菌定殖的基本规律,为预防早期种植体周围炎的发生,提高种植修复的成功率提供实验依据。
1 对象与方法
1.1 研究对象 选取2019年1月至2020年12月就诊于空军军医大学第三附属医院急诊与综合临床科,接受种植修复的缺失牙齿数量≤2颗的牙列缺损患者52例,男26例,女26例,年龄22~65岁。其中非牙周病缺牙组30例,牙周病缺牙组22例。其中非牙周病缺牙组男13例,女17例;牙周病缺牙组男13例,女9例。为排除牙位导致的刷牙清洁效率的不同,本研究中种植位点以前牙或前磨牙、磨牙加以区分,非牙周病缺牙组前牙或前磨牙12例,磨牙18例;牙周病缺牙组前牙或前磨牙10例,磨牙12例;以上各因素经分析均无统计学差异(均P<0.05),具有可比性。病例纳入标准:全身无系统性疾病,牙周病缺牙组患者在行一期种植体植入术前已经接受牙周治疗并停止使用抗生素3个月;无吸烟史,或种植手术前6个月已成功戒烟;拍片观察牙周病进入静止期;愿意配合临床治疗和后期随访,并签署知情同意书。排除标准:吸烟患者;精神性疾病患者;在拟种植区域有种植体脱落史的患者;在拟种植区域存在肿瘤,慢性骨丧失类疾病;曾有放射性治疗史等疾病的患者,以及拒绝参加或无法配合复查采样的患者。
1.2 研究方法 术前检查包括开口位锥形束CT(CBCT)、血常规、术前感染四项等,检查是否符合筛选标准;所有患者选用骨水平种植体,自由手操作,埋入式愈合。一期手术后行常规抗炎治疗。选择种植体对侧同名牙作为对照牙。若种植体对侧同名牙不是天然牙,则选择种植体对颌牙。种植后6个月行牙片检查骨结合情况,进行二期手术。于术中采集种植体根部样本,种植二期术后12 d取模,此时采集种植体及对照牙的龈袋底样本。种植二期术后24 d复诊戴牙,此时采集种植体及对照牙的龈袋底样本。
1.3 取样方法 ①对照牙:一期术前准备前取样,对照牙牙周围用棉球搽干隔湿、气枪吹干。用3个30号纸尖插入牙的近颊、颊侧和远颊牙周袋袋底,静置30 s,纸尖立即置于1.5 ml EP管中,PBS缓冲液200 μl,-20 ℃冻存,待用。②种植二期手术:患者在局麻下,切除种植钉上牙龈组织,暴露种植体,局部止血,去除封闭螺丝,将3个30号纸尖置于种植体内部30 s,纸尖立即置于1.5 ml EP管中,200 μl PBS浸泡,-20 ℃冻存。③种植二期术后12 d:将种植体周围棉球搽干、隔湿、气枪吹干,用3个30号纸尖插入种植体的近颊、颊侧和远颊牙周袋袋底,静置30 s,纸尖立即置于1.5 ml EP管中,PBS缓冲液200 μl,-20 ℃冻存,待用,用同样方法同时取对照牙标本。④种植后二期后24 d:将种植体周围棉球搽干隔湿、气枪吹干,用3个30号纸尖插入种植体的近颊、颊侧和远颊牙周袋袋底,静置30 s,纸尖立即置于1.5 ml EP管中,PBS缓冲液200 μl,-20 ℃冻存,待用。用同样方法同时取对照牙标本。
1.4 对照设置 以 Pg ATCC 33277、Aa ATCC 33384、Pi ATCC 25611原菌液(均为空军军医大学第三附属医院实验室提供)作为阳性对照,具体参数见表1。

表1 引物设计表
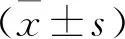
2 结 果
2.1 三种牙周致病菌菌株的PCR扩增 针对三种牙周致病菌的16sDNA设计引物进行常规PCR检测,扩增片段电泳图(图1)。

1道为Aa扩增产物条带;2道为Pi扩增产物条带;3道为Pg扩增产物条带图1 三种细菌单独PCR扩增电泳图
2.2 临床龈沟液样本多重PCR扩增阳性结果 见表2。将采样标本按照预实验摸索成熟的反应条件进行扩增,出现阳性结果的电泳图(图2~4)。牙周病缺牙组中,1例患者(编号25)一期术前对照牙龈沟内发现Pg(图2中1道);1例患者(编号38)二期术后12 d对照牙龈沟内发现Pg(图2中7道);1例患者(编号14)二期术后12 d对照牙龈沟内发现Pi(图2中8道);以上3例患者在二期术后24 d时在对照牙和种植体周围均检出相同牙周致病菌定殖(图3、4)。1例患者(编号52)一期术前对照牙龈沟内发现Aa(图2中11道),但在随后的采样中再未检出。在非牙周病缺牙组中只有2例患者在一期术前的对照牙龈沟内检测出Pi(图2中2道及17道),后期的历次采样中均未能检出Pi。

表2 牙周病缺牙组阳性检出情况

A、B、C道分别为Aa、Pi和Pg阳性对照;Marker自下而上分别为100、250、500、750、1000、2000 bp;1道和7道Pg阳性,11道Aa阳性,8道Pi阳性,均为牙周病组检出;2道和17道Pg阳性,为非牙周病缺牙组检出图2 两组在一期术前和二期术后12 d三种细菌阳性检出
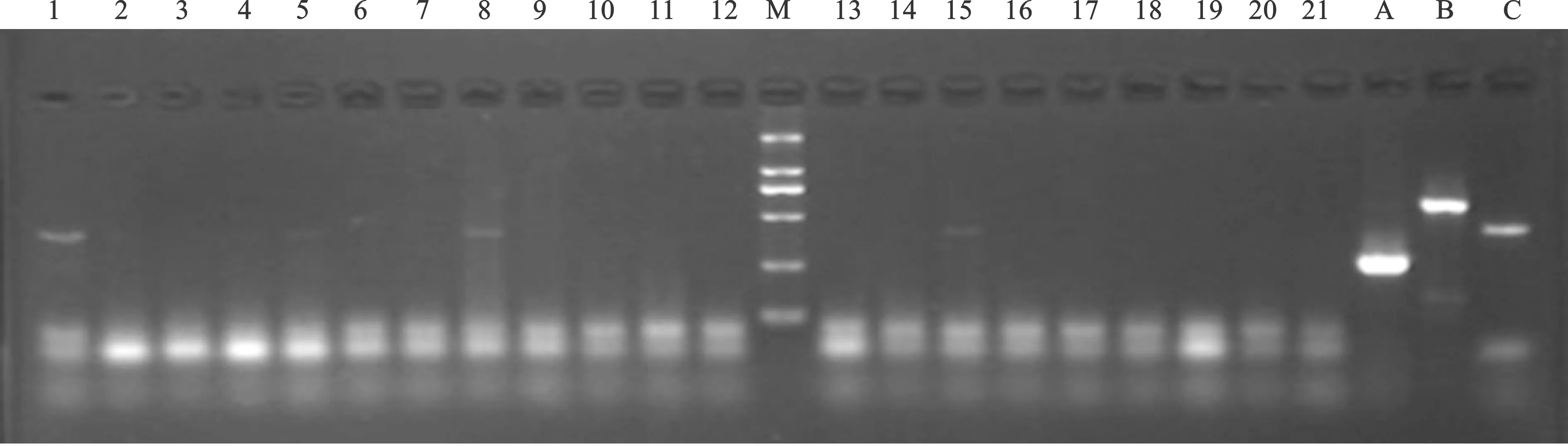
A、B、C道分别为Aa、Pi和Pg阳性对照;M道为Marker,自下而上分别为100、250、500、750、1000、2000 bp;1道和5道与图2中1道为同一患者,8和15道与图2中7道为同一患者,连续检出Pg图3 患者二期术后24 d口内种植体和对照牙Pg检出阳性

M道为Marker,自下而上分别为100、250、500、750、1000、2000 bp;13道和15道为Pi阳性图4 图1中8道Pi阳性患者口内于术后12 d和24 d连续检出Pi
2.3 各组阳性检出率统计 非牙周病缺牙组30例患者中有2例检出牙周致病菌,检出率6.67%;牙周病缺牙组22例患者牙周致病菌检出为4例,检出率为18.18%。两者之间比较无统计学差异(χ2=1.649,P>0.05),见表3。以三种牙周致病菌检出例次为单位计算,非牙周病的患者共采集标本88例次,其中有10例次有牙周致病菌检出,检出率为1.67%;而牙周病组采集标本88例次,有10例次有牙周致病菌检出,检出率为11.36%,两者之间比较存在统计学差异(χ2=8.781,P<0.05),见表4。

表3 两组患者阳性检出情况比较(例)

表4 两组患者阳性检出例次比较(例/次)
3 讨 论
在牙周感染所致的种植体周围组织损伤中,种植体周围炎是种植义齿修复的常见并发症,是导致种植修复失败的主要原因[8]。种植义齿能否长时间留存于患者口内并正常行使功能,与种植体周围组织是否健康密切相关,包括种植体与骨组织的良好骨结合,以及种植体与邻接上皮和结缔组织纤维良好的结合状态[9]。诸葛春耕等[10]研究表明,种植义齿由于其特殊的解剖结构环境,更容易遭受口腔微生物的侵袭。有研究指出,种植体周围炎的发病率近33%[11],以种植体数量计算,种植体周围炎发生率约为20%,且呈逐年增长的趋势[12]。 细菌感染是种植体周围炎发生的最主要因素,包括常见的牙周致病菌,如牙龈卟啉单胞菌(Pg)、伴放线放线杆菌(Aa)、中间普氏菌(Pi)、福赛坦氏菌(Tannerella forsythia,Tf)和齿垢密螺旋体(Treponema denticola,Td)等[13]。
本研究仅就龈沟液样品进行多重PCR定性检测,以考察受检患者牙周致病菌的携带情况。在牙周病缺牙组有10例次,共3例患者连续检测出牙周致病菌的存在,另有1例患者与一期术前检测出Aa的存在。而其他病因导致缺牙的患者中只有2例有牙周致病菌的检出,两组间进行χ2检验后,检出例数两组无统计学差异,但检出例次存在统计学差异。说明牙周致病菌在种植体周围定殖的机会很高。Koka等[14]发现二期术后14 d细菌会在牙龈边缘定殖,而龈下菌群的定殖约需28 d,说明牙周致病菌在种植体周围的定殖比天然牙更早。Mombelli等[15]发现,种植体周围菌群数量和种类与邻近天然牙龈沟内的定殖菌群相似,85%以上为球菌,80%以上是革兰阳性兼性厌氧球菌。植入后6个月,未发现菌群有显著改变。另有学者对种植修复后患者追踪调查,发现有牙周病史的牙列缺损患者种植体周围可检出牙周致病菌从邻牙牙周组织传播到种植体周围[16]。本研究的结果也印证以上结论。可见种植体周围牙周致病菌的早期定殖受到种植体类型、结构、口腔内暴露时间以及口腔内余留牙的影响。虽然目前认为经过系统的牙周治疗后,牙周病进入静止期,牙槽骨停止病理性吸收,可以进行牙种植术,但患者口内的牙周致病菌仍然有可能迁移并定殖于种植体穿龈部位。
本研究中,在牙周病组中有4例共10例次有牙周致病菌的检出,并且有3例是连续的检出,提示在种植体植一旦暴露于口腔内,牙周致病菌就会进入种植体周围定殖,其种类与对照牙的阳性细菌相同,在此印证了种植体周围细菌来自口内天然牙牙周菌群的学说[17]。但国外有研究发现,种植体周围炎中的微生物中检测出的牙周致病菌中福赛坦菌最多,其次是具核梭杄菌及齿垢密螺旋体,但作为牙周病主要致病菌的伴放线放线杆菌和牙龈卟啉单胞菌的含量较少[18];有学者报道,牙周炎的发生与牙龈卟啉单胞菌、具核梭杆菌水平相关,而种植体周围炎与这两种微生物无显著关联[19]。目前的观点认为两者的主要致病微生物并不完全相同,种植体周围炎中的菌斑微生物种类较正常的种植体周围组织和传统的牙周炎更加复杂[20]。
本研究中,牙周病缺牙组中有3例患者在种植义齿完成时发现其种植体周围已经有与对照牙相同种类的牙周致病菌定殖,提示对于牙周病静止期患者进行种植体修复时应考虑牙周致病菌的因素。1例患者在一期术前对照牙检测出Aa的定殖,但是在随后的各时间节点均未能检测出牙周致病菌的定殖。以上结果与Waal等[21]的研究类似,该学者发现种植体周围的破坏程度与牙龈卟啉单胞菌(Pg)、中间普氏菌(Pi)、福赛坦氏菌(Tf)和具核梭杄菌(Fn)的龈下定殖存在显着相关,Pi和Tf与疾病状况的关联最为明显,伴放线放线杆菌(Aa)和葡萄球菌的检出率很低。就非牙周病导致缺牙的患者来说,其阳性检出率仅6.67%,并且没有连续检出的病例。原因可能是:①样本量不够大。②本研究对种植修复期间的常规口腔保健措施并没有加以控制,如术后40 d口水抗菌治疗等;只是告知病人在此基础上不必使用任何口服或注射用抗菌素。所以非牙周病组的检出率较低只能说明与牙周病缺牙的患者相比,其种植修复过程中受到牙周致病菌影响的几率较低而已,而并不意味着牙周组织健康的患者在进行种植修复构成中完全没有牙周致病菌感染和种植失败的危险。③检测手段的局限性。最新的研究显示,人类口腔内微生物可能近1.9万种,而目前的技术手段能够检测出700余种[22],仅用一种方法难以精确测定种植体周围牙周致病菌的存在。已有学者采用MiSeq测序、QIIME(Quantitative insights in microbial ecology)技术、Mothur软件、LEfSe差异分析、Network网络分析等先进的检测手段进行牙周致病菌群的定性、定量研究,在不久的将来也势必会应用于种植体周围炎的研究[23]。
可见,种植体周围细菌来自口内天然牙牙周菌群。由于年龄、饮食、口腔卫生习惯的不同,种植体植入后其周围的细菌组成受多种因素影响。所以对牙周组织健康的患者仍然要注意口腔牙周致病菌的控制,对牙周致病菌易感染群的种植适应证和控制,纠正不良口腔卫生习惯,严格菌斑控制,以降低种植体周围牙周致病菌的繁殖,延长种植体使用寿命。

