DEPDC5基因表达对胃癌MKN-28细胞凋亡的影响
周 威,洪 舟,符兆英
(1.延安大学医学院免疫教研室,陕西 延安716000;2.西安市第五医院急诊科,陕西 西安 710082)
人DEP 结构域包含5(Dishevelled,Egl-10,and pleckstrin domain-containing protein 5,DEPDC5)基因位于22号染色体长臂1区2带2亚带至1区2带3亚带,具有GTP酶活性。DEPDC5与NPRL2和NPRL3结合形成复合体GATOR1后可以抑制mTORC1活性,进而调控哺乳动物雷帕霉素靶蛋白(mTOR)功能的发挥[1]。 大量研究表明DEPDC5与神经发育、癫痫的发生、治疗及预后相关:DEPDC5基因表达与大脑及神经元发育有关——shRNA下调DEPDC5基因表达可激活mTORC1信号,促进神经细胞的增殖和神经元树突的形成[2],并且,DPEPDC5基因突变与癫痫的发生,癫痫患者的脑损伤、脑发育不良、抗癫痫药物的不良预后等相关[3-5]。mTORC1属于蛋白丝/苏氨酸激酶,在肿瘤发生发展过程中mTORC1通过PI3K/Akt/mTOR和Ras/Raf/MEK/ERK通路调节肿瘤细胞生长、凋亡、侵袭和迁移的作用已被广泛报道[6-8]。然而,作为mTORC1的负性调节因子,DEPDC5相关的肿瘤研究报道还相对较少,但已有报道显示DEPDC5与肝炎病毒感染导致的肝细胞癌相关[9-11];胃肠道中,DEPDC5突变失活与胃肠道间质瘤的形成相关[12];并且DEPDC5的磷酸化可使其对mTORC1的抑制作用降低,进而促进肿瘤细胞的生长[13]。DEPDC5及其下游基因mTORC1在肿瘤中的作用提示,DEPDC5可能在肿瘤发生发展过程中发挥作用。研究[14]表明:DEPDC5高表达与消化道肿瘤发生相关,为进一步探究DEPDC5在肿瘤发生发展中的作用,本文对DEPDC5基因表达与胃癌侵袭、迁移及凋亡的关系进行了探究,现报告如下。
1 材料与方法
1.1 实验材料 人胃癌细胞株MKN-28为延安大学医学院医学实验研究中心保存。细胞培养用胎牛血清购自BI公司(以色列);RPMI-1640、Trizol购自赛默飞 (美国);转染试剂jetPRIME购自Polyplus (法国);逆转录试剂盒PrimeScriptTM1st Strand cDNA Synthesis Kit购自TaKaRa(日本);荧光定量PCR试剂盒购自康润生物(中国),Transwell 小室购自康宁(美国),Annexin V-FITC/PI细胞凋亡检测试剂盒购自贝博生物有限公司(中国),Caspase 3和β-actin购自博士德公司(中国)。DEPDC5的小干扰RNA(siRNA-DEPDC5)和阴性对照siRNA(siRNA-NC)购自上海吉玛基因(中国)。荧光定量引物由奥科鼎盛生物科技有限公司(中国)合成。
1.2 实验方法
1.2.1 细胞培养及处理:MKN-28细胞培养于含10%胎牛血清的RPMI-1640培养液中。细胞培养条件为37 ℃,5% CO2。使用jetPRIME转染试剂,按试剂说明书进行siRNA的转染,转染4 h后更换培养基。siRNA-DEPDC5干扰序列为,sense:5’-AAGGACUUCACGGACUUCUGC-3’,anti-sense:5’-GCAGAAGUCCGUGAAGUCCUU-3’,siRNA-NC的序列为,sense:5’-CCATCGCAACCUCGAUCGCAU-3’,anti-sense:5’-AUGCGAUCGAGGUUGCGA-
UGG-3’。
1.2.2 凋亡检测:细胞转染36 h后,依试剂说明书处理细胞并对其进行染色,流式细胞仪检测各组细胞的凋亡情况。
1.2.3 荧光定量PCR(q-PCR)检测DEPDC5基因相对表达量变化:首先用Trizol裂解法提取各细胞样本中的总RNA。以上述总RNA为模板,用Oligo dT,和随机引物按试剂说明书合成cDNA片段。之后,以反转录所得cDNA为模板,GAPDH为内参基因,用荧光定量PCR试剂盒RealStar SYBR Green qPCR Power Mixture分别检测DEPDC5在不同处理组中的表达变化。定量引物序列为:DEPDC5-F,5’- AGTGTTCCGGCTGAGACCTTA-3’;DEPDC5-R,5’-CCACGGCCAATATACTGATCCT-3’;GAPDH-F,5’- GGAGCGAGATCCCTCCAAAAT;GAPDH-R:5’-GGCTGTTGTCATACTTCTCATGG-3’。DEPDC5基因的相对表达量以2-ΔΔCt进行计算,结果以3次实验的计算结果的平均值表示。
1.2.4 Western blot检测Caspase 3表达:细胞转染36 h后,分别收集各处理组细胞,用含全蛋白酶抑制剂的RIPA裂解液裂解细胞,BCA蛋白定量后进行蛋白电泳,湿转法进行蛋白质转印,10%脱脂奶粉封闭,4 ℃过夜孵育,TBST洗涤3次,每次10 min,室温孵育第二抗体2 h,TBST洗涤3次,每次15 min,用G-Box采集图片,Image J测定各个条带的光密度值。
1.2.5 划痕实验:细胞转染12 h后,用无菌枪头以十字性进行划痕,拍照记录。待细胞继续培养24 h后,明场拍照记录,观察不同处理组细胞的迁移能力变化。
1.2.6 Transwell小室:细胞转染24 h后,将其接种于无血清培养基的Transwell小室中(上室),下室用含20%胎牛血清的RPMI-1640进行培养。48 h后,用多聚甲醛固定细胞,结晶紫染色,普通光学显微镜下进行观察不同处理组细胞侵袭能力的变化。
2 结 果
2.1 RNA干扰DEPDC5基因表达对胃癌细胞凋亡的影响 见表1。与对照siRNA转染组(siRNA-NC)相比,siRNA-DEPDC5干扰DEPDC5基因表达后,胃癌细胞的凋亡率显著增加(P<0.01)。siRNA干扰DEPDC5时胃癌细胞DEPDC5的表达量降低(图1A)。对凋亡相关蛋白Caspase 3的Western blot检测(图1B,左)及灰度值变化分析(图1B,右)显示,RNA干扰DEPDC5基因表达后,Caspase 3基因表达量增加(P<0.01)。

表1 不同处理组胃癌细胞凋亡情况(%)
2.2 RNA干扰DEPDC5基因表达对胃癌细胞侵袭、迁移的影响 为进一步探究DEPDC5对胃癌生长的影响,采用Transwell和划痕实验检测了siRNA-DEPDC5干扰DEPDC5基因表达时胃癌细胞侵袭、迁移能力的变化,结果显示:与转染siRNA-NC对照组胃癌细胞相比,siRNA-DEPDC5干扰DEPDC5基因表达后MKN-28细胞的侵袭(图2A)、迁移能力无显著变化(图2B),提示DEPDC5基因表达可能与胃癌的进展无关。
3 讨 论
哺乳动物雷帕霉素靶蛋白(mTOR)属于丝/苏氨酸蛋白激酶,是一种进化上十分保守的蛋白激酶,有两种蛋白复合体类型mTORC1和mTORC2,能够通过生长因子、氨基酸和能量等信号的整合调控细胞生长和新陈代谢。其中,mTORC1由mTOR、Raptor、PRAS40、mLST8和Deptor构成[15],其主要信号通路有两条:Ras/Raf/MEK/ERK和PI3K/Akt/mTOR,能够调节细胞生长、存活、血管生成和蛋白质翻译。

注:**P<0.01A:qPCR检测siRNA干扰DEPDC5时胃癌细胞DEPDC5的表达量;B:Western blot检测siRNA干扰DEPDC5后Caspase 3基因的表达变化(左),以灰度值表示其相对变化(右)图1 RNA干扰DEPDC5对凋亡蛋白Caspase 3表达影响
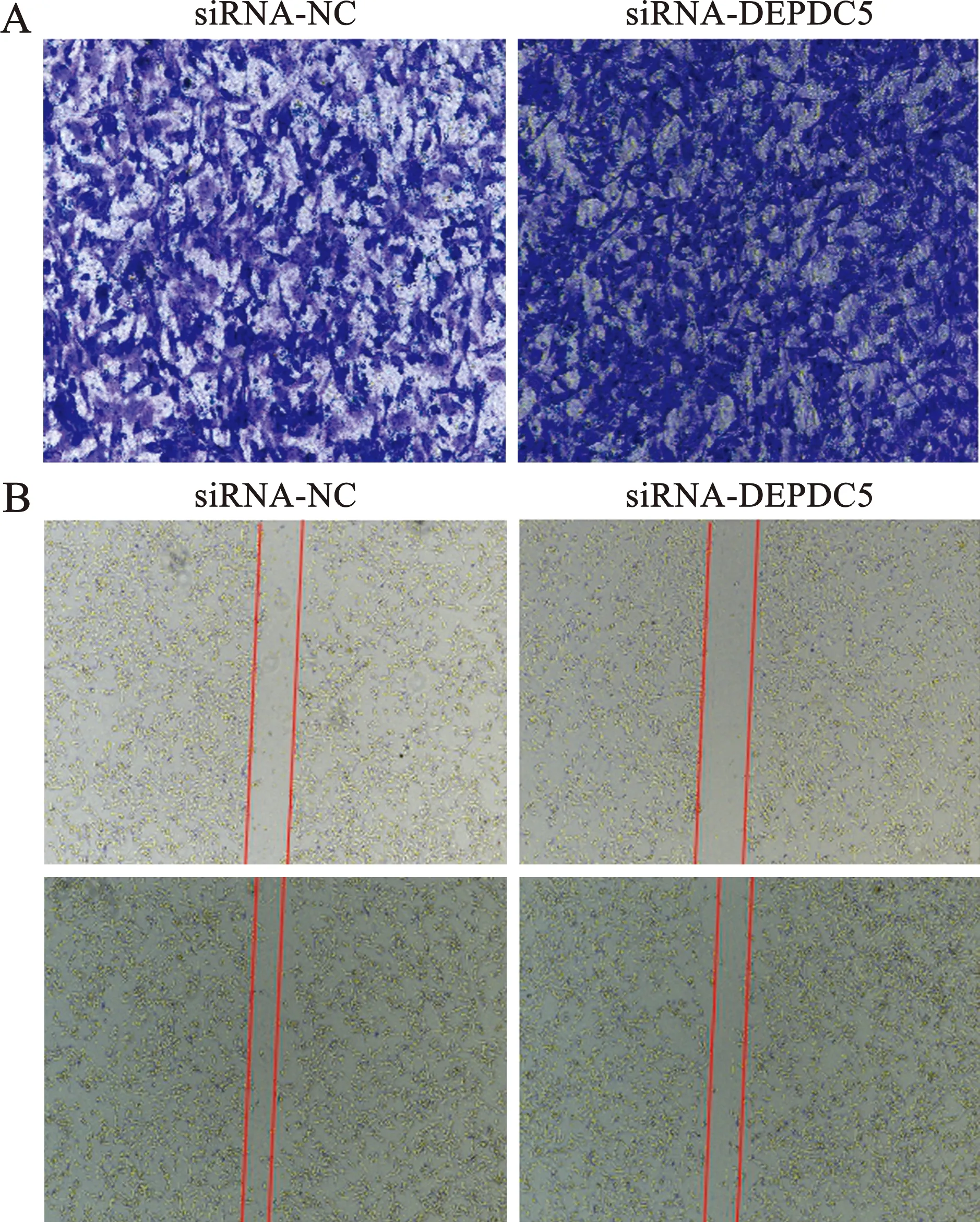
A:不同处理条件下胃癌细胞侵袭能力的变化(结晶紫染色,×200);B:不同处理条件下胃癌细胞迁移能力的变化(明场,×4)图2 RNA干扰DEPDC5对胃癌细胞侵袭和迁移能力的影响
PI3K/Akt/mTOR通路对生长因子敏感,与肿瘤的发生发展密切相关;Ras/Raf/MEK/ERK与能量代谢相关,能够间接调节mTOR的活性。mTORC2由mTOR、Rictor、PROTOR、mLST8、mSIN1和Deptor构成,在细胞生存、细胞骨架形成、多肽、糖类、脂质的降解等方面发挥作用[16]。肿瘤发生发展过程中,已有研究显示多种肿瘤细胞内存在mTOR通路的异常,该通路活性变化可引起癌基因和抑癌基因的活性改变,参与肿瘤的发生、侵袭和迁移。mTOR能够调节TGF-β通路活性调节细胞增殖、分化,通过Bcl-2、细胞色素C和自噬相关基因的表达调节肿瘤细胞发生程序性及自噬性凋亡[17-18]。mTOR在肿瘤发生发展中的作用使其成为潜在的肿瘤治疗靶点[19]。
DEPDC5是mTORC1的负性调控因子——DEPDC5基因缺陷可引起mTORC1信号的增加[20],磷酸化DEPDC5可使其对mTORC1的抑制作用解除[13],并且在体实验显示,使用雷帕霉素抑制mTORC1活性可挽救小鼠神经元DEPDC5缺失导致的行为和生化缺陷[21],DEPDC5对mTORC1活性的影响提示其可能作为mTOR的调控因子参与mTOR相关疾病的发生和发展。在肿瘤研究中,尽管已有研究显示,DEPDC5参与了病毒感染引起的肝癌发生[9-11,22-23],且DEPDC5基因突变与胃肠间质瘤形成过程相关[11]。但因DEPDC5基因转录本较多,其在肿瘤发生发展中的表达变化还不甚清楚,有关DEPDC5在肿瘤发生发展中的作用及作用机制还鲜见报道。探究DEPDC5表达量与肿瘤发生发展的关系和DEPDC5在肿瘤生长中的作用,对揭示肿瘤发生发展的机制具有一定的积极意义。
项目组前期通过TCGA数据分析发现DEPDC5基因表达与胃癌的发生相关,胃癌发生过程中DEPDC5基因的表达增加,高DEPDC5基因表达的胃癌患者生存期较短,提示DEPDC5基因表达变化可能与胃癌的发生发展相关,为探究DEPDC5在胃癌发生发展中的作用,本研究通过体外RNA干扰实验证实,DEPDC5基因表达可能与胃癌的发生相关,并且DEPDC5基因表达与胃癌细胞的迁移和侵袭无关——RNA干扰DEPDC5表达时,胃癌细胞凋亡增加,但侵袭和迁移能力未发现显著变化。然而,研究对DEPDC5在胃癌发生中的作用是否与mTORC1相关通路有关并未进行探究。此外,DEPDC5有多个转录本,研究并未对各转录本进行区分,未来还需进一步对DEPDC5不同转录本在胃癌发生中的作用及作用机制进行探究。显然,以上问题的阐明将会增加我们对DEPDC5参与胃癌发生机制的理解,并为利用DEPCDC5-mTORC1相关通路进行肿瘤的预防和治疗提供理论基础。

