经导管动脉栓塞术联合小干扰核糖核酸治疗肝癌疗效及对兔缺氧诱导因子-1、血管内皮生长因子的影响
陈思攀,杨耀博,焦 阳,颜昭勇
(陕西省人民医院介入放射科,陕西 西安 710068)
肝癌是我国一种常见的、高发的恶性肿瘤,我国每年新增肝癌患者占全球新增的55%,对该病的诊治形势依然十分严峻[1]。目前首选治疗为手术切除,但大部分肝癌患者伴有肝硬化,使手术切除量有一定的限制[2]。近年来,经导管动脉内栓塞(Transcatheter arterial embolization,TAE)介入治疗逐渐成为主要方法之一,但术后远期疗效仍不理想,复发及转移率高[3]。基因治疗领域的重要发现之一是小干扰核糖核酸(Smallinterfering ribonucleic acid,siRNA),为肝癌的靶向治疗提供了新的治疗手段,为不能手术患者的提供了新的途径[4]。siRNA能特异地结合细胞内靶mRNA形成沉默复合体,进而阻断或减少下游蛋白质的合成,此为RNA干扰现象。siRNA诱导的基因沉默特异性高、操作简单、周期短,应用前景广阔[5]。经导管动脉内栓塞能加重缺氧微环境,升高肝癌细胞缺氧诱导因子-1(Hypoxia inducible factor 1α,HIF-1α)的基因表达,继而引起血管内皮生长因子(Vascular endothelial growth factor,VEGF)的异常高表达,刺激肿瘤细胞的增殖[6-7]。本研究通过建立VX2肝癌兔模型,考察TAE联合siRNA干扰HIF-1α对肝癌兔的疗效及对HIF-1α、VEGF表达的影响。
1 材料与方法
1.1 实验材料
1.1.1 仪器与试剂:HIF-1α多克隆抗体购自美国Cell Signaling Technology公司,HIF-1α shRNA购自美国Santa Cruz公司,大规模质粒抽提试剂盒购自Qiagen公司,质粒小量中提试剂盒购自北京天根生化,注射用青霉素钠购自华北制药,血管鞘、Cobra导管等购自Terumo;聚乙烯醇(PVA)微粒购自Cook公司,光学显微镜(OlympusBX53)购自Olympus,Philips Brilliance 64层螺旋CT购自荷兰飞利浦公司,自动生化分析仪(BA-200FR)购自日本东芝公司。
1.1.2 实验动物:以20只2~3个月龄的雄性新西兰大白兔为研究对象,体重2.0~2.5 kg,由杭州余杭科联兔业有限公司提供,许可证号SCXK(浙)2017-0004,合格证号1805160014。试验前进行6 d的适应性单笼饲养,温度20~25 ℃,湿度40%~70%。荷瘤种兔1只,VX2由日本Funbanski公司引进。
1.2 实验方法
1.2.1 动物模型的建立:VX2瘤株从荷瘤兔中获得,将生长完好的实性部分裁剪成1 mm3(长×宽×高为1 mm×1 mm×1 mm)的组织块,放置备用。将实验兔麻醉、开腹及暴露肝脏后,在肝左叶部位植入剪好的肿瘤组织块,用明胶海绵压迫止血,回纳肝脏于腹腔中,逐层缝合实验兔腹壁肌肉、皮肤。术后需保温处理,直到实验兔苏醒,苏醒后放置在笼中,独立饲养,每日肌肉注射1万U/kg青霉素,维持3 d,术后两周所有实验兔全麻下,行MRI 检查,纳入研究标准:肿瘤最大径<3 cm,且坏死灶<瘤体直径1/2者,位于肝实质内,信号均匀。研究中造模兔无脱失,全部纳入结果分析。
1.2.2 HIF-1α-shRNA的合成:第一步构建HIF-1α-shRNA病毒载体,第二步提取质粒,以shHIF-1α质粒对293A细胞进行转染,获得腺病毒。以腺病毒对原代兔皮肤成纤维细胞进行感染,于48 h后检测HIF-1α mRNA的表达,对shRNA进行筛选,以HIF-1α基因敲降效率最高的作为目标HIF-1α-shRNA。
1.2.3 治疗方法:采用随机数字表法将所有肝癌模型兔分为两组,每组10只,所有实验兔均采用1%戊巴比妥钠(3 ml/kg)耳缘静脉麻醉,进行股动脉穿刺,穿刺成功后导入4F血管鞘,将4F Cobra导管插入腹腔干,以0.5 ml/s流率手推3 ml的对比剂 Omnipaque 350,以进行腹主动脉造影,再将2.7F同轴微导管置入肝左动脉内,DSA造影确认移植瘤由肝左动脉供血。两组动物在DSA透视导向下,对照组将PVA微粒与对比剂混悬液缓缓注入肝左动脉,至肿瘤供血动脉血流完全停滞;研究组注入PVA微粒与对比剂混悬液及含有慢病毒颗粒的转染溶液 (含HIF-1α shRNA),注入量为0.6 nmol/L。
1.3 观察指标 ①肿瘤体积:分别于术前1 d和术后28 d,采用螺旋CT进行扫描,测量各组实验兔肿瘤体积。②肝癌组织核分裂象总数:于治疗后28 d,处死实验兔,进行病理学以及免疫组织化学检查。于100倍镜下计算肿瘤区域核分裂象总数。③HIF-1α 蛋白和VEGF蛋白的表达:采用免疫组织化学法,测定肿瘤组织HIF-1α 蛋白、VEGF蛋白的表达情况。④门冬氨酸氨基转移酶(AST)和丙氨酸基转移酶(ALT)水平:分别于术前1 d和术后28 d,采集两组耳缘静脉血,以自动生化分析仪测量两组血浆AST、ALT水平。
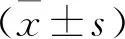
2 结 果
2.1 两组肝癌模型兔肿瘤体积变化 见表1。治疗前两组肿瘤体积比较无统计学差异(P>0.05);治疗后两组肿瘤体积均有一定程度的增加,与治疗前比较,对照组差异有统计学意义(P<0.01),研究组差异无统计学意义(P>0.05);组间比较,研究组治疗后肿瘤体积显著降低(P<0.01)。
表1 两组肝癌模型兔肿瘤体积变化(mm3)
2.2 两组核分裂象总数比较 见表2。 研究组核分裂象总数显著低于对照组(P<0.05)。

表2 两组核分裂象总数比较(个)
2.3 两组HIF-1α蛋白和VEGF蛋白表达比较 见表3。研究组肿瘤组织HIF-1α表达量显著低于对照组(P<0.01),研究组肿瘤组织VEGF表达量显著低于对照组(P<0.01)。

表3 两组HIF-1α蛋白和VEGF蛋白表达比较(pg/ml)
2.4 两组血浆AST和ALT比较 见表4。治疗前两组ALT和AST水平比较均无统计学差异(均P>0.05;治疗后两组ALT、AST水平均高于治疗前(均P<0.01);与对照组相比,研究组治疗后ALT和AST水平均显著降低(均P<0.01)。
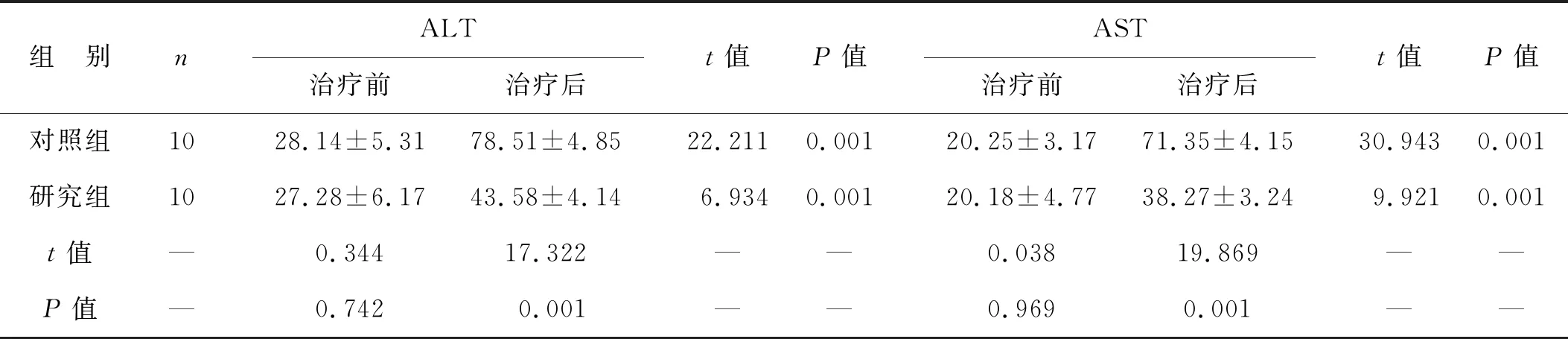
表4 两组血浆AST和ALT比较(U/L)
3 讨 论
原发性肝癌是最常见的消化系统恶性肿瘤之一,在亚洲地区和非洲部分地区发病率高,患者年龄大部分在40~50岁,我国每年新增肝癌患者以及肝癌死亡人数居全球首位,是我国第三的肿瘤死亡原因以及发病率第四高的恶性肿瘤,其发生常与人们的生活习惯的等有关,一直以来,如何对肝癌进行有效的预防和治疗都是研究热点。手术为首选治疗方式,但80%以上患者伴有肝硬化,使得肝切除量受到限制,同时,部分肝癌部位接近第一、第二、第三肝口,为手术治疗造成很大困难,因此,临床上能进行手术切除的患者较少[8]。近年来,TAE逐渐成为治疗肝癌的主要手段之一,但远期疗效有限,可能与TAE治疗后产生缺血缺氧、坏死,肿瘤组织逐渐对缺氧微环境产生适应性有关[9-10]。
基因沉默是近年来基因治疗领域的重要进展,其作用机制包括位置效应、转录水平和转录后水平[11-12]。RNA干扰为一项新兴的基因阻断技术,是一种由双链RNA分子所介导的序列特异性转录后引起基因静默的过程,表现为双链RNA分子在mRN A水平选择性关闭相关基因的表达。在多种肿瘤的治疗中有广阔的发展前景,siRNA水平基因调控的结果为转录后水平基因沉默,该途径对靶基因特异度高,毒性小,不与染色体 DNA相互作用,且诱导靶细胞基因突变的风险较低[13-14]。本研究通过siRNA干扰沉默HIF-1α基因,以抑制TAE 治疗后的肿瘤缺氧适应,从而抑制肿瘤血管生成。结果显示,治疗前两组肿瘤体积比较无统计学差异;治疗后两组肿瘤体积均有一定程度的增加,与治疗前比较,对照组差异有统计学意义;研究组无统计学意义;组间比较研究组治疗后肿瘤体积显著降低。对两组核分裂像总数进行比较,结果显示,研究组核分裂像总数显著低于对照组,两组比较差异有统计学意义。即TAE联合siRNA干扰能有效的抑制肝癌兔肿瘤组织的生长。
HIF-1α在肝癌兔肿瘤组织的缺氧适应中能调控VEGF、IL-6以及TNF-α等多种肿瘤因子的表达[15-16]。其中血管生成调控因子特异性和作用最强的是VEGF,其产生并分泌于肿瘤细胞,具有促进内皮细胞的分裂和生长作用,进而诱导新生血管形成,且VEGF能上调BCL-2的表达,从而抑制肿瘤的凋亡,进而促进肿瘤的生长[17-18]。本研究对两组HIF-1α蛋白和VEGF蛋白表达量进行检测,结果显示,研究组肿瘤组织HIF-1α表达量、VEGF表达量低于对照组。表明TAE联合siRNA能显著抑制缺氧后靶部位HIF-1α和VEGF的蛋白表达。其机制可能在于,TAE能闭塞肿瘤供血动脉,改变肿瘤部位血流动力学,导致HIF-1α-shRNA慢病毒载体长时间停留于靶部位,提高了转染效率;缺氧环境中HIF-1α呈高表达状态,但HIF-1α-shRNA能抑制其表达,进而抑制肝癌组织中新生血管的生成,使癌细胞处于持续缺氧、坏死和凋亡状态,进而提高TAE疗效[19-20]。
药物只要通过肝脏和肾脏进行排泄,易在该部位聚集产生毒性,因此本研究对两组治疗前后两组血浆AST和ALT水平进行比较,结果显示治疗前两组ALT和AST水平比较均无统计学差异;治疗后两组ALT、AST水平均高于治疗前;与对照组相比,研究组治疗后ALT和AST水平均显著降低。表明HIF-1α-shRNA在抑制肿瘤的生长的同时,未增加肝癌兔的肝肾毒性,而对照组的ALT和AST水平更高,说明可能肿瘤本身对于肝肾功能损害更严重。
综上所述,TAE联合siRNA干扰HIF-1α能通过降低HIF-1α和 VEGF蛋白表达量抑制肝癌兔肿瘤的生长。

