刺梨多糖对小鼠黑色素瘤抑制作用实验研究
陈 慧,常 瑛,刘振国
(西北妇女儿童医院,陕西 西安 710061)
黑色素瘤是发生于皮肤或黏膜表面的来源于神经嵴黑色素细胞的恶性肿瘤,其恶性程度高,极易发生转移侵袭,是皮肤恶性肿瘤主要的死亡原因之一[1]。目前手术治疗、放疗和化疗是治疗黑色素瘤的主要方法,但其对放化疗均不敏感,临床预后差,病死率高[2]。研究发现,黑色素瘤为免疫原性较高的肿瘤,机体免疫反应的低下是肿瘤发展和转移的重要原因,因此针对黑色素瘤的免疫治疗得到广泛关注[3]。在肿瘤的发生过程中,肿瘤细胞可以通过许多机制,比如抑制了NK细胞和T细胞等具有杀伤活性的免疫细胞的功能,逃逸免疫系统的监视,促进自身的生长和转移[4-5]。因此,如果在抗肿瘤的同时提高免疫系统的活化功能,可以有效抵抗肿瘤的发生发展。刺梨(Rosa Roxburghii Tratt)是蔷薇科蔷薇属落叶灌木缫丝花的果实,近年来,中医常用刺梨的果实和根入药,在治疗消化系统、心血管系统疾病及抗肿瘤方面都有很高的药用价值[6],且有研究表明刺梨多糖可提高小鼠的免疫功能[7]。基于此,本研究拟探讨刺梨多糖在体外对黑色素瘤B16细胞的生物学行为的影响,及在体内对黑色素瘤生长的作用,同时探究刺梨多糖在抗肿瘤的同时,对小鼠免疫系统的影响。
1 材料与方法
1.1 实验材料
1.1.1 细胞与动物:小鼠黑色素瘤B16细胞购自美国ATCC细胞库,C57BL/6J小鼠购自京北维通利华实验动物技术有限公司。
1.1.2 仪器:HWJ-2-80型CO2细胞培养箱(上海鑫诺仪器集团有限公司)、Allegra®X-12R 型离心机(美国Beckman Coulter 公司)、5430R型低温离心机(德国 Eppendorf 公司)、Multiskan Sky酶标仪(美国Thermo Scientific公司)、FACS Via型流式细胞仪(美国BD公司)、 BSA124S型分析天平(德国赛多利斯公司);ABI Veriti PCR仪(美国Bio-Rad 公司)。
1.1.3 药品与试剂:刺梨多糖(由新乡医学院药物研究所实验室提供,实验中用生理盐水配成2%溶液,≥98%);1640培养基(美国 Hyclone 公司,批号AD32454266);胎牛血清(美国Gibco公司,批号10437-028);0.25% 胰酶(上海生工生物有限公司,批号2667534);MTT(美国赛默飞公司,批号M6494);小鼠IFN-γ ELISA试剂盒(浙江联科生物有限公司,批号96-900-M98);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物有限公司,批号C1062S);RT-PCR试剂盒(美国Sigma公司,批号KK1007); Bax、Bcl-2及β-actin基因由擎科生物有限公司合成;anti-mouse CD3流式抗体(美国eBbioscience,克隆号17A2);anti-mouse CD4流式抗体(美国eBbioscience,克隆号GK1.5);anti-mouse CD8流式抗体(美国Biolegend,克隆号53-6.7);anti-mouse NK1.1流式抗体(美国Biolegend,克隆号PK136);anti-mouse CD69流式抗体(美国Biolegend,克隆号H1.2F3)。其他试剂为实验室常用试剂。
1.2 研究方法
1.2.1 细胞培养与动物模型的建立:B16细胞,用含10%胎牛血清的1640培养基进行培养,放于 37 ℃、5% CO2环境的培养箱中。C57BL/6J小鼠(6周)于SPF级动物房中饲养,取B16细胞建立皮下荷瘤模型,每只小鼠皮下注射1×106个细胞,1周后有肿瘤出现,并随机分组,其中对照组通过灌胃方式给予2 ml/g的生理盐水,实验组通过灌胃方式给予0.8 g/kg的刺梨多糖,1次/2 d,连续治疗6次。每组小鼠10只,期间用游标卡尺测量肿瘤的长和宽,代入公式进行计算肿瘤体积(肿瘤体积=长×宽2/2)。治疗结束后,处死小鼠,取出肿瘤,进行称重。
1.2.2 MTT检测刺梨多糖对B16细胞的抑制率:取对数生长期的B16细胞接种于96细胞培养板中,每孔接入1.5×104个细胞。12 h后,将刺梨多糖的储存液分别稀释至20、40、80 μmol/L,并加入各孔,每个浓度设5个复孔,并设置阴性对照组(细胞加入等体积培养基)和空白对照组(孔内只含有培养基)。继续培养12、24、48 h,并在每个时间点利用MTT法进行检测。每孔加入MTT试剂 10 μl,继续培养 2 h,离心,去除上清,加入100 μl DMSO,吹打混匀,随后使用酶标仪测定各孔的吸光度(OD570和OD630,以OD630为校正值,即将OD570-OD630的值代入公式计算),细胞抑制率=(1-实验组OD/对照组OD)×100%,试验重复3次。
1.2.3 RT-PCR检测基因的表达:各组B16细胞加入不同浓度的刺梨多糖,24 h后,收集各组细胞,用磷酸盐缓冲液(PBS)充分洗涤,参照Trizo1试剂盒说明书提取细胞总RNA,用RT-PCR检测各组细胞中基因的表达量。其中以β-actin为内参对照基因。PCR反应条件参照PCR试剂盒说明书。各基因序列参见表1。

表1 引物序列
1.2.4 FACS检测刺梨多糖对细胞凋亡的影响:取对数生长期的B16细胞,接种于6孔板内,加入不同浓度的刺梨多糖进行处理,48 h后,用Annexin V-FITC细胞凋亡检测试剂盒检测,参照说明书操作,最后用流式仪进行上机检测。
1.2.5 FACS检测小鼠脾内免疫细胞的比例和CD69的表达:将小鼠进行脱颈处死后,取出脾脏,用200目的钢网研磨并不停用PBS冲洗。将悬液转移到干净的离心管中,加入PBS,以400 g的离心力进行离心,离心5 min后弃去上清。向离心管中加入3 ml的红细胞裂解液,吹打混匀,在4 ℃中静置15 min。后加PBS洗一遍,离心,弃去上清并重悬细胞后、过滤。将细胞悬液移至流式管中,每管100 μl,加10 μl大鼠血清封闭50 min。根据荧光不同分别加入相应荧光标记的抗体,4 ℃避光静置1 h,PBS 洗两遍,用流式细胞仪进行检测。
1.2.6 ELISA检测小鼠血清中IFN-γ分泌水平:各组小鼠进行治疗后,常规分离小鼠的血清,并利用ELISA试剂盒进行检测,参照说明书操作,最后用酶标仪检测OD450波长处的值。利用各标准品标准曲线计算各孔浓度。
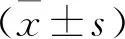
2 结 果
2.1 刺梨多糖对B16细胞增殖的影响 见表2。分别用0、20、40、80 μmol/L浓度的刺梨多糖处理B16细胞后,用MTT法进检测。由结果可知,不同浓度的刺梨多糖对B16细胞的增殖均有一定的抑制作用。与对照组(0 μmol/L组)比较,不同浓度的刺梨多糖对B16细胞增殖抑制率均显著增加(P<0.05或P<0.01);且随着刺梨多糖浓度的增加,其抑制作用越强。

表2 不同浓度刺梨多糖对B16细胞增殖的影响(%)
2.2 刺梨多糖对B16细胞凋亡的影响 见表3(图1)。先用0、20、40、80 μmol/L浓度的刺梨多糖处理B16细胞,48 h后,用Annexin V-FITC细胞凋亡检测试剂盒染色,然后用流式仪进行上机检测和分析,最后统计早期凋亡和晚期凋亡的总比例。结果显示,在不同剂量的刺梨多糖的处理下,B16细胞的凋亡率明显上升。与对照组相比,各浓度的刺梨多糖处理组中B16细胞的凋亡率比较差异均有统计学意义(均P<0.05),且呈剂量依赖性。应用用RT-PCR实验检测各组B16细胞中与凋亡相关的基因的表达水平,包括Bcl-2和Bax。结果显示,与对照组相比,不同剂量的刺梨多糖均可抑制抗凋亡基因Bcl-2,升高促凋亡基因Bax的表达,且呈现剂量依赖性。
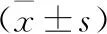
表3 不同浓度刺梨多糖对B16细胞凋亡的影响
2.3 刺梨多糖可抑制B16细胞在小鼠体内的生长 见表4(图2)。为了研究刺梨多糖在体内对B16细胞的抑制作用,本研究采用皮下荷瘤模型进行探讨。待肿瘤出现时,依据预实验的使用剂量0.8 g/kg,用刺梨多糖进行灌胃,连续治疗5次,观察21 d后,取出肿瘤,并测量肿瘤的体积和重量,进行组间比较。结果发现,与对照组相比,刺梨多糖治疗后,小鼠的肿瘤体积和重量均较低,且均有统计学差异(均P<0.01)。说明刺梨多糖可抑制B16细胞在小鼠体内的生长。
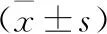
表4 刺梨多糖对小鼠肿瘤重量和体积的影响
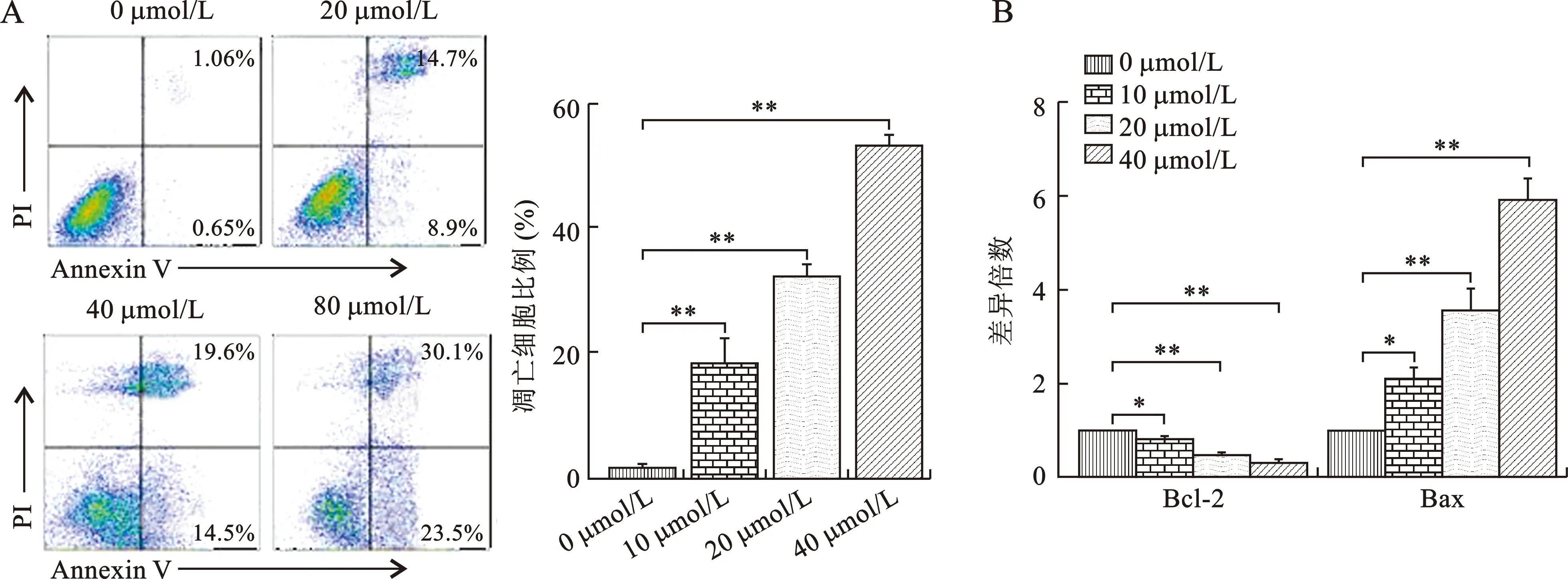
注:与对照组(0 μmol/L)比较, *P<0.05,**P<0.01图1 刺梨多糖对B16细胞凋亡及凋亡相关基因的影响
2.4 刺梨多糖可增加小鼠脾内免疫细胞的比例 见表5(图3)。运用FACS法检测小鼠脾内CD4+T、CD8+T和NK细胞的比例。由结果可知,与对照组相比,刺梨多糖治疗后,小鼠脾内CD4+T、CD8+T和NK细胞的比例明显增加,且均有统计学差异(均P<0.05)。说明刺梨多糖可以升高小鼠脾内免疫细胞的比例。
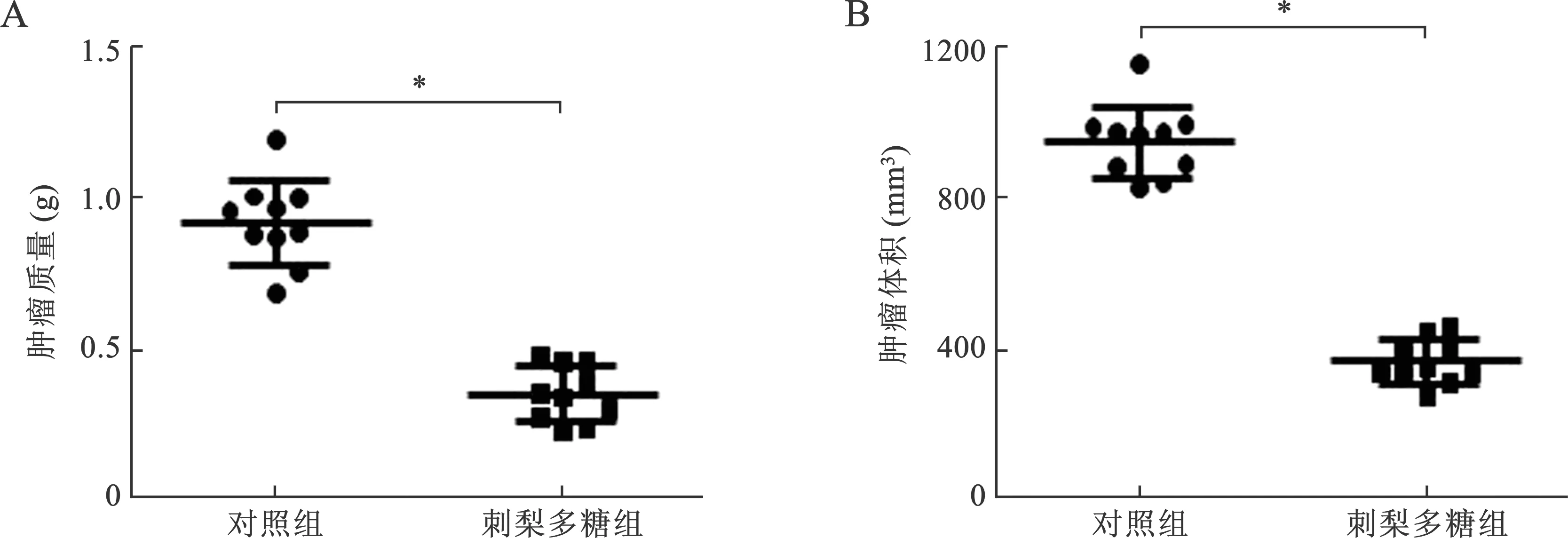
注:与对照组比较, *P<0.01图2 刺梨多糖对B16细胞在小鼠体内生长的影响

表5 刺梨多糖对小鼠脾内免疫细胞比例的影响(%)
2.5 刺梨多糖可升高小鼠脾内免疫细胞的活化 见表6(图4)。运用FACS法检测小鼠脾内CD4+T、CD8+T和NK细胞的比例及这三种免疫细胞上CD69的表达情况,以及ELISA检测小鼠血清中IFN-γ的水平。由结果可知,与对照组相比,刺梨多糖可以升高三种免疫细胞上CD69+的表达水平,血清中IFN-γ的分泌水平也明显增加,且均有统计学差异(均P<0.05)。说明刺梨多糖可以刺激小鼠脾内免疫系统的活化。
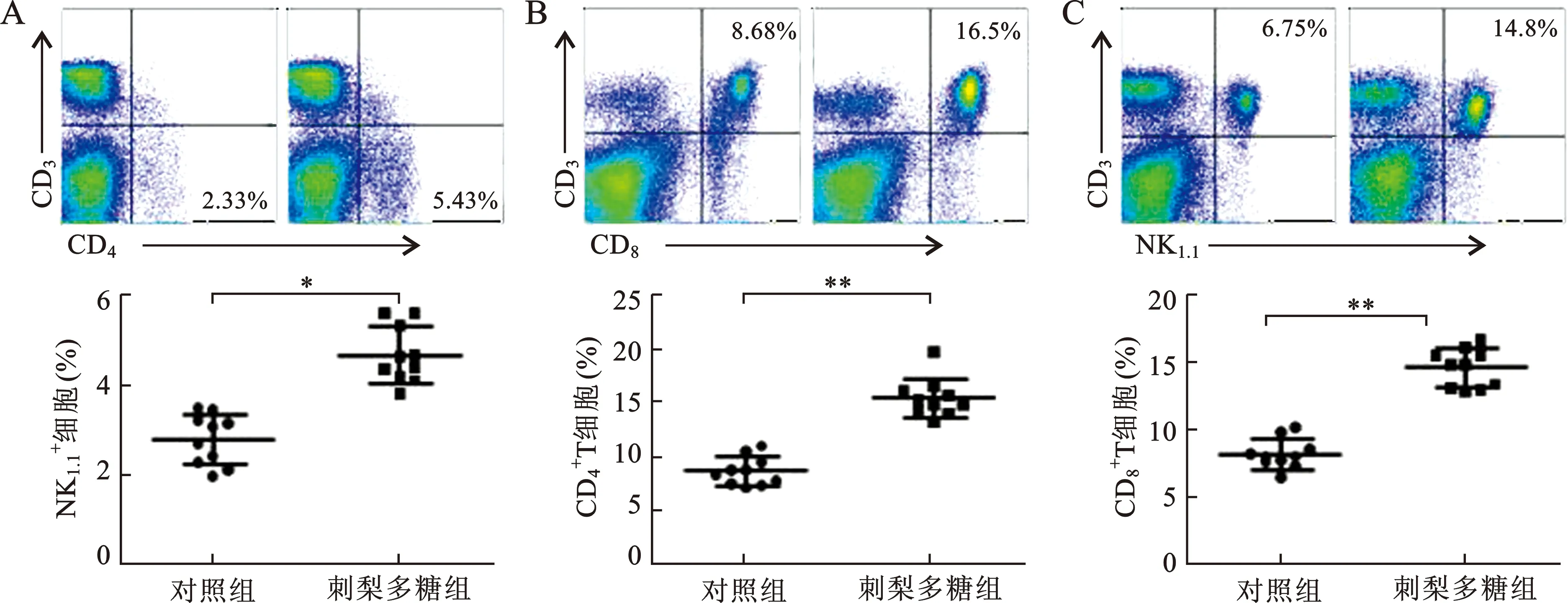
注:与对照组比较, *P<0.05,**P<0.01图3 刺梨多糖对小鼠脾内免疫细胞比例的影响
表6 刺梨多糖对小鼠脾内免疫细胞上CD69+表达水平和血清中IFN-γ分泌水平的影响

注:与对照组比较, *P<0.05,**P<0.01图4 刺梨多糖对小鼠脾内免疫细胞活化及血清中IFN-γ的影响
3 讨 论
目前,黑色素瘤发病率极高,恶性程度高,而抗肿瘤药物在抑制肿瘤细胞的同时,也会对机体产生一定的损害,因此寻找高效低毒的中药治疗已成为一种趋势[8-9]。有研究报道,刺梨多糖不仅具有一定的解毒作用,抗氧化作用,同时还有一定的抗肿瘤作用,比如食管鳞癌、胃癌及肺癌等[10-11]。然而,刺梨多糖对黑色素瘤是否有一定的抑制作用还不清楚。因此本研究通过体内体外实验,观察了刺梨多糖对黑色素瘤B16细胞的作用,结果显示刺梨多糖不仅在体外可以通过促进B16细胞的凋亡,从而抑制B16细胞的增殖,同时在体内可以通过增强免疫系统的活化,抑制小鼠的肿瘤形成。
为了探讨刺梨多糖对B16细胞增殖的抑制作用机制,本研究观察了刺梨多糖对B16细胞凋亡的影响,以确定是否是通过促进肿瘤细胞的凋亡,从而抑制肿瘤细胞生长。结果发现刺梨多糖可促进B16细胞的凋亡。目前,人们对细胞凋亡现象进行了广泛的研究,已形成的初步认识多源于对Bcl-2基因家族的研究[12]。有报道认为,Bcl-2为编码膜相关蛋白,保护肿瘤细胞免受DNA损伤诱导的凋亡,Bcl-2可与促凋亡Bax形成二聚体,Bax是一种促进细胞死亡的Bcl-2拮抗剂,可促进细胞凋亡[13-14]。因此,本研究利用RT-PCR技术检测了B16细胞中Bcl-2与 Bax的基因表达,以探究刺梨多糖对B16细胞凋亡的影响的作用机制。结果表明,刺梨多糖可以通过降低Bcl-2的表达,促进Bax的表达水平,促进B16细胞的凋亡,最终抑制B16细胞的增殖。
免疫系统是机体抵抗外来病原菌或者肿瘤细胞的防线,但是肿瘤细胞在发生过程中,会影响机体的免疫系统,导致免疫系统功能低下,从而有利于自身的逃逸和发生发展[15]。基于此,提高机体免疫系统的功能,已成为抑制肿瘤发生发展的重要治疗策略。有研究指出,刺梨多糖可以有效提高机体的免疫能力[7],且可以提高T细胞的增殖能力[16]。脾脏是机体重要的免疫器官,且目前已知道,CD8+T细胞可以通过识别抗原杀伤肿瘤细胞,CD4+T 细胞作为辅助性T细胞,可以诱导和增强适应性免疫应答,促进效应CD8+T细胞发挥抗肿瘤作用[17],而NK细胞能通过自身表达的活化性受体识别肿瘤细胞上的配体直接杀伤肿瘤细胞[18]。因此,CD4+T、CD8+T和NK细胞在抗肿瘤过程中发挥着重要的作用[19]。本研究通过流式检测小鼠脾内CD4+T、CD8+T和NK细胞的比例及活化情况,探究刺梨多糖对荷瘤小鼠机体免疫系统的影响。结果发现,刺梨多糖不仅可以明显提高T细胞的比例,还可以提高NK细胞的比例。本研究结果显示刺梨多糖可增加CD4+T、CD8+T和NK细胞上CD69的表达水平,CD69是免疫细胞活化的重要标志[20],因此可以说明刺梨多糖可以激活免疫细胞的活化功能。然而,抑制肿瘤的发生不仅需要肿瘤细胞的直接杀伤,还需要和微环境中炎症因子和细胞基质等因素紧密配合[21]。IFN-γ具有抗病毒、抗肿瘤和免疫调控的作用。血清中IFN-γ的水平也代表了机体免疫功能的高低。本研究结果显示刺梨多糖升高了小鼠血清中IFN-γ的分泌水平。因此可以说明刺梨多糖可以通过增加免疫细胞的比例,升高免疫细胞上CD69的表达以及提高IFN-γ的分泌水平三方面,提高机体的免疫系统的活化功能,最终更好地抑制肿瘤的发展。
综上,本研究为刺梨多糖用于体内体外的抗肿瘤活性研究提供了实验依据,是临床药物开发的基础研究。本实验室会进一步分离刺梨多糖的成分,同时探讨刺梨多糖影响免疫系统的具体机制,探究是否可以促进免疫治疗的作用,为联合免疫治疗黑色素瘤提供更多的实验和理论依据 。

