炎症微环境下miR-30a调控Runx相关转录因子2对人牙周膜干细胞成骨分化的影响
林 丽,张 卓,哈斯达来,王 博,刘翠娟,马稔秋,付泽宇
(1.锦州医科大学附属第一医院口腔科,辽宁 锦州 121001;2.赤峰学院附属医院口腔科,内蒙古 赤峰 024005)
牙周炎是一种发生于牙周支持组织的慢性炎症,因牙龈卟林单胞菌、伴放线菌、变形链球菌等微生物感染引起,可破坏牙槽骨吸收及骨形成之间的动态平衡,使其骨吸收大于骨形成,导致牙槽骨的高度降低,阻止炎症进展,促进牙周组织的修复再生在牙周炎的治疗中至关重要[1-2]。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)来源于人牙周膜内间质的未分化细胞,可分化形成牙骨质或牙周膜样结构,具有再生修复牙周组织的作用[3-4],而炎症可影响hPDLSCs的成骨分化能力,减弱其对牙槽骨及牙周组织的修复功能[5-6]。Runt相关转录因子2(Runt-related transcription factor 2,Runx2)与成骨分化密切相关,能诱导不成熟骨细胞分化成熟,还可促进hPDLSCs向成骨细胞分化[7-8],由此推测,Runx2是调控炎症微环境下hPDLSCs成骨分化的一个作用靶点。微小RNA-30a(miR-30a)在牙周炎牙龈和牙槽骨组织中高表达,并抑制炎性环境下骨代谢及成骨细胞活性,另外miR-30a可与Runx2的3’-非翻译区结合抑制Runx2的表达,但miR-30a是否可通过调控Runx2影响炎症微环境下hPDLSCs的成骨分化,目前还不清楚,本文通过构建体外hPDLSCs炎症模型,对此进行探索。
1 材料与方法
1.1 实验细胞、试剂及仪器 hPDLSCs(上海圻明生物科技有限公司,批号Sci-L-0684);miR-30a mimics、miR-30a mimics阴性对照、miR-30a inhibitor、miR-30a inhibitor阴性对照(上海吉玛基因有限公司,批号JM1037、JM1158、JM2019、JM2027);DMEM培养基(武汉益普生物科技有限公司,批号PM150210);胎牛血清、PBS缓冲液、胰蛋白酶-EDTA消化液、青链霉素混合液(北京索莱宝科技有限公司,批号11011-8611、P1022、T1300、P1400);Opti-MEM培养基、LipofectamineTM2000(美国invitrogen公司,批号51985091、11668019);人白细胞介素-6(IL-6)酶联免疫吸附(ELISA)试剂盒(上海古朵生物科技有限公司,批号GD-DS1726);人肿瘤坏死因子-α(TNF-α)ELISA试剂盒(上海广锐生物科技有限公司,批号DS-535);碱性磷酸酶(ALP)染色试剂盒(上海翊圣生物科技有限公司,批号40749ES60);茜素红染色液(上海联硕生物科技有限公司,批号N/A-899);RNA提取试剂盒(RNAiso Plus)、逆转录试剂盒、荧光定量PCR试剂盒(日本Takara公司,批号9108、RR037Q/A/B、639519);兔源Runx2、骨桥蛋白(OPN)、骨钙素(OCN)及GAPDH一抗、羊抗人二抗(美国Abcam公司,批号ab23981、ab63856、ab93876、ab181602、ab6721);蛋白提取试剂盒、BCA蛋白测定试剂盒(上海生工生物工程股份有限公司;批号C006325-0150、P0011)。光学显微镜(日本Olympus公司,型号CKX41-F32F);酶标仪(山东博科生物产业有限公司,型号BK-EL10C);荧光定量PCR仪、蛋白电泳仪、转膜仪(美国Bio-Rad公司,型号CFX96 Touch Deep Well、1659001、Trans-Blot Turbo);低温高速离心机(德国Eppendorf公司,型号Centrifuge 5424R);凝胶成像系统(美国Thermo Fisher Scientific公司,型号IBright CL 1500)。
1.2 研究方法
1.2.1 细胞培养及培养基配制:完全培养基:向500 ml DMEM培养基中加入胎牛血清和青链霉素混合液,使其终浓度分别为10%、100 U/ml,上下颠倒混匀。成骨诱导分化培养基:向500 ml完全培养基中加入地塞米松、维生素C及β-磷酸甘油钠,使其终浓度分别为10、50 μmol/L、10 mmol/L,上下颠倒混匀。购买的冻存hPDLSCs细胞株置于37 ℃水浴中,快速冻融后离心5 min(室温,1000 r/min),以完全培养基洗涤细胞沉淀后重悬,接种在25 cm2培养瓶中,于37 ℃,5% CO2培养箱中培养,当细胞铺满瓶底时,以胰酶消化,并以1∶3的比例传代培养。
1.2.2 细胞转染及标本收集:取1.2.1中指数生长期的细胞,以胰酶消化后重悬并计数,接种在4个24孔板中,培养24 h,各板细胞随机分为对照组、模型组、miR-30a mimics组、miR-30a mimics阴性对照组、miR-30a inhibitor组、miR-30a inhibitor阴性对照组,除对照组外,其余各组以10 μg/ml的脂多糖处理细胞,构建体外炎症微环境,24 h后转染细胞,步骤如下:将完全培养基更换成Opti-MEM减血清培养基培养细胞,将1 μl LipofectamineTM2000溶于50 μl Opti-MEM减血清培养基中,小心混匀,同时分别将miR-30a mimics、miR-30a mimics阴性对照、miR-30a inhibitor、miR-30a inhibitor阴性对照(浓度参照说明书)溶解于50 μl Opti-MEM减血清培养基中混匀,均静置20 min后分别与LipofectamineTM2000溶液混匀后,分组处理细胞,6 h后,以成骨诱导分化培养基更换Opti-MEM减血清培养基,继续培养2周后,选取两个24孔板分别用于后续ALP染色及茜素红染色实验,剩余2个24孔板中的各组细胞收集后分别用于实时荧光定量PCR(qRT-PCR)及蛋白检测。
1.2.3 ALP染色及茜素红染色实验:取1.2.2中两个24孔板,吸去培养基,以PBS漂洗后,加入4%多聚甲醛固定2 h,采用ALP染色试剂盒及茜素红染色液分别对各组细胞进行染色(具体步骤参照说明书),在光学显微镜下观察,呈现紫色的为ALP阳性细胞,呈现红色的为矿化结节,每组任选5个视野拍照,计数ALP阳性细胞数及矿化结节数,并计算其各组相对比例,对照组设为100%,相对比例=实验组ALP阳性细胞数(矿化结节数)/对照组ALP阳性细胞数(矿化结节数)×100%。
1.2.4 细胞上清液中TNF-α及IL-6水平检测:取1.2.1中指数生长期的细胞,以胰酶消化后重悬并计数,接种在24孔板中,培养24 h,参照1.2.2中的方法转染细胞,继续培养24 h后,收集各组细胞上清液,以ELISA试剂盒测定其中TNF-α、IL-6水平,具体步骤参照说明书进行。
1.2.5 qRT-PCR分析各组细胞miR-30a、Runx2 mRNA的表达:取出1.2.2中收集的各组细胞,加入RNAiso Plus提取各自总RNA并以逆转录试剂盒将其逆转录成cDNA,然后以荧光定量PCR试剂盒进行实时荧光定量PCR反应,具体步骤、反应体系配制、反应条件设定均参照各自说明书进行,以GAPDH为Runx2的内参基因,U6为miR-30a的内参基因,采用2-ΔΔCt算法统计分析所得数据,进而得出各组mRNA相对表达量,qRT-PCR引物序列见表1。miR-30a、Runx2、U6、GAPDH引物由上海生工生物工程股份有限公司合成。

表1 qRT-PCR引物序列
1.2.6 免疫印迹分析各组细胞Runx2、OPN、OCN蛋白的表达:取出1.2.2中收集的各组细胞,以蛋白提取试剂盒提取总蛋白后使用BCA试剂盒测定其总浓度,调整各组蛋白浓度至相同,煮沸变性,各取10 μl样品液上样,进行聚丙烯酰胺凝胶电泳,然后将分离蛋白全部转移至硝酸纤维素膜上,根据目的蛋白分子量截取条带置于小盒中,加入5%的脱脂奶粉,室温进行封闭2 h,然后分别经兔源Runx2、OPN、OCN及GAPDH一抗4 ℃孵育过夜,羊抗人二抗室温孵育2 h后,采用ECL显色,以凝胶成像系统拍摄蛋白条带,并以Image Lab软件分析各组蛋白相对表达量。
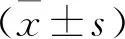
2 结 果
2.1 ALP染色检测miR-30a对各组细胞成骨分化的影响 与对照组相比,模型组ALP阳性细胞相对比例降低(P<0.05);与模型组相比,miR-30a mimics组ALP阳性细胞相对比例均降低(均P<0.05),miR-30a inhibitor组ALP阳性细胞相对比例升高(P<0.05),miR-30a mimics阴性对照组、miR-30a inhibitor阴性对照组ALP阳性细胞相对比例无明显变化(均P>0.05),见表2(图1)。
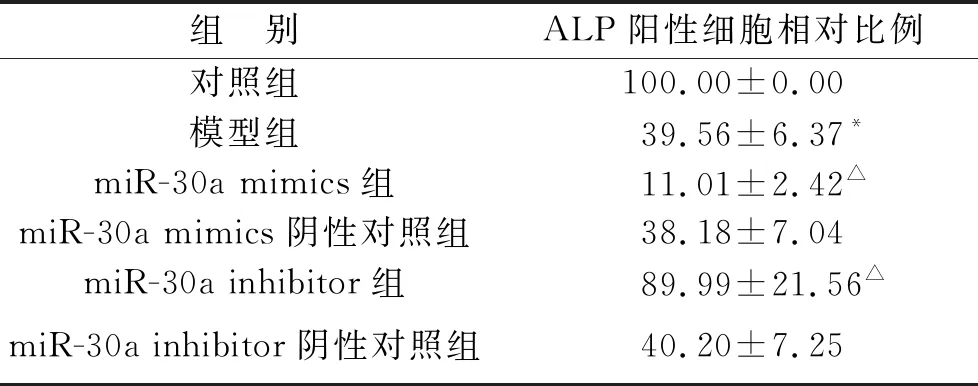
表2 各组细胞ALP阳性细胞相对比例(%)
2.2 茜素红染色检测miR-30a对各组细胞成骨分化的影响 与对照组相比,模型组细胞矿化结节相对比例降低(P<0.05);与模型组相比,miR-30a mimics组细胞矿化结节相对比例均降低(均P<0.05),miR-30a inhibitor组细胞矿化结节相对比例升高(P<0.05),miR-30a mimics阴性对照组、miR-30a inhibitor阴性对照组细胞矿化结节相对比例无明显变化(均P>0.05),见表3(图2)。

A:对照组;B:模型组;C:miR-30a mimics组;D:miR-30a mimics阴性对照组;E:miR-30a inhibitor组;F:miR-30a inhibitor阴性对照组图1 各组细胞成骨分化(ALP染色,×200)

A:对照组;B:模型组;C:miR-30a mimics组;D:miR-30a mimics阴性对照组;E:miR-30a inhibitor组;F:miR-30a inhibitor阴性对照组图2 各组细胞成骨分化(茜素红染色,×200)
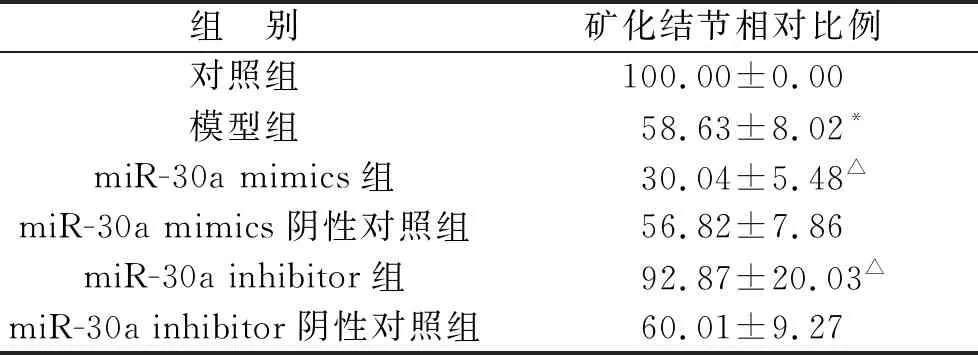
表3 各组细胞矿化结节相对比例(%)
2.3 miR-30a对各组细胞上清液中炎症因子水平的影响 与对照组相比,模型组细胞上清液中TNF-α、IL-6水平均升高(均P<0.05);与模型组相比,miR-30a mimics组细胞上清液中TNF-α、IL-6水平均升高(均P<0.05),miR-30a inhibitor组细胞上清液中TNF-α、IL-6水平均降低(均P<0.05),miR-30a mimics阴性对照组、miR-30a inhibitor阴性对照组细胞上清液中TNF-α、IL-6水平均无明显变化(均P>0.05),见表4。

表4 各组细胞上清液中TNF-α、IL-6水平比较(ng/ml)
2.4 各组细胞miR-30a、Runx2 mRNA表达水平比较 与对照组相比,模型组细胞miR-30a表达水平均升高(均P<0.05),Runx2 mRNA表达水平降低(P<0.05)。与模型组相比,miR-30a mimics组细胞miR-30a表达水平升高(P<0.05),Runx2 mRNA表达水平降低(P<0.05);miR-30a inhibitor组细胞miR-30a表达水平降低(P<0.05),Runx2 mRNA表达水平升高(P<0.05);miR-30a mimics阴性对照组、miR-30a inhibitor阴性对照组细胞miR-30a、Runx2 mRNA表达水平均无明显变化(均P>0.05),见表5。
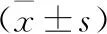
表5 各组细胞miR-30a、Runx2 mRNA表达水平比较
2.5 miR-30a对各组细胞成骨相关蛋白Runx2、OPN、OCN表达的影响 与对照组相比,模型组细胞成骨相关蛋白Runx2、OPN、OCN表达水平均降低(均P<0.05);与模型组相比,miR-30a mimics组细胞Runx2、OPN、OCN蛋白表达水平均降低(均P<0.05),miR-30a inhibitor组细胞Runx2、OPN、OCN蛋白表达水平均升高(均P<0.05),miR-30a mimics阴性对照组、miR-30a inhibitor阴性对照组细胞成骨相关蛋白表达水平均无明显变化(均P>0.05),见表6(图3)。
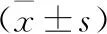
表6 各组细胞Runx2、OPN、OCN蛋白表达水平比较

A:对照组;B:模型组;C:miR-30a mimics组;D:miR-30a mimics阴性对照组;E:miR-30a inhibitor组;F:miR-30a inhibitor阴性对照组图3 各组细胞Runx2、OPN、OCN蛋白表达
3 讨 论
牙周炎不仅可导致剧烈疼痛、牙齿损坏,还可能诱发心血管疾病,对居民身心健康,特别是口腔健康存在重大威胁[9-12]。组织再生工程技术是修复牙周组织,改善牙周炎临床症状的重要治疗手段,hPDLSCs具有自我更新和分化为牙周膜、牙骨质等多种牙周组织细胞的能力,是组织工程技术中很好的种子细胞[13-14],但hPDLSCs慢性炎症微环境下再生及分化能力明显降低[15]。本文以脂多糖诱导炎症,构建hPDLSCs体外炎症微环境模型,结果显示,hPDLSCs经脂多糖处理后,细胞上清液中促炎因子TNF-α及IL-6水平升高,ALP阳性细胞相对比例、矿化结节相对比例、细胞成骨分化相关蛋白OPN及OCN表达水平降低,表明脂多糖可引发hPDLSCs产生炎症,抑制其向成骨细胞分化,模型建立成功。
miR-30a是一种非编码RNA分子,可调控多种信号通路传导,介导炎症反应,细胞增殖、凋亡及分化等生理过程。miR-30a可下调过氧化物酶体增殖物激活受体γ的共同激活剂Ppargc1b的表达,促使炎症进展,加剧自身免疫性脑脊髓炎症状[16],并可抑制骨形态发生蛋白9(BMP9)诱导的C3H10T1/2和C2C12细胞的成骨分化[17-18]。本研究发现,与对照组相比,模型组细胞miR-30a表达水平升高,推测炎症微环境下miR-30a高表达,可能调控炎症微环境下hPDLSCs的成骨分化。本研究通过使用miR-30a mimics及inhibitor调控炎症微环境下hPDLSCs中miR-30a的表达对此进行探索,结果显示,miR-30a mimics处理细胞可升高细胞上清液中TNF-α及IL-6水平,降低ALP阳性细胞相对比例、矿化结节相对比例、细胞成骨分化相关蛋白OPN及OCN表达水平,miR-30a inhibitor处理细胞,则作用相反。表明miR-30a参与脂多糖诱导的hPDLSCs炎症反应及其成骨分化,上调miR-30a表达,可促进炎症进展,抑制炎症微环境下hPDLSCs向成骨细胞分化,下调miR-30a表达,可抑制炎症进展,促进炎症微环境下hPDLSCs向成骨细胞分化。Runx2是一种成骨分化相关因子,可增强间充质干细胞及hPDLSCs的成骨分化[19]。研究显示,miR-30a可与Runx2的3’-UTR结合,进而调节Runx2的表达,抑制破骨细胞的分化和骨溶解过程[20],但miR-30a是否可通过调控Runx2的表达而介导炎症微环境下hPDLSCs的成骨分化,目前还未见阐释。本文结果显示,与对照组相比,模型组细胞Runx2 mRNA和蛋白表达水平降低,进一步分析发现,miR-30a mimics处理炎症微环境下hPDLSCs可降低细胞Runx2 mRNA和蛋白表达,miR-30a inhibitor处理细胞则作用相反,表明miR-30a可抑制Runx2表达,加重炎症,抑制炎症微环境下hPDLSCs的成骨分化。
综上所述,炎症微环境下hPDLSCs中miR-30a高表达,可抑制Runx2的表达,促进脂多糖诱导的hPDLSCs炎症进展及其成骨分化,下调miR-30a水平,可促进Runx2表达,抑制炎症发展,增强炎症微环境下hPDLSCs中成骨相关因子OPN、OCN、ALP的表达水平,促使其向成骨细胞分化,揭示miR-30a是牙周炎的一个潜在治疗靶点,为临床治疗牙周疾病提供了新的参考,调控Runx2的表达可能是其作用机制。但本文未通过上调或下调Runx2表达对miR-30a调控炎症微环境下hPDLSCs的成骨分化进行对照验证,还存在一定不足,还需进行后续的深入研究,得出更为精确完整的作用机制。

