miR-7-5p靶向KLF4基因调控食管癌细胞的增殖和迁移能力
彭 慧,陈 丹,李东林,魏蜀亮
食管癌是最常见的消化系统恶性肿瘤,具有高致死率。统计数据显示,2018年全球食管癌约有57万例新诊断病例和51万例死亡病例,其中中国占新发病例的大部分,是全世界主要的公共卫生问题[1]。尽管食管癌的诊断技术和治疗取得了进步,但食管癌患者的总体生存率仍然很差,因此食管癌新的治疗方法对提高患者生存率具有重大意义[2]。微小RNA(microRNA,miRNA,miR)是一类高度保守的内源性表达的小型非编码RNA,它们可以是肿瘤的启动子或抑制因子[3]。miR-7-5p在非小细胞肺癌和肝细胞肝癌等多种恶性肿瘤中被报道为抑癌因子,与肿瘤恶性生物学行为密切相关[4-5]。目前,miR-7-5p在食管癌中的相关研究未见有报道。miRNA通过与相应靶信使RNA(mRNA)的3’-非翻译区(3’-untranslated region,3’-UTR)直接相互作用并通过miRNA切割,在转录后基因表达中发挥主要作用[6]。在结直肠癌中Krüppel样因子4(Krüppel-like factor 4,KLF4)基因被证实是miR-7-5p的直接靶标[7],KLF4属于KLF家族成员,具有进化上高度保守的哺乳动物锌指结构。KLF4在肿瘤的发生和发展中发挥重要作用,可以发挥癌基因的作用也可以发挥抑癌基因的作用[8-9],其在食管癌中发挥的作用也不一致[10-11]。因此本文对miR-7-5p靶向KLF4在食管癌中发挥的作用进行了探究。
1 材料与方法
1.1 组织样本
选择2017年1月—2018年6月本院收治的40例食管癌患者的癌组织及其配对的癌旁组织(距离癌组织>5 cm的非癌组织的标本)。所有患者手术前均未接受化疗或放射治疗,食管癌组织和癌旁组织均经病理学确诊。标本收集获得本院伦理委员会批准,所有患者均签署了知情同意书。
1.2 细胞和试剂
食管癌TE1、Eca109和EC9706细胞以及人食管鳞状上皮细胞Het-1购自美国模式菌种保藏中心(American Type Culture Collection,ATCC)。DMEM高糖培养液、胎牛血清和胰蛋白酶购自美国HyClone公司;TRIzol试剂、PrimeScriptTMRT Reagent Kit反转录和SYBR Premix EX TaqTMⅡqRT-PCR试剂盒购自日本TaKaRa公司;miR-7-5p、KLF4基因、内参照U6和GAPDH基因引物由上海捷瑞生物工程有限公司合成;miR-7-5p-模拟物(mimics)及阴性对照(negative control,NC)-mimics、携带有KLF4全基因的过表达KLF4质粒(重组载体pcDNA3.0-KLF4)(over-expression-KLF4,OEKLF4)及空载体pcDNA3.0、携带有KLF4全基因的重组质粒pGLO-KLF4-野生型(wild type,WT)(KLF4-WT)和重组质粒pGLO-KLF4-突变型(mutant type,MUT)(KLF4-MUT)购自上海吉凯基因科技有限公司;双荧光素酶报道基因检测试剂盒购自上海碧云天生物试剂有限公司;MTS增殖检测试剂盒购自中国北京百奥莱博科技有限公司;Transwell小室购自美国Coring公司;RIPA和BCA检测试剂盒购自北京索莱宝试剂有限公司;兔抗人Wnt3a、β-连环蛋白(β-catenin)和内参照GAPDH多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)的羊抗兔IgG购自英国Abcam公司。
1.3 实时荧光定量PCR检测组织中miR-7-5p及KLF4 mRNA的表达水平
手术切除的新鲜组织即刻放入液氮中冻存。取部分组织,经研钵研磨为组织粉末后加入TRIzol试剂,提取组织中的RNA。按照PrimeScriptTMRT reagent Kit试剂盒将RNA反转录为cDNA。以cDNA为模板,采用SYBR Premix EX TaqTMⅡqRT-PCR试剂盒进行PCR扩增;条件为95 ℃ 5 s,95 ℃ 5 s、70 ℃30 s,共40个循环。用2-ΔΔCt值表示目的基因的相对表达量,以U6为内参照计算miR-7-5p的相对表达量,以GAPDH基因为内参照计算KLF4 mRNA相对表达量。miR-7-5p上游引物序列 为5’-AAAACTGCTGCCAAAACCAC-3’,下游引物序列为5’-GCTGCATTTTACAGCGACCAA-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACATATACT-3’,下游引物序列为5’-ACGCTTCACGAATTTGCGTGTC-3’;KLF4基因上游引物序列为5’-CCCACATGAAGCGACTTCCC-3’,下 游引物序列为5’-CAGGTCCAGGAGATCGTTGAA-3’;GAPDH基因上游引物序列为5’-GTGAACCATGAGAAGTATG-3’,下游引物序列为5’-CGGCCATCACGCCACAGTTTC-3’。
1.4 细胞培养和转染
食管癌细胞TE1、Eca109、EC9706和人食管鳞状上皮细胞Het-1复苏后重悬至含有10%胎牛血清的培养液中,置于37 ℃、CO2体积分数为5%、全湿度培养箱中进行培养。细胞融合度约为95%时,按照1∶3的比例进行传代。待细胞长满时,采用胰蛋白酶消化后收集细胞,PBS洗3次,采用实时荧光定量PCR法检测miR-7-5p和KLF4 mRNA的表达水平,实验流程同1.3节。
将miR-7-5p表达水平最低的食管癌细胞常规培养后,以1×105个的密度接种于6孔板中,分 为NC-mimics组、miR-7-5p-mimics组和miR-7-5p-mimics+OE-KLF4组。细胞接种12 h后采用LipofectAMINE 2000进行质粒转染,miR-7-5p-mimics转入TE1细胞为miR-7-5p-mimics组,miR-7-5p-mimics和携带有KLF4全基因的重组载体[过表达KLF4(OE-KLF4)]共转入TE1细胞为miR-7-5p-mimics+OEKLF4组,以转入无相关性的NC-mimics作为对照组。转染后置于培养箱中培养,12 h后更换为新鲜培养叶继续培养。
1.5 miR-7-5p靶向调控KLF4基因的验证
TargetScan 7.1软 件(http://www.targetscan.org/)预测miR-7-5p可能的靶基因。将KLF4的野生型3’-UTR和突变型3’-UTR分别被插入到基于pGL3的荧光素酶报道质粒中,构成KLF4-WT和KLF4-MUT重组质粒。
将miR-7-5p表达最低的食管癌细胞常规培养后,以3 000个/孔的密度接种到96孔板中,分为KLF4-WT+NC-mimics组,KLF4-WT+miR-7-5p-mimics组;KLF4-MUT+NCmimics组和KLF4-MUT+miR-7-5p-mimics组。收集转染48 h后的各组细胞,采用双荧光素酶报道基因检测试剂盒检测各组细胞荧光素酶活性。
1.6 MTS实验
选择miR-7-5p表达最低的食管癌TE1细胞,以1 500个细胞/孔的密度接种到96孔板中,分为NC-mimics组、miR-7-5p-mimics组 和miR-7-5p-mimics+OE-KLF4组,细胞转染的实验流程同1.4节,分别在细胞转染的0、24、48和72 h时,加入30 μL MTS试剂,置于37 ℃、CO2体积分数为5%、全湿度培养箱中孵育2 h。采用酶标仪检测细胞在490 nm处的D值。
1.7 Transwell小室法检测TE1细胞的迁移能力
收集转染48 h的各组细胞,用PBS洗涤3次后,以5×104个细胞重悬于100 μL无血清DMEM培养液中,加至Transwell小室上室的微孔膜上;将Transwell小室放入含有500 μL完全培养液的24孔板中,使微孔膜与24孔板中的培养液接触。置于37 ℃、CO2体积分数为5%、全湿度培养箱中培养12 h后终止培养;用PBS将微孔膜上室面细胞的洗去后,用无水甲醇溶液固定细胞、结晶紫染色后,观察细胞形态,随机选择5个视野计数穿过小室膜的细胞数。
1.8 蛋白质印迹法检测Wnt3a蛋白的表达水平
收集转染48 h的各组细胞,PBS洗涤3次后,加入RIPA试剂重悬细胞,超声裂解30 min后低温离心,收集上清液移,用BCA试剂盒检测蛋白浓度。取适量蛋白加入上样缓冲液,煮沸进行蛋白变性,上样行10%的SDS-PAGE分离蛋白,将分离后的蛋白转移至PVDF膜上,用含8%脱脂牛奶的封闭液封闭非特异性蛋白;加入一抗[兔抗人Wnt3a、β-catenin和GAPDH多克隆抗体(体积稀释比例为1∶500)]4 ℃孵育过夜,随后加入二抗[HRP标记的羊抗兔IgG(体积稀释比例为1∶8 000)],室温孵育1 h,电化学发光法显影。
1.9 统计学方法
用SPSS 17.0软件进行统计学分析。数据均以表示,独立样本t检验分析2组间的统计学差异,单因素方差比较3组及3组以上的统计差异。P<0.05为差异有统计学意义。相关性分析采用的Pearson相关性统计。所有的实验独立重复3次或以上。
2 结果
2.1 食管癌组织中miR-7-5p和KLF4的表达水平
实时荧光定量 PCR检测miR-7-5p和KLF4分别在食管癌和癌旁组织中的表达水平。结果(图1A)显示,miR-7-5p在食管癌组织中的表达量为0.78±0.46,在癌旁组织中的表达量为1.00±0.50,与癌旁组织相比,食管癌组织中miR-7-5p的表达水平下降(t=2.06,P=0.043)。KLF4 mRNA在食管癌组织中的表达为1.83±0.75,在癌旁组织中的表达为1.00±0.55,与癌旁组织相比,食管癌组织中KLF4 mRNA的表达水平增加(t=5.71,P=0.000)(图1B)。
2.2 miR-7-5p和KLF4 mRNA在食管癌组织中的表达相关性
Pearson分析结果(图2)显示,miR-7-5p和KLF4 mRNA在食管癌组织中的表达呈负相关性(r=-0.601,P<0.05)。
2.3 食管癌细胞系中miR-7-5p和KLF4 mRNA的表达水平
实时荧光定量PCR检测miR-7-5p和KLF4 mRMA在食管癌细胞中的表达水平。结果(图3A)发现,miR-7-5p在食管癌TE1、Eca109和EC9706细胞中的相对表达量分别为0.19±0.03、0.65±0.06和0.50±0.02,在人食管鳞状上皮细胞Het-1中的相对表达量为1.00±0.00;与Het-1细胞相比,miR-7-5p在食管癌细胞中的表达水平均明显下调(P值均<0.001),以在TE1细胞中表达量最低。
实时荧光定量PCR法检测结果(图3B)显示,KLF4 mRMA在TE1、Eca109和EC9706细 胞中的表达量分别为6.79±0.69、5.83±0.52和4.09±0.12,在Het-1细胞中的表达量为1.00±0.00;与Het-1细胞相比,KLF4 mRMA在食管癌细胞中的表达水平均明显上调(P值均<0.001)。
2.4 miR-7-5p对KLF4的靶向调控作用
TargetScan 7.1软件在线预测结果(图4A)显示,KLF4基因启动子区与miR-7-5p具有结合位点。
双荧光素酶报道基因系统检测结果(图4B)显示,KLF4-WT+NC-mimics共转染组的荧光素酶活性为1.00±0.02,KLF4-WT+miR-7-5p-mimics共转染组的荧光素酶活性为0.33±0.05,较KLF4-WT+NC-mimics共转染组明显降低(t=4.01,P=0.006);而KLF4-MUT+NC-mimics共转染组的荧光素酶活性为1.00±0.05、KLF4-MUT+miR-7-5pmimics共转染组的荧光素酶活性为0.90±0.12,二者间差异无统计学意义(t=1.25,P=0.069)。上述结果提示,miR-7-5p靶向负调控KLF4基因。
2.5 miR-7-5p-mimics转染效果及对KLF4 mRNA表达水平的影响
选择miR-7-5p表达最低的食管癌细胞TE1,转入miR-7-5p-mimics。实时荧光定量PCR法检测结果(图5)显示,miR-7-5p在NC-mimics组中的相对表达量为1.00±0.00,在miR-7-5pmimics组中的相对表达量为8.35±0.97;与NCmimics组相比,miR-7-5p-mimics组中miR-7-5p的表达水平明显上调(t=3.47,P=0.018)。KLF4 mRNA在NC-mimics组中的相对表达量为1.00±0.00,在miR-7-5p-mimics组中的相对表达量为为0.46±0.15,与NC-mimics组相比,miR-7-5p-mimics组中KLF4 mRNA的表达水平明显下调(t=2.99,P=0.021)。
2.6 miR-7-5p调控KLF4对TE1细胞增殖能力的影响
MTS实验检测结果(图6)显示,与NCmimics组相比,miR-7-5p-mimics组和miR-7-5p mimics+OE-KLF4组TE1细胞的增殖能力均明显降低(P值均<0.05);而与miR-7-5p-mimics组相比,miR-7-5p-mimics+OE-KLF4组TE1细胞的增殖能力增加(P<0.05)。这一结果提示,KLF4基因表达水平的上调能抑制miR-7-5p对TE1细胞增殖的促进作用。
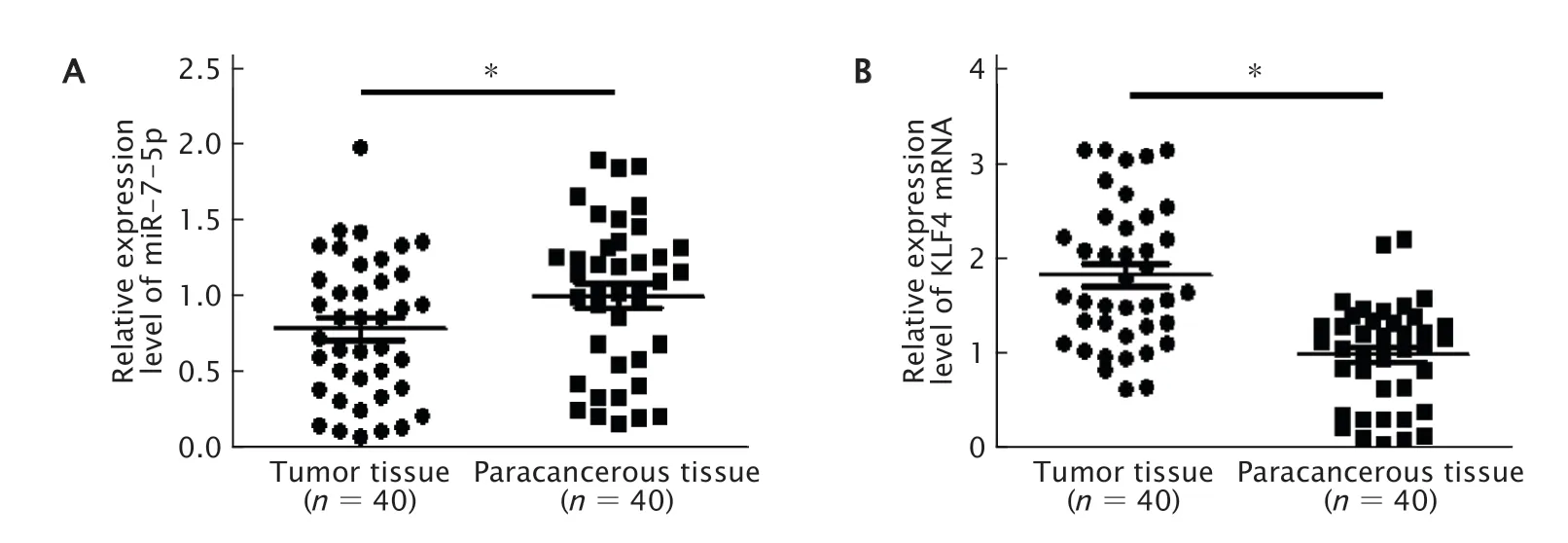
Fig.1 Real-timefluorescentquantitativePCRwas usedtodetectthe expressionlevelsofmiR-7-5p(A)andKrüppellikefactor 4 (KLF4)mRNA(B)in40 casesof esophageal cancerandadjacent non-cancerous tissues.*P<0.05.图1 实时荧光定量PCR检测miR-7-5p(A)和KLF4 mRNA(B)在40例在食管癌和癌旁组织中的表达水平
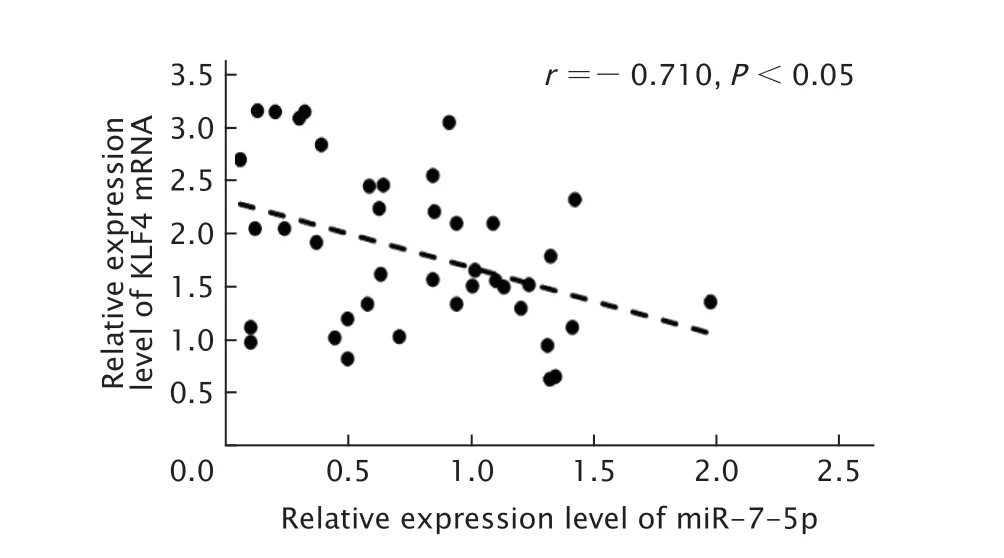
Fig.2 Correlation between miR-7-5p and Krüppel-like factor 4 (KLF4) mRNA expression in esophageal cancer tissues.图2 miR-7-5p和KLF4 mRNA在食管癌组织中表达的相关性

Fig.3 The expression level of miR-7-5p (A) and Krüppel-like factor 4 (KLF4) mRNA (B) in esophageal cancer TE1,Eca109 and EC9706 cells were detected by real-time fluorescent quantitative PCR.***P<0.05,vs human esophageal squamous epithelial Het-1 cells (n=3).图3 实时荧光定量PCR检测miR-7-5p(A)和KLF4 mRMA(B)在食管癌TE1、Eca109和EC9706细胞中的表达水平
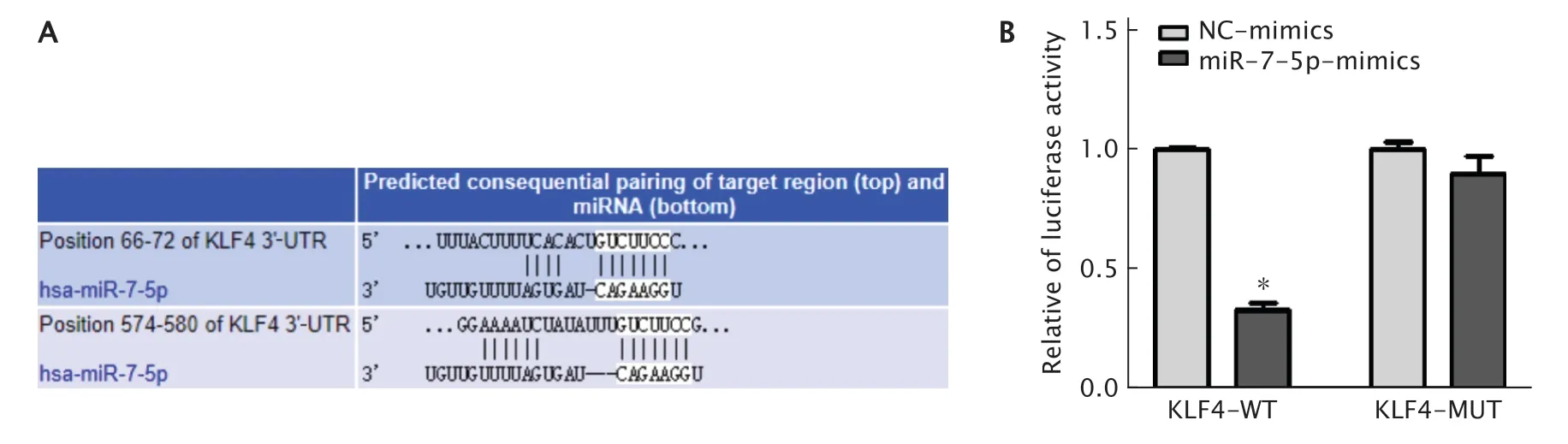
Fig.4 The targeted regulation of miR-7-5p on Krüppel-like factor 4 (KLF4).A:The binding site between the promoter region of KLF4 gene and miR-7-5p was predicted using TargetScan 7.1;B:The regulation of miR-7-5p on KLF4 was detected by double luciferase reporter assay.*P<0.05 (n=3).图4 采用TargetScan 7.1在线预测miR-7-5p与KLF4基因的相关性(A),并用双荧光素酶报道基因系统予以验证(B)
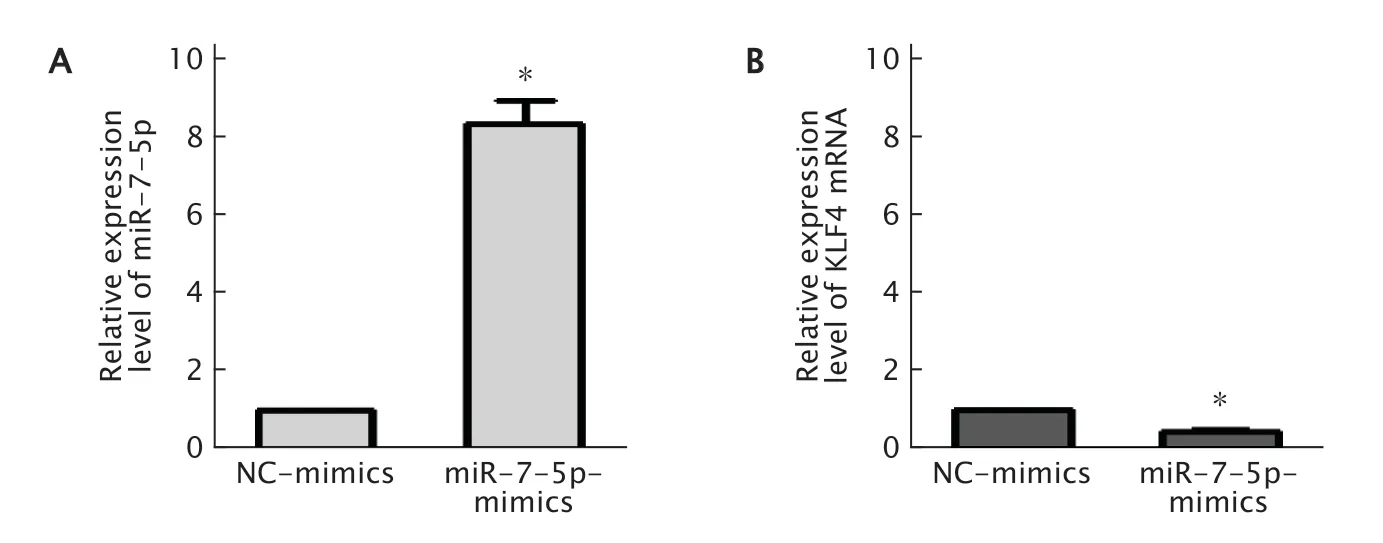
Fig.5 Real-time fluorescent quantitative PCR was used to detect the expression levels of miR-7-5p (A) and Krüppel-like factor 4 (KLF4) mRNA (B) in TE1 cells transfected with negative control (NC)-mimics or miR-7-5pmimics.*P<0.05,vs NC-mimics group (n=3).图5 实时荧光定量PCR检测转入miR-7-5p-mimics对TE1细胞中miR-7-5p和KLF4 mRNA表达水平的影响

Fig.6 The effect of miR-7-5p on the proliferation of TE1 cells through regulating Krüppel-like factor 4(KLF4).*P<0.05,vs NC-mimics group;△P<0.05,vs miR-7-5p-mimics group (n=3).图6 MST法检测miR-7-5p调控KLF4对TE1细胞增殖能力的影响
2.7 miR-7-5p调控KLF4对TE1细胞迁移能力的影响
Transwell实验检测结果(图7)显示,NCmimics组穿过小室膜的细胞数为(79.33±6.5)个,miR-7-5p-mimics组穿过小室膜的细胞数为(19.67±1.42)个,miR-7-5p-mimics+OEKLF4组穿过小室膜的细胞数为(40.67±3.98)个;与NC-mimics组 相比,miR-7-5p-mimics组 和miR-7-5p-mimics+OEKLF4组细胞迁移能力降低(P<0.05);而与miR-7-5p-mimics组相比,miR-7-5p mimics+OE-KLF4组细胞迁移能力增加(P<0.05)。这一结果提示,上调KLF4基因表达能减弱miR-7-5p对TE1细胞迁移能力的抑制作用。
2.8 miR-7-5p调控KLF4对Wnt/β-catenin信号通路的影响
蛋白质印迹法检测结果(图8)显示,与NC-mimics组相比,miR-7-5p-mimics组和miR-7-5p mimics+OE-KLF4组细胞中Wnt3a和β-catenin蛋白的表达水平降低。而与miR-7-5pmimics组相比,miR-7-5p-mimics+OE-KLF4组细胞中Wnt3a和β-catenin蛋白表达增加,KLF4减弱miR-7-5p 对Wnt3a和β-catenin的抑制作用。
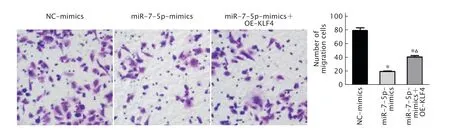
Fig.7 The effect of miR-7-5p on the migration ability of TE1 cells regulating Krüppel-like factor 4 (KLF4)(crystal violet staining,×200).*P<0.05,vs NC-mimics group;△P<0.05,vs miR-7-5p-mimics group (n=3).图7 miR-7-5p调控KLF4对TE1细胞迁移能力的影响
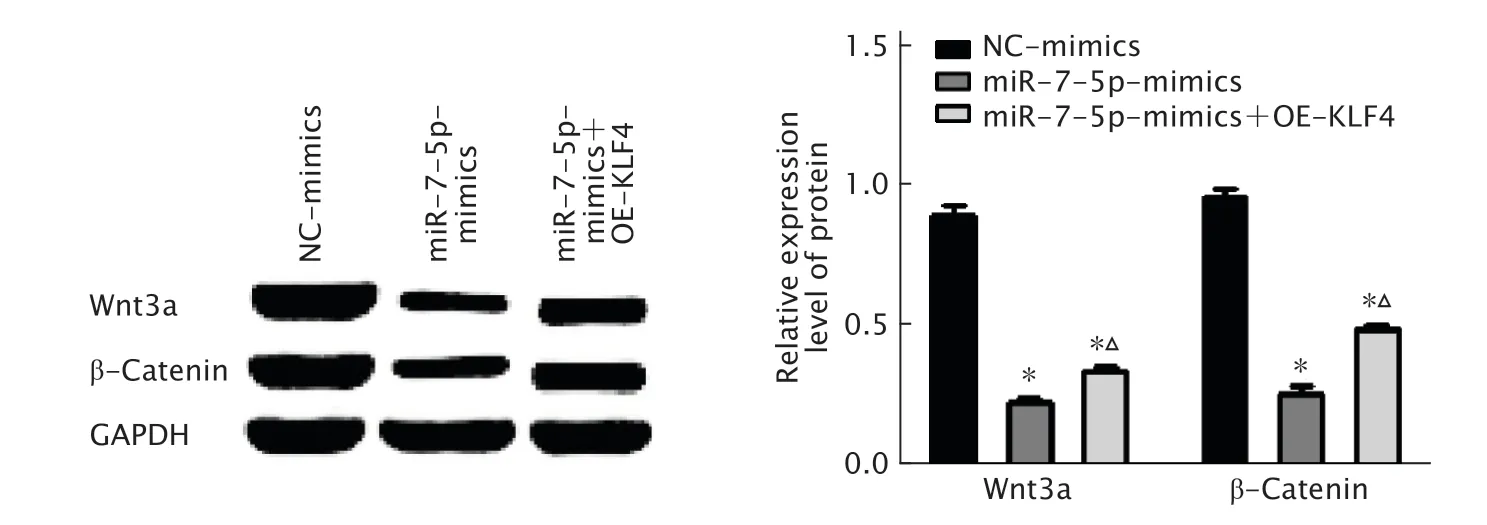
Fig.8 miR-7-5p attenuates the influence of Krüppel-like factor 4 (KLF4) on Wnt/β-catenin pathway.*P<0.05,vs NC-mimics group;△P<0.05,vs miR-7-5p-mimics group (n=3).图8 miR-7-5p负靶向调控KLF4对Wnt/β-catenin的影响
3 讨论
食管癌是最常见的恶性肿瘤之一,是与肿瘤相关死亡的第6大主要原因,也是全球第7大最普遍的肿瘤[1]。食管癌包括食管鳞状细胞癌和食管腺癌2种组织类型,食管腺癌在发达国家常见,而食管鳞状细胞癌在亚洲和其他发展中国家更常见,占中国食管癌病例的90%以上[12]。食管鳞状细胞癌具有直接侵袭和早期转移的能力,同时早期症状具有隐匿性,因此食管癌患者在初诊时通常已伴有晚期转移症状。早期食管癌患者的治疗仍然是手术切除为主,辅以放化疗,而晚期患者的治疗主要采取放化疗,由于肿瘤具有相当大的异质性,对放化疗的反应差异很大,放化疗抵抗性限制了食管癌患者治疗效果,导致其预后较差,5年生存率<5%[2]。目前,食管癌的发病机制尚未明确,因此研究与食管癌恶性进展密切相关的分子是探索食管癌新型药物的重要策略。
miRNA是一类短链非编码RNA,长度为20~24个核苷酸,目前在人类基因组中注释了3 000多个miRNA;miRNA的失调在许多人类疾病中,尤其在恶性肿瘤中被发现,因此可作为肿瘤患者早期诊断的标志物或作为患者生存和预后的预测因素。多项研究表明,miRNA可以作为肿瘤治疗的靶点进行抗肿瘤治疗[3]。miR-7是从miR-7-1、miR-7-2和miR-7-3转录而成的,它们都具有相同的成熟miRNA序列。miR-7-5p是该家族中研究最多的miRNA序列[13]。研究报道,miR-7-5p在非小细胞肺癌组织和细胞系中表达下调,其在体外和体内均抑制肿瘤细胞的增殖、迁移、侵袭和上皮-间质转化[4];miR-7-5p可抑制肝细胞肝癌细胞在小鼠体内的人成瘤作用,肿瘤体积和质量的增长[5];上述研究提示,miR-7-5p在非小细胞肺癌和肝细胞肝癌中发挥抑癌作用[4-5],但是其在食管癌中的作用仍未知。因此,本研究中首先检测了miR-7-5p在食管癌组织中的表达水平,实时荧光定量PCR结果显示,与配对的食管癌癌旁组织相比,食管癌组织中miR-7-5p的表达水平下调,表明miR-7-5p在食管癌中可能也发挥抑癌作用。miR-7-5p在结直肠癌组织中的低表达能够预测患者5年总体生存率低,其过表达抑制结直肠癌细胞增殖和迁移能力[7]。本研究未对患者的预后进行随访,因此在后续实验中需扩大组织样本进行进一步验证。本研究在细胞水平探讨了miR-7-5p在食管癌中发挥的具体作用,实时荧光定量PCR检测结果显示miR-7-5p在3株食管癌细胞中的表达均低于其在食管鳞状上皮细胞中的表达水平,与在组织中的表达水平一致。选择miR-7-5p表达最低的食管癌细胞进行miR-7-5p-mimics的转染,功能实验显示过表达miR-7-5p后,食管癌细胞的增殖和迁移能力均降低,表明miR-7-5p可抑制食管癌细胞的恶性进展。
一个miRNA可以调节数百或数千种不同的mRNA,调控靶mRNA是miRNA发挥作用的分子机制[6]。miR-7-5p已经明确的靶基因包括神经肿瘤腹侧抗原2(neuro-oncological ventral antigen 2,NOVA2)和p21激活的激酶2(P21-activated kinase 2,PAK2)等基因[4,13]。DONG等[7]报道,miR-7-5p在结直肠癌中通过靶向KLF4基因抑制肿瘤的进展,本文采用TargetScan 7.1软件预测miR-7-5p与KLF4的结合位点,并在食管癌细胞中利用双荧光素酶报告基因证实KLF4是miR-7-5p的靶基因,表明miR-7-5p可能通过KLF4抑制食管癌的增殖和迁移能力。KLF4是肿瘤相关转录因子,研究报道显示其在不同的肿瘤中可能发挥相反的作用,如KLF4通过转化生长因子β1(transforming growth factor-β1,TGF-β1)信 号通路维持结直肠癌细胞的干性和间质特性[8],而非小细胞肺癌中过表达KLF4,细胞的迁移和侵袭能力降低[9]。然而,KLF4在食管癌中的作用报道也不一致,SHAVERDASHVILI等[10]报道提示,KLF4通过激活核因子κB(nuclear factorκB,NF-κB)信号转导通路促进食管癌细胞的发生;CHEN等[11]报道提示,KLF4通过凋亡诱导和细胞周期阻滞增强顺铂对食管癌细胞的敏感性。本研究中采用实时荧光定量PCR检测发现,KLF4 mRNA在食管癌组织和细胞系中的表达水平均明显升高,并且相关性分析结果显示食管癌组织中KLF4与miR-7-5p的表达呈负相关性。进一步研究发现,miR-7-5p-mimics组中KLF4 mRNA的表达水平明显降低,表明miR-7-5p负调控KLF4的表达;同时通过过表达KLF4,在功能研究中发现KLF4可以回复miR-7-5p对食管癌细胞增殖和迁移的抑制作用,表明miR-7-5p可能是通过负调控KLF4参与食管癌的进展。Wnt3a和β-catenin是Wnt/β-catenin信号通路的重要基因,Wnt/β-catenin是与肿瘤增殖和迁移密切相关的信号通路[14],Wnt3a和β-catenin在食管癌中均高表达[15],促进食管癌的恶性生物学行为,而本研究发现miR-7-5p抑制Wnt3a和β-catenin的表达,而KLF4可以回调这种抑制作用,表明miR-7-5p靶向KLF4调控Wnt/β-catenin抑制食管癌增殖和迁移能力。
综上所述,miR-7-5p在食管癌组织和细胞系中低表达,KLF4在食管癌组织和细胞系中高表达,miR-7-5p靶向KLF4抑制食管癌细胞增殖和迁移能力,可能是通过抑制Wnt/β-catenin信号通路发生的。本研究结果提示,miR-7-5p可能是治疗食管癌的一个新的分子靶点。

