mTOR抑制剂在骨和软组织肿瘤的应用进展
任静祎,王祥旭,潘 伟,刘文超,张红梅
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是由mTOR基因编码,普遍存在于哺乳动物中的一种丝/苏氨酸蛋白激酶,其属于磷脂酰肌醇3-激酶相关激酶(phosphatidylinositol 3-kinase-related kinase,PIKK)家族,可接受并整合生长因子、环境压力、能量状态以及氨基酸等多种信号,并在参与调控细胞生长、增殖以及凋亡的信号通路中起枢纽作用。因此,mTOR信号通路的异常在肿瘤、肥胖、2型糖尿病和退行性神经病变等多种疾病的发生和发展中具有重要作用[1]。在肿瘤中,mTOR主要通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PBK,又称AKT)/mTOR信号通路发挥作用,PI3K能被与细胞膜受体结合的多种生长因子和氨基酸等受体酪氨酸激酶(receptor tyrosine kinase,RTK)信号激活,活化的PI3K通过磷酸化二磷酸磷脂酰肌醇(phosphatidylinositol 4,5-bisphosphate,PIP2)生成三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-triphosphate,PIP3),PIP3作为第2信使促进磷酸肌醇依赖性激酶1(phosphoinositide-dependent kinase 1,PDK1)与AKT的相互作用,引起AKT的Thr308位点磷酸化[2]。活化的AKT通过结节性硬化复合物1(tuberous sclerosis complex 1,TSC1)和TSC2形成的异二聚体激活下游效应因子mTOR,并上调各种转录因子,从而促进蛋白质合成,以使细胞存活与增殖[3]。在脑胶质瘤中发现了PI3K、AKT以及mTOR下游分子核糖体蛋白S6激酶1(S6 kinase 1,S6K1)的磷酸化水平升高,并且提示不良预后[4]。编码PI3K催化亚基p110α的PIK3CA基因突变是乳腺癌中最常见的遗传变异,在基因工程小鼠中发现p110α的结构变异可通过激活PI3K/AKT/mTOR信号转导通路促进细胞转化和肿瘤的发生[5]。
随着对mTOR相关通路的深入了解以及多项临床研究结果的公布,2019年NCCN指南将3种mTOR抑制剂(西罗莫司、依维莫司和坦罗莫司)推荐用于骨肉瘤、淋巴管平滑肌瘤病、复发性血管平滑肌脂肪瘤和血管周上皮样细胞瘤的治疗。此外,在骨肉瘤中推荐使用合并抗血管生成药物。其中,雷帕霉素(西罗莫司)因其广泛的抗增殖特性被应用于免疫抑制和抗肿瘤领域[6]。目前我国批准将雷帕霉素用于抗移植排斥反应,美国食品药品管理局(Food and Drug Administration,FDA)以Ⅱb级推荐其用于肺淋巴管平滑肌瘤病。坦罗莫司(Temsirolimus)作为首个被批准用于恶性肿瘤治疗的mTOR抑制剂,在2007年经FDA批准用于难治性晚期肾细胞癌的一线治疗。依维莫司于2009年经FDA批准用于肾血管平滑肌脂肪瘤、胃肠道及肺部晚期神经内分泌瘤的治疗,在国内其被批准用于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性晚期乳腺癌。本文将就mTOR通路相关复合体、信号通路途径、mTOR通路在不同肿瘤的作用机制以及当前的用药进展进行综述。
1 mTORC1和mTORC2
mTOR相关通路主要通过由6种蛋白组成的mTORC1和由7种蛋白组成的mTORC2这2种复合物发挥作用,二者共用mTOR催化亚基、mTOR负性调控亚基含DEP结构域的mTOR相互作用蛋白(DEP domain containing mTOR interacting protein,DEPTOR)、mLST8(mammalian lethal with SEC13 protein 8,又 名GβL)和Tti1/Tel2复合体这4种结构蛋白[7](图1)。Tti1因与裂殖酵母(Schizosaccharomyces pombe Tti1)具有序列同源性而得此名。Ttil与调节PIKK稳定性的哺乳动物同源蛋白Tel2(官方基因符号为TELO2,又称hCLK2)结合,可维持mTOR复合物的稳定与活化[8]。mTORC1其他部分包括mTOR调控相关蛋白(regulatory-associated protein of mammalian target of rapamycin,Raptor)和40 kDa富含脯氨 酸的AKT磷酸化底物(proline-rich AKT substrate of 40 kDa,PRAS40);mTORC2包括对雷帕霉素不敏感的mTOR伴侣(rapamycin insensitive companion of mTOR,Rictor)、哺乳动物应激活化蛋白激酶作用蛋白1(mammalian stressactivated MAPK interacting protein 1,mSin1,又称MAPKAP1)以及与Rictor同时观察到的蛋白(protein observed with Rictor,Protor)[1]。
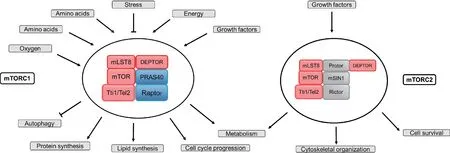
Fig.1 The diagram of mammalian target of rapamycin (mTOR) complex composition.mLST8:Mammalian lethal with SEC13 protein 8;Tti1/Tel2:A complex that maintains the stability and activation of the mTOR complex;DEPTOR:DEP domain containing mTOR interacting protein;PRAS40:Proline-rich AKT substrate 40;Raptor:Regulatory-associated protein of mammalian target of rapamycin;Rictor:Rapamycin insensitive companion of mTOR;mSin1:Mammalian stressactivated MAPK interacting protein 1;Protor:Protein observed with Rictor.图1 mTOR复合体构成图
mTORC1作为mTOR主要作用单位,可以通过整合生长因子、压力与能量状态、氧气和氨基酸等多种细胞内外信号以调控蛋白质、脂质合成以及自噬等多种细胞行为[1]。结节性硬化症相关突变基因TSC1和TSC2分别编码的错构瘤蛋白Hamartin(TSC1)和马铃薯蛋白Tuberin-2(TSC2)所形成的异源二聚体TSC1/2是mTORC1上游的主要负调节剂,小G蛋白Rheb是mTOR活化所必需的刺激蛋白,Tuberin-2通过使Rheb的GTP酶水解失活转化为Rheb-GDP从而抑制mTOR活化[9]。真核细胞翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E-binding protein 1,4E-BP1)是mTORC1下游调控细胞增殖的关键因子[10],活化的mTORC1通过介导S6K1和4E-BP1磷酸化,引起真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)释放,直接加快蛋白质翻译合成和细胞周期进程[11]。mTORC1还可间接上调脂肪酸合成酶(fatty acid synthase,FASN),进而促进恶性细胞快速增殖[12]。在大鼠肝细胞中发现,雷帕霉素可降低氨基酸对自噬的抑制作用[13],在酵母中可刺激自噬发生[14],从而间接抑制肿瘤生长。在乏氧微环境中,mTORC1可上调乏氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)的表达,促进肿瘤血管的生成,从而诱导肿瘤进展[15]。mTORC2较mTORC1对雷帕霉素敏感性低,所接受并整合的细胞信号也少于mTORC1,仅由生长因子激活。mTORC2主要通过激活AKT在肿瘤中发生作用,活化的AKT可通过增加葡萄糖摄取,促进糖酵解过程驱动细胞增殖,同时抑制细胞凋亡[16](图2)。
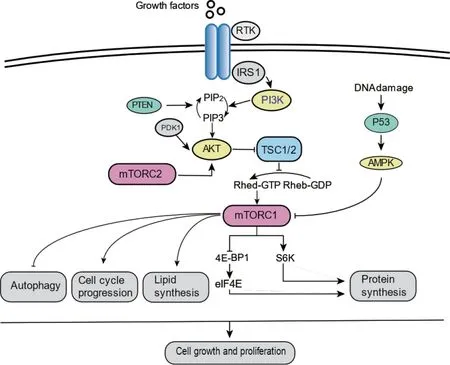
Fig.2 The diagram of PI3K/AKT/mTOR signalling pathway.RTK:Receptor tyrosine kinase;IRS1:Insulin receptor substrate 1;PI3K:Phosphatidylinositol 3-kinase;PIP2:Phosphatidylinositol 4,5-bisphosphate;PIP3:Phosphatidylinositol 3,4,5-triphosphate;PDK1:Phosphoinositide-dependent kinase 1;AKT:Protein kinase B (PBK,also known as AKT).AMPK:Adenosine 5’-monophosphate(AMP)-activated protein kinase;4E-BP1:Eukaryotic translation initiation factor 4E-binding protein 1;eIF4E:Eukaryotic translation initiation factor 4E;S6K:S6 kinase.图2 PI3K/AKT/mTOR信号通路
2 mTOR信号通路与骨和软组织肉瘤
2.1 mTOR信号通路与骨肉瘤
骨肉瘤是最常见的骨原发恶性肿瘤,近年来发现mTOR信号通路对骨肉瘤的发生和发展具有重要作用。通过对骨肉瘤细胞进行基因富集与突变分析,筛选出了32条受突变影响的信号通路,10条与细胞增殖、存活以及凋亡相关的重点通路中有4条与PI3K/mTOR途径有关,分别为PTEN、IGF1/mTOR、RAS和AKT,具体包括7种关于第10号染色体同源丢失性磷酸酶基因和张力蛋白(phosphate and tension homology deleted on chromsome ten,PTEN)基因的突变类型,2种TSC2中Tuberin结构域突变,1个神经纤维瘤病Ⅰ型蛋白(neurofibromin 1,NF1)基因的移码突变以及1个位于PIK3CA第545位氨基酸残基突变,此外在PI3K/mTOR通路中,磷酸肌醇依赖性蛋白激酶(phosphoinositide dependent protein kinase 1,PDK1)、AKT1和eIF4B存在突变。对4种人类和3种鼠骨肉瘤细胞系,以及此前已被证明对PI3K/mTOR双重抑制剂具有治疗反应的乳腺癌MCF-7细胞和PIK3CA基因突变的乳腺癌细胞应用PI3K/mTOR双重抑制剂GSK2126458、BEZ235以及PIK3CA选择性抑制剂PIK75后均表现出细胞凋亡,并且骨肉瘤细胞系的半数抑制浓度(halfmaximal inhibitory concentration,IC50)值与MCF-7细胞相似,这表明骨肉瘤细胞对PI3K/mTOR或PIK3CA抑制剂具有治疗敏感性[17]。
其次,多数骨肉瘤细胞存在表皮生长因子受体(epidermal growth factor receptor,EGFR)全基因组表达增加,同时伴有PI3K信号通路的负性调节基因PTEN的缺失突变,二者共同促进了肿瘤的增殖、血管生成和转移[18]。对65例原发性骨肉瘤石蜡包埋标本中mTOR和S6K1进行免疫组织化学法染色后发现,mTOR和S6K1分别在80%(52/65)和70.8%(46/65)的骨肉瘤细胞胞质中阳性表达,并且mTOR/S6K1阳性表达在单因素和多因素生存分析中均为预后不良因素[19]。Ezrin是细胞质膜与细胞骨架之间的重要连接蛋白ERM(ezrin/radixin/moesin)蛋白家族的重要成员,可作为细胞骨架肌动蛋白与细胞膜间的交联剂直接参与细胞与微环境的相互作用[20]。研究显示,Ezrin的表达增加了mTOR下游分子S6K1和4EBP-1的磷酸化水平以及S6K1的活性,与骨肉瘤的转移行为关系密切[21]。此外有研究指出,细胞外基质糖蛋白腱糖蛋白-C(tenascin-C,TN-C)可在机械应力的作用下,由mTOR、4EBP-1和S6K1辅助过表达,并与其剪接的FNIIIA1结构域共同促进骨肉瘤MG-63细胞的迁移和转移[22]。mTOR通过多种细胞内外信号与骨肉瘤的转移行为有着密切联系,除了上游已知的PI3K/AKT通路以外,mTORC1和mTORC2下游以及二者在mTOR中的作用关系仍需进一步阐明。
2.2 mTOR信号通路与软组织肉瘤
血管周上皮样细胞瘤(perivascular epithelioid cell tumor,PEComa)是间叶组织血管周上皮样细胞来源的一组罕见且复杂的软组织肉瘤肿瘤[23],免疫组织化学检测结果通常同时表达肌源性细胞标志物[平滑肌肌动蛋白(SMA)、泛肌动蛋白(pan-muscle actin)和波形蛋白(Vimentin)]和黑素细胞标志物(HMB45和黑色素细胞分化标志物Melan-A等)。PEComa包括血管平滑肌脂肪瘤(angiomyolipoma,AML)、淋巴管平滑肌瘤(lymphangioleiomyomatosis,LAM)、肺及肺外组织透明细胞“糖”瘤(clear cell“sugar”tumor of the lung,CCST)和镰状韧带/圆韧带的透明细胞肌黑素瘤(clear cell myomelanocytic tumor of the falciform ligament/ligamentum teres,CCMMT)等。PEComa多发生于肺,女性生殖系统及胃肠道系统等部位的恶性PEComa较罕见[24]。血管周上皮样细胞(perivascular epithelioid cells,PEC)具有独特的组织病理学和免疫组织化学特征,2002年以来,世界卫生组织将PEComa定义为一种由PEC组成的特殊间充质肿瘤,其在子宫、胰腺、肠道、乳房、颅底和软组织等部位的病例均有报道。
LAM是一种罕见的、低级别的、具有转移潜能、选择性靶向肺部且与肺囊性破坏有关的肿瘤,能高表达血管内皮生长因子C(vascular endothelial growth factor-C,VEGF-C)和VEGF-D这2种生长因子,并且可以通过淋巴管扩散[25]。LAM几乎只见于育龄期女性,主要表现为进展性囊性肺病,患者1 s用力呼气容积(forced expiratory volume in one second,FEV1)以每年75~118 mL的速度下降[26],后期多发展为不可逆性呼吸衰竭,中位生存期为8~10年,除肺移植外,目前仍缺乏有效的治疗手段[27]。AML由成熟的脂肪组织、平滑肌和血管组成,多发于肾脏和肝脏,是TSC和散发性LAM的常见继发病变,可见于40%的散发性LAM。AML通常为良性病变但具有破裂出血的风险,主要依靠手术治疗,其变种类型上皮样AML虽罕见但具有恶性潜能[28]。
由于PEComa涵盖良性、潜在恶性及恶性多种性质,当前对PEComa发病机制尤其是恶性进展机制了解有限,但多数AML、约30%的LAM以及少数散发性肺外PEComa均与TSC相关遗传改变,TSC1/2复合体的失活有关[29]。此外,散发性AML中也存在mTOR激活标志物磷酸化S6K1水平的增加[30],对该类患者应用西罗莫司后,肿瘤的体积出现明显的缩小[31]。多数良性PEComa在手术切除后不再复发,对潜在恶性或恶性PEComa则可选择mTOR抑制剂治疗。
3 mTOR抑制剂在骨和软组织肉肿瘤中的应用进展
3.1 mTOR抑制剂治疗骨肉瘤
体外研究显示,雷帕霉素可通过上调骨肉瘤细胞SaOS2和U2-OS中p27蛋白的表达水平,降低细胞周期相关蛋白D1(cyclin D1)的表达水平来抑制细胞增殖,诱导G1期细胞周期停滞和细胞自噬,在SaOS2和U2-OS细胞小鼠移植瘤模型中验证发现,雷帕霉素可显著减小荷瘤小鼠的肿瘤体积[32]。对212例晚期骨和软组织肉瘤患者使用mTOR抑制剂ridaforolimus单药的Ⅱ期临床研究显示,中位总生存期(median overall survival,mOS)为10个月,仅有4例达到部分缓解(2例骨肉瘤、1例梭形细胞肉瘤和1例恶性纤维组织细胞瘤)[33]。随着当前对mTOR通路相关靶点的药物研发及单药治疗的有限获益,多药联合将成为骨肉瘤的主要治疗模式。
在体外培养的人骨肉瘤细胞和小鼠骨肉瘤模型中,对PI3K和mTOR 2个靶点同时进行抑制可有效诱导肿瘤细胞的凋亡,而单一靶向抑制PI3K或mTOR则无效[34]。对骨肉瘤细胞系(MG-63、U2-OS和SaOS-2)应用PI3K/mTOR双重抑制剂NVP-BEZ235后发现,肿瘤细胞中cyclin D1和(或)cyclin B1的表达下调,细胞周期停滞在G0/G1期[35],在荷瘤小鼠模型中体现为异位骨肉瘤形成显著降低和脉管侵犯减弱[36]。既往的研究发现,胰岛素样生长因子-1(insulinlike growth factors-1,IGF-1)、IGF-2和IGF结合蛋白(IGF-binding protein,IGF-BP)在多种肉瘤亚型中表达,IGF-1和IGF-2刺激IGF-1受体(IGF receptor,IGF-1R)发生自磷酸化激活,后者可引起包括PI3K/AKT/mTOR途径在内的多项级联信号激活,从而诱导肿瘤进展[37]。在坦罗莫司联合IGF-1R单克隆抗体西妥木单抗(Cixutumumab)治疗骨和软组织肉瘤的Ⅱ期临床研究中[38],将174例患者分为57例IGF-1R阳性软组织肉瘤组、54例IGF-1R阳性骨肉瘤组和63例IGF-1R阴性肉瘤组,中位随访时间为18.6(2.9~30.9)个月,IGF-1R阳性软组织肉瘤组、IGF-1R阳性骨肉瘤组和IGF-1R阴性肉瘤组的mOS期分别为18.9、14.2和14.7个月,相较于Ridaforolimus单药,患者的生存期得到了显著延长。其中共有9例患者达到部分缓解,IGF-1R阳性软组织肉瘤组1例(1/57,1.75%)、IGF-1R阳性骨肉瘤组6例(6/54,11.11%)和IGF-1R阴性骨肉瘤组2例(2/63,3.17%),但无完全缓解病例。在进一步的研究中,对IGF-1和IGF-1R阳性患者血浆IGF的主要载体蛋白IGF-BP3进行定量分析显示其与生存无相关性,但所有在12周发生疾病进展的患者血浆IGF-BP3均显著增加(P<0.01)。在该研究中主要的3~4级不良反应为淋巴细胞减少症25例(25/174,14.37%)、血糖增高18例(18/174,10.34%)和口腔黏膜炎及血小板减少症均为19例(19/174,10.92%),另有4例患者死亡,且均为疾病进展所致。
在晚期和转移性骨肉瘤患者中发现,索拉非尼仅可短期维持肿瘤缩小或稳定状态,最终仍会发展为耐药。有动物实验研究显示,经多激酶抑制剂索拉非尼治疗的骨肉瘤异种移植小鼠较对照组mTORC1复合体的mTOR和下游转录因子4E-BP1和S6K1磷酸化水平降低,同时mTORC2-Rictor的负调控位点被去磷酸化,引起mTORC2激活,而索拉非尼联合依维莫司可完全抑制mTORC1和mTORC2通路,进而增强抗增殖、抗血管和促凋亡的作用,由此提示mTORC2的激活可能是索拉非尼的一种耐药机制[39]。一项对38例高级别骨肉瘤患者应用索拉非尼联合依维莫司的Ⅱ期临床研究显示,17例患者达到了6个月的无进展生存时间(progression-free survival,PFS),但未达到所设定的研究终点,即6个月时达到50%的PFS;65.78%的患者(25/38)因不良反应而减少剂量或短期停药,5.26%(2/38)的患者永久停药。主要的不良反应为淋巴细胞减少症、口腔黏膜炎和腹泻等,但未出现与治疗相关的死亡[40]。借由该项研究,索拉非尼联合依维莫司在2019年NCCN指南中被推荐用于不可切除的高级别骨肉瘤。此外,同时抑制mTORC1/mTORC2的ATP竞争性mTOR激酶抑制剂MLN0128在横纹肌肉瘤、恶性周围神经鞘瘤、滑膜肉瘤、尤文肉瘤、骨肉瘤和脂肪肉瘤细胞的体外实验中可显著抑制肿瘤细胞的增殖[41],由此提示完全抑制mTOR在其他软组织肉瘤中同样具有应用前景。
3.2 mTOR抑制剂治疗软组织肿瘤
3.2.1 LAM
体外研究表明,肺LAM细胞中存在S6K1过度磷酸化、S6K1组成型激活和DNA合成增加等生物学现象,西罗莫司可抑制上述异常激活并降低DNA合成[42]。一项对TSC/LAM患者使用西罗莫司的Ⅰ~Ⅱ期临床研究显示,患者肺功能在用药后得到明显改善并在停药1年后得到维持[43]。在一项对89例中度肺功能不全的LAM患者使用西罗莫司(46例)对比安慰剂(43例)的Ⅱ期研究[44]中发现,安慰剂组与西罗莫司组患者每月的肺功能监测显示,安慰剂组的FEV1为(-12±2)mL,西罗莫司组为(1±2)mL(P<0.001);安慰剂组的用力肺活量(forced vital capacity,FVC)为(-11±3)mL,西罗莫司组为(8±3)mL(P<0.001)。相较于安慰剂组,西罗莫司组血清中VEGF-D的表达水平降低,肺功能和生活质量均有改善,但6 min步行试验示肺活量、残气量和一氧化碳扩散能力无明显差异,由此提示肺功能的储备和运动能力未有改善,不良反应主要为皮肤、胃肠系统的感染和疼痛。在停药观察期内,2组患者的FEV1均下降且与基线数据的差异无统计学意义,由此提示维持肺功能的改善需长期用药。安慰剂组患者肺功能以每年约10%的速度减退,这提示中重度患者有必要进行药物控制。对24例LAM患者应用依维莫司的单臂Ⅱa期研究结果显示[45],除静态肺功能改善外,6 min步行距离较治疗前提高了47 m。对142例接受西罗莫司治疗1~4年的LAM患者进行回顾性分析显示[46],FEV、FVC、动脉氧分压、6 min步行试验和VEGF-D表达水平分别在治疗第1年、第1~2年、第1~3年和1~4年期间有所改善,且不良事件轻微,对患者肺功能的改善或稳定长达4年,同时血氧水平,运动能力和生活质量也得到了提高。另一项纳入600例患者且长期使用西罗莫司耐受性和安全性的国际多中心前瞻性临床研究(MIDAS)正在进行中(NCT02432560)。
3.2.2 AML
对25例散发性AML患者使用西罗莫司的Ⅰ/Ⅱ期临床研究显示,平均肿瘤体积对比治疗前基线体积减少(53.2±26.6)%(P<0.001)。20例随访患者中有16例(80%)患者的肿瘤体积减少超过30%,在停药后6和12个月时的肿瘤平均体积分别增加到治疗前基线体积的(76.8±27.5)%(P<0.001)和(85.9±28.5)%(P=0.005),但部分患者的病情在撤药后肾脏和肺部缓解出现一定程度的逆转[43]。一项Ⅱ期研究对16例TSC或散发性LAM和AML患者进行了2年的西罗莫司治疗的结果显示[47],16例AML患者的肿瘤直径均发生减小,其中8例减少超过30%。总计48个AML靶病灶中有41个体积小于基线,肿瘤缩减多见于第1年治疗。一项依维莫司对比安慰剂在结节性硬化症-1的临床研究EXIST-1(EXamining everolimus In a Study of Tuberous Sclerosis Complex-1)中的AML亚组分析结果显示[48],TSC相关性肾脏AML患者(TSC-associated renal angiomyolipomata,TSC-RAML)在使用依维莫司12、24和48周治疗后,靶病灶体积减少50%的患者比例分别为56.5%、78.3%和80.0%。EXIST-2扩展试验显示,TSC-RAML患者使用依维莫司可维持约4年的临床获益且安全性可控[49]。一项首次对中国TSC-RAML成年患者使用依维莫司的Ⅱ期试验显示[50],18例患者在3、6和12个月的部分缓解率分别为52.94%,58.82%和66.67%,同时肺功能和皮肤病变均得到改善。主要的不良反应为口腔黏膜炎(18/18,100%)、腹痛(14/18,77.78%)和高甘油三酯血症(13/18,72.22%),3级不良反应为口腔黏膜炎(2/18,11.1%)和月经不调(3/18,16.67%),均高于此前的研究,研究者考虑这可能与种族相关。此外有2例患者死亡,死因分别为自发性出血和术后感染。与LAM类似,AML同样需要长期使用维持疗效,远期获益可观,2019年NCCN指南推荐西罗莫司用于复发性AML,实际应用中对出血等不良反应和撤药后疗效的逆转情况还应仔细评估。
3.2.3 恶性PEComa
PEComas按表现分为3类:良性、具有恶性潜能和恶性[51],其中恶性PEComas较为罕见。由以下6种组织病理学特征作为恶性风险因素的参考:(1)肿瘤直径>5 cm或8 cm;(2)呈浸润生长;(3)高细胞核级别和高细胞性;(4)高有丝分裂活性:每50个高倍视野发现存在超过1个高分裂细胞;(5)出血坏死;(6)血管侵犯。仅具备肿瘤直径>5 cm这一条风险特征的PEComas为恶性潜能不确定,具有任何2条及以上的PEComas考虑为恶性[52]。因PEComa罕见,该标准尚未在更大系列研究中得到验证。恶性PEComa主要以手术切除为治疗手段,放化疗效果不明,复发及晚期患者治疗困难。
有个案报道显示,mTOR抑制剂在治疗恶性PEComa中有效[53]。1例69岁女性患者,在接受PEComa手术切除时经PET-CT检查发现右上肺孤立结节,术后标本采用免疫组织化学检测显示S6K1过度激活,因此使用坦罗莫司治疗。首月评估显示右上肺病变缩小35%,代谢活性降低50%,次月复查PET/CT显示残留病灶未见明显代谢,遂行右上肺叶切除;术后标本采用活性细胞检测显示较原发肿瘤减少40%,之后继续行坦罗莫司维持治疗。另1例患者为55岁女性,在接受PEComa切除术15年后出现心包及胸腔转移,术后1年CT检查结果显示肝转移,接受多柔比星联合异环磷酰胺化疗、肝脏放疗和依托泊苷治疗。数月后胸腔病变进展,因免疫组织化学检测显示S6K1激活,因此使用坦罗莫司;2个月后评效为部分缓解。之后陆续有报道显示,腹膜后PEComa伴肺转移患者在接受依维莫司治疗12周后,肺部病变消失,腹部肿块明显减少,并且未出现严重不良反应[54];肝脏恶性PEComa患者在应用西罗莫司8个月后肿瘤明显缩小,后行肝部分切除,并达到临床完全缓解且肝功能正常[55]。上述2例个案均提示,mTOR抑制剂可作为PEComa治疗的药物选择之一。一项对53例晚期/转移性PEComa患者的回顾性分析显示[56],吉西他滨方案的客观缓解率(objective response rate,ORR)为20%,中位PFS时间为3.4个月,蒽环类药物类似ORR为13%,中位PFS时间为3.2个月。抗血管生成药物ORR为8.3%,中位PFS时间为5.4个月,mTOR抑制剂ORR为41%,中位PFS时间为9个月,由此提示mTOR抑制剂治疗PEComa的应用前景良好。
3.2.4 mTOR抑制剂治疗其他软组织肉瘤
平滑肌肉瘤(leiomyosarcoma,LMS)是软组织肉瘤中最常见的亚型之一(15%~20%),40%~50%的LMS存在抑癌基因PTEN丢失[57]。有体外研究显示,PI3K/mTOR双重抑制剂BEZ235对LMS细胞具有较高的抗肿瘤活性[58],对2种LMS细胞应用表柔比星联合BEZ235相较于表柔比星单药抗肿瘤作用有所增强,对移植瘤小鼠使用BEZ235或联合表柔比星后肿瘤体积显著缩小[59],但仍需进一步的研究证明。
上皮样肉瘤(epithelioid sarcoma,ES)恶性程度高,其易发生淋巴结和肺转移,且5年生存率低[60]。对2种ES细胞系用依维莫司处理后,结果显示G0/G1期细胞所占比例明显增加,S期细胞所占比例明显减少,由此表明依维莫司可通过干预ES细胞周期发挥抗肿瘤的作用。但是,mTOR通路抑制可引起AKT信号重新激活,因而减弱了mTOR抑制剂的抗肿瘤作用并加快耐药进程[61]。而肝细胞生长因子(hepatocyte growth factor,HGF)及其受体c-MET在多数ES细胞中过表达[62]并且与依维莫司诱导的AKT激活有关,对ES应用依维莫司联合c-MET抑制剂INC280的体内外研究发现肿瘤生长均被有效抑制[63],由此提示同时靶向mTOR和c-MET通路可能成为治疗ES的一种有效方法。
4 总结与展望
mTOR作为细胞生长代谢过程中与多种信号因子发生作用的重要整合单位,与之相关的信号通路调控异常在肿瘤发生和发展中有着极为重要的作用,在包括骨肉瘤、PEComa、LMS和ES等多种恶性肿瘤中均存在不同程度的异常激活,mTOR抑制剂治疗其他肿瘤的临床研究也在进行中。随着对mTORC1和mTORC2 2种复合体的了解、mTOR与周围调控信号间正负反馈环路的形成、不同作用位点间的相互牵制以及基础与临床研究的探索,mTOR抑制剂单药治疗已不能满足对肿瘤多靶点和多通路的控制需求。mTOR抑制剂与化疗和抗血管生成抑制剂等多种靶向药物联合使用的疗效获益,无疑给晚期骨肉瘤和软组织肉瘤患者带来更多治疗选择。相信随着对mTOR及其通路的进一步认识,联合治疗方案的逐步优化有望改善更多肿瘤患者的远期获益。

