C-Myc/Bcl-2蛋白双表达弥漫大B细胞淋巴瘤中C-Myc、Bcl-2和Bcl-6基因重排的检测及临床意义
许 娟,杨文秀,冯江龙,濮珍红,杨 光,沈丹丹
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是最常见的非霍奇金淋巴 瘤(non-Hodgkin’s lymphoma,NHL),其生物学行为和临床过程都表现出很大的异质性[1]。DLBCL的类型很多,最常见的是非特指的DLBCL。日常工作中最常用的Hans分型将DLBCL分为生发中心细胞型(germinal center B-cell like,GCB)和非生发中心细胞型(nongerminal center B-cell like,non-GCB)[2],但 是这远远不能涵盖大B细胞淋巴瘤的异质性。双表达淋巴瘤(double-expression lymphoma,DEL)是指同时具有C-Myc和Bcl-2蛋白高表达(C-Myc阳性表达细胞所占百分比≥40%和Bcl-2阳性表达细胞所占百分比≥70%)的DLBCL。在2016年更新的WHO造血和淋巴组织肿瘤分类(第4版)中提出的高级别B细胞淋巴瘤(high-grade B-cell lymphoma,HGBL)的诊断中,其中一类就是具有C-Myc、Bcl-2和(或)Bcl-6基因重排这一遗传学改变的大B细胞淋巴瘤,即双打击(double-hit lymphoma,DHL)或三打击淋巴瘤(triple-hit lymphoma,THL)[3]。DHL/THL发病率不高,但其C-Myc和Bcl-2蛋白阳性表达率高达80%~90%[4],多数属于DEL,有研究认为,DHL和THL比DEL的临床过程和预后更差。DEL对临床上B细胞非霍奇金淋巴瘤(B cell non-Hodgkin’s lymphoma,B-NHL)常用的治疗方案R-CHOP[利妥昔单抗(rituximab)+环磷酰胺(cyclophosphamide)+多柔比星(adriamycin)+长春新碱(oncovin)+强的松(prednisone)]反应较差,容易复发成为难治性B细胞淋巴瘤[5]。目前,对于这类淋巴瘤的有效治疗方法一直在探索研究中[6]。淋巴瘤的免疫表型和遗传学特征与临床预后及其治疗反应密切相关[7],故DEL遗传学和免疫表型相关的研究是实施其个体化医疗的关键。不同的DEL病例C-Myc和Bcl-2双表达的分子机制不尽相同,其生物学行为和遗传学改变也有所差异,在DEL病例中探讨C-Myc、Bcl-2和Bcl-6基因变化特点的研究尚鲜有报道。本研究拟通过免疫组织化学法检测蛋白表达和荧光原位杂交(fluorescencein situhybridization,FISH)检测基因断裂情况,探讨C-Myc、Bcl-2和Bcl-6基因重排在DEL中的发生及其临床意义。
1 资料与方法
1.1 病例收集
收集2010年1月1日—2018年12月31日由贵州医科大学附属医院病理科确诊的DLBCL病例资料,从中筛选出39例C-Myc和Bcl-2蛋白双表达病例纳入研究。
纳入标准为:临床病理资料完整,石蜡包埋肿瘤组织充足,免疫组织化学检测结果提示C-Myc和Bcl-2均为高表达者。排除标准:临床病理资料欠缺,石蜡包埋组织材料过少,并发其他恶性肿瘤,免疫组织化学检测结果提示C-Myc和Bcl-2表达水平不满足DEL诊断标准者。本研究内容已获得贵州医科大学附属医院伦理委员会批准。
1.2 主要试剂及仪器
抗C-Myc、Bcl-2、CD10、Bcl-6和多发性骨髓瘤癌基因1(multiple myeloma oncogene 1,MUM1)单克隆、羊抗小鼠和(或)兔IgG(二抗)[通用二步法试剂盒,小鼠和(或)兔增强聚合物法检测系统](PV-9001)、EDTA修复液、EB病毒编码的小分子RNA(Epstein-Barr virus encode RNA,EBER)原位杂交检测试剂盒及DAB染色试剂盒均购自北京中杉金桥生物技术有限公司,抗p65抗体单克隆购自美国Cell Signaling Technology公司;FISH探针[C-Myc(8q24)、Bcl-2(18q21)和Bcl-6(3q27)基 因双色分离探针]及DAPI染色剂购自广州安必平医药科技有限公司。
光学显微镜DM6B和原位杂交仪(Thermobrite)均为德国Leica公司产品。
1.3 免疫组织化学法检测C-Myc、Bcl-2和p65的表达情况
采用PV二步法,抗原修复采用高压热修复(C-Myc和Bcl-2使用EDTA修复液,p65、CD10、MUM1和Bcl-6使用柠檬酸盐修复液),具体操作步骤按照PV-9001试剂盒操作说明进行。一抗为抗C-Myc和Bcl-2单克隆抗体(体积稀释比例为1∶200)和抗p65单克隆抗体(体积稀释比例为1∶1 200)]。C-Myc、Bcl-2和p65检测以本课题组既往检测阳性病例档案蜡块作为阳性对照,用PBS代替一抗作为空白对照。
免疫组织化学检测结果判定:以细胞核和细胞质出现浅黄色、棕黄色或棕褐色信号为阳性。C-Myc阳性信号位于细胞核上,Bcl-2阳性信号位于细胞质,p65阳性信号位于细胞核和细胞质(图1)。随机选择10个不重复的视野(放大倍数为400倍),每个视野随机计数400个肿瘤细胞中阳性细胞所占的比例,取10个视野的平均值作为该病例的表达率。参阅参考文献[8],C-Myc阳性细胞所占的比例≥40%为高表达,Bcl-2阳性细胞所占的比例≥70%为高表达,若C-Myc和Bcl-2均高表达则定义为C-Myc/Bcl-2双表达的B细胞淋巴瘤;p65阳性细胞所占的比例≥20%为阳性表达[9]。
1.4 FISH检测C-Myc、Bcl-2和Bcl-6基因的重排情况

Fig.1 The expressions of C-Myc,Bcl-2 and p65 proteins in diffuse large B cell lymphoma (DLBCL)patients with double expression of c-myc and Bcl-2 tissues were detected by immunohistochemistry (DAB staining,×400).图1 免疫组织化学法检测DEL组织中C-Myc、Bcl-2及p65蛋白的表达情况(DAB,×400)
根据HE染色切片观察选择典型病变区域作为杂交区域。检测严格按照试剂盒说明书步骤进行,简述如下:切4 μm石蜡切片,65 ℃烘烤60 min,用二甲苯溶液脱蜡后,梯度乙醇溶液(100%→95%→85%→75%)复水;蒸馏水高压喷气后3 min,加入胃蛋白酶37 ℃消化25~40 min;用2×SSC溶液洗涤后,梯度乙醇溶液(75%→85%→95%→100%)脱水晾干,随后避光加入6~10 μL探针[C-Myc(8q24)、Bcl-2(18q21)和Bcl-6(3q27)基因双色分离探针],85 ℃变性5 min,37 ℃杂交16~18 h;37 ℃条件下以2×SSC溶液、2×SSC/0.1% NP-40及75%乙醇溶液洗涤晾干后DAPI复染。图像采集、分析和保存在FISH图像分析软件中完成。判读标准:正常基因表现为2个红色和绿色荧光融合的黄色信号;典型的基因断裂信号类型是1个红色、1个绿色和1个黄色信号。每个病例分析200个细胞,根据文献出现1个红色和1个绿色分离信号的肿瘤细胞>10%确定为有重排[10]。
1.5 原位杂交法检测EBER表达水平
实验步骤简述如下:切石蜡切片(厚度为4 μm),65 ℃烘烤60 min,二甲苯溶液脱蜡,无水乙醇水化,室温风干,水浴箱37 ℃预热湿盒加胃蛋白酶消化,去离子水洗后梯度乙醇溶液(75%→95%→100%)脱水,切片风干后滴加地高辛标记的EBER探针封闭过夜(37 ℃杂交仪中),滴加辣根过氧化物酶标记的抗地高辛抗体37 ℃孵育30 min,DAB显色及苏木精染色后盐酸分化,梯度乙醇溶液(75%→95%→100%)上行脱水风干加中性树胶封片观察结果。阳性判定:核表达阳性肿瘤细胞所占百分比≥10%认为是EBER阳性。
1.6 随访
通过住院病历资料收集患者临床相关数据,随访方式主要是电话咨询,随访内容包括患者首次确诊后的治疗方案、生存及复发情况。以首次确诊时间为随访开始时间,患者死亡或失访结束随访,存活患者随访截止日期为2020年3月1日。39例DEL病例中获访33例,失访6例,获访率84.62%(33/39);其中存活24例,死亡9例。
1.7 统计学方法
用SPSS21.0软件对实验数据整理分析。计数资料组间比较采用Fisher精确检验,采用Kaplan-Meier法绘制患者的总生存(overall survival,OS)时间曲线;生存曲线的比较采用对数秩检验(log-rank),采用COX比例风险回归模型对预后进行多因素统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床病理学特征
39例患者中男性20例,女性19例,男女比例为1.05∶1;中位年龄为64岁(范围:28~79岁);Hans分型:GCB型16例,non-GCB型23例;Ann Arbor分期:Ⅰ和Ⅱ期14例,Ⅲ和Ⅳ期25例;国际预后指数(international prognostic index,IPI)评 分:0~2分15例,3~5分24例;32例患者行乳酸脱氢酶(lactate dehydrogenase,LDH)检测,>245 U/L者17例,≤245 U/L者15例;原发部位:淋巴结内15例,淋巴结外24例;Ki-67表达:肿瘤细胞≥80%者26例,<80%者13例。p65蛋白表达阳性21例(non-GCB 16例,GCB 5例),阴性18例(non-GCB 7例,GCB 11例);p65在non-GCB亚型中高表达(P=0.025,Fisher精确检验)。
2.2 FISH检测结果
FISH检测结果(图2)显 示,C-Myc及Bcl-2基因单独重排者均为9例(9/39,23.08%),Bcl-6基因单独重排者12例(12/39,30.77%),DHL和THL者5例(2例为C-Myc和Bcl-2基因重排,1例为C-Myc和Bcl-6基因重排,2例为C-Myc、Bcl-2和Bcl-6基因重排),检出率为5/39(12.82%)(DHL及THL临床病理资料见表1),Bcl-2和Bcl-6基因同时发生重排者3例。
2.3 几种基因重排与DEL临床病理学特征的关系
C-Myc、Bcl-2及Bcl-6基因重排与DEL临床病理特征的关系见表2。C-Myc基因重排和HGBL与年龄有关,好发年龄<60岁;Bcl-2和Bcl-6基因重排与免疫表型有关,好发于GCB型,差异有明显的统计学意义。
2.4 生存分析结果

Fig.2 The C-Myc,Bcl-2 and Bcl-6 genes rearrangement in diffuse large B cell lymphoma (DLBCL)patients with double expression of C-Myc and Bcl-2 tissues were detected by fluorescence in situ hybridization (FISH) method (×1 000).图2 FISH法检测C-Myc、Bcl-2和Bcl-6基因的重排结果(×1 000)
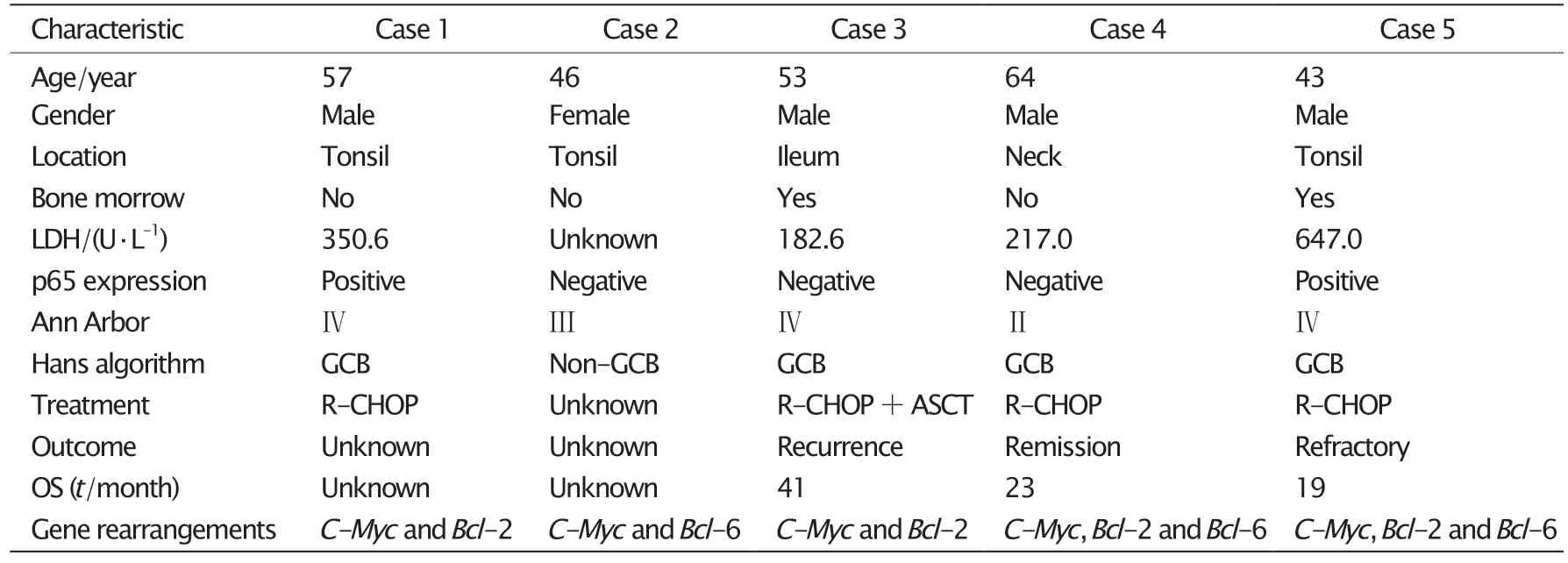
表1 5例伴有C-Myc、Bcl-2和(或)Bcl-6基因重排DLBCL患者的临床病理特征Table 1 Clinicopathological characteristics of diffuse large B cell lymphoma (DLBCL) with C-Myc、Bcl-2 and (or) Bcl-6 gene rearrangements
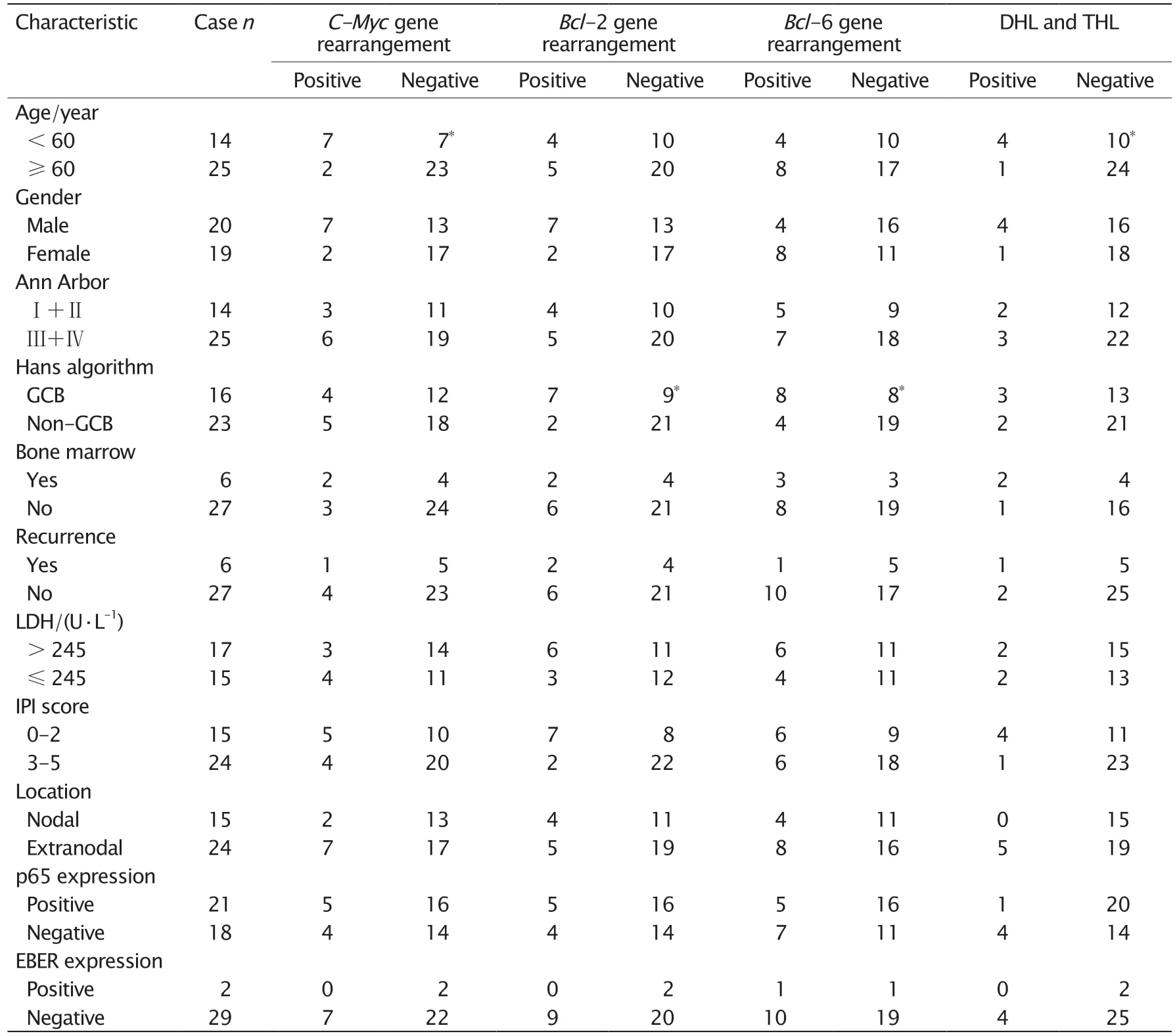
表2 4种基因重排对DEL临床病理特征的影响Table 2 Effects of C-Myc,Bcl-2 and (or) Bcl-6 gene rearrangements on double-expression lymphoma(DEL) clinicopathological characteristics
39例DEL病例中获访33例,失访6例,随访率为84.62%(33/39);其中存活24例,死亡9例,中位存活时间为24.5个月。获访病例中诊断后接受R-CHOP方案治疗者17例,RE-CHOP方案[R-CHOP+依托泊苷(etoposide)]治疗者5例,CHOP方案治疗者4例,R-CHOP方案联合自体干细胞移植者2例,CHOP方案联合自体干细胞移植者1例,DAEPOCH方案[剂量调整(依托泊苷+强的松+长春新碱+环磷酰胺+多柔比星)]治疗者1例,确诊后未治疗者4例,且经治疗后复发者6例,其余病例治疗方案不详。基因重排与DEL患者生存状况的关系见图3,其中Bcl-6基因重排阳性组OS期低于阴性组,差异具有统计学意义(P=0.037)。多因素COX回归分析结果见表3。

Fig.3 Comparison of survival analysis between positive and negative double-expressing lymphoma gene rearrangement cases.A:C-Myc rearrangement positive vs negative cases (P=0.179);B:Bcl-2 rearrangement positive vs negative cases (P=0.087);C:Bcl-6 rearrangement positive vs negative cases (P=0.037);D:C-Myc,Bcl-2 and (or) Bcl-6 rearrangement positive vs negative cases (P=0.326).OS:Overall survival.图3 Kaplan-Meier法分析C-Myc(A)、Bcl-2(B)和Bcl-6(C)基因重排以及HGBL(D)对DEL患者OS时间的影响

表3 DEL患者预后相关因素的多因素COX回归分析Table 3 Multivariate COX regression analysis of prognostic factors related to diffuse large B cell lymphoma(DLBCL) patients with double expression of C-Myc and Bcl-2
3 讨论
DLBCL的异质性体现在病因、临床过程、预后、细胞来源、遗传学特点和免疫表型等多个方面。其中,肿瘤细胞的遗传学特征和免疫表型对DLBCL的临床预后有重要影响。位于染色体8q24上的C-Myc基因、18q21上的Bcl-2和3q27上的Bcl-6是重要的转录因子或凋亡相关蛋白编码基因[9],其表达的蛋白参与细胞的分化、生长、增殖以及凋亡等重要过程,对于HGBL的DHL和(或)THL中所出现的C-Myc、Bcl-2或Bcl-6基因的重排对其临床过程和预后、治疗效果都有明显影响,使其容易发展成为复发/难治性的大B细胞淋巴瘤。然而,临床中DEL远比DHL多见,虽然DEL的临床过程和预后也较差。研究显示,相当一部分DEL中存在NFκB的异常表达,后者与DLBCL的不良预后有关。因此,DEL中C-Myc、Bcl-2或Bcl-6基因重排等遗传学改变对其发生和发展以及免疫表型的影响值得进一步予以探讨。
本研究在对39例DEL的DLBCL患者的基因重排检测中发现,C-Myc和Bcl-2基因重排检出率均为23.08%(9/39),Bcl-6重排检出率为30.77%(12/39)。与既往文献报道相比[12-13],本组DEL病例中C-Myc、Bcl-6和Bcl-2重排检出率明显高于其他非特指的DLBCL,尤其是DHL的检出率(12.82%)明显高于非特指的DLBCL。结果表明,C-Myc/Bcl-2双表达对DHL和(或)THL的发现有初筛的意义,这与既往的报道一致。值得提出的是,本研究还发现在年龄<60岁的DEL病例中,更容易发生C-Myc基因重排以及DHL和(或)THL;在本研究检测出的5例DHL和(或)THL中,原发于扁桃和头颈部者占大多数,并以GCB型DLBCL为主。这表明年龄<60岁、原发扁桃和颈部的GCB型DEL对DHL和(或)THL诊断更有提示意义,对此类患者须进行C-Myc、Bcl-2和Bcl-6基因重排的检测。
既往文献报道及本课题组前期研究[14-15]都发现,DLBCL中存在与NF-κB活化相关的多种基因异常,故转录因子NF-κB异常活化是DLBCL的重要特征,其异常活化在non-GCB型DLBCL中尤其明显。本研究检测发现,39例DEL患者中p65(NF-κB最关键的组件之一)的阳性表达率为53.84%(21/39),21例阳性表达病例中non-GCB型16例,GCB型5例;在GCB和non-GCB型DEL病例中p65表达有明显差异,p65在non-GCB亚型中显示为高表达,这与本课题组在其他非特指DLBCL中的研究结果一致。p65表达在DHL和(或)THL病例中的阳性表达率为40%,低于其他的DEL病例(58.8%);这一结果提示,在DHL和(或)THL病例中C-Myc和Bcl-2的表达与NF-κB活化可能无关,而是C-Myc和Bcl-2基因重排的结果,但2组间的p65表达水平未见差异有统计学意义,这可能与本研究中DHL和(或)THL的研究病例数少有关。p65在DEL中阳性表达率在50%以上,这说明半数以上的DEL病例都存在NF-κB的异常活化。由于C-Myc和Bcl-2都是NF-κB通路的下游分子,本研究提示在上述基因重排阳性和阴性的病例中C-Myc和Bcl-2的表达都可能与p65表达有关。NF-κB异常活化是DLBCL的重要特征,故在基因重排阴性的DEL中,2种蛋白高表达是否与NF-κB活化有关或是其他的分子机制还需要扩大研究范围并采用多层次的研究方法进行深入探讨。
DEL和DHL都有较差的临床过程、治疗反应和预后,这已经被既往的研究所证实。LDH、IPI、临床分期、发生部位和年龄都与DLBCL的临床发展和预后有关。EB病毒(Epstein-Barr virus,EBV)与淋巴瘤发生和发展的相关性早有报道,其与免疫缺陷相关DLBCL的发生密切相关。本研究比较分析了39例DEL中不同基因重排情况,以及对患者部分临床病理特征的影响,并分析了不同基因重排和一些临床病理特征对患者生存状况的影响。结果发现,39例DEL病例中,Bcl-2与Bcl-6基因重排发生与DEL的Hans分型有关,这与既往报道一致;GCB型DEL病例中Bcl-2基因发生重排者明显多于non-GCB型患者,但Bcl-6基因重排也在GCB型DEL中多见的结果,这与其他研究报道不同[16]。造成这一结果的原因是客观的地区差异,还是本研究中病例的偏差还有待于扩大研究样本做进一步的研究。本研究中发现,C-Myc基因重排与DHL和(或)THL发生与DEL患者年龄的关系也在本研究中被发现,在<60岁的病例中发生率明显高于≥60岁的病例。上述结果表明,C-Myc和Bcl-2基因重排可能是DEL,尤其是DHL和(或)THL中C-Myc和Bcl-2双表达的又一个重要分子机制。此外,本研究发现,有3例DEL为同时发生Bcl-2和Bcl-6基因重排,Hans分型是GCB-DEL,没有发生骨髓浸润,R-CHOP治疗后都得到缓解。这说明DEL中不同的基因重排与其临床过程和疗效有关,Bcl-2和Bcl-6基因重排与DEL较好的临床过程和疗效可能有关,这有待进一步扩大研究和延长随访时间进一步观察。本研究还发现3种基因重排的发生与DEL患者的临床分期、IPI、血清LDH水平及EB病毒感染无关。
众所周知,瘤细胞分子遗传学的改变对患者生存预后会产生明显的影响。关于C-Myc、Bcl-2和Bcl-6基因重排以及DHL和(或)THL对患者预后及生存率的影响报道不一,既往研究认为C-Myc重排阳性、Bcl-2重排阳性及DHL和(或)THL是较差的OS标志[17],而对于Bcl-6基因重排阳性对患者预后的影响目前尚未统一。本研究发现,Bcl-6基因重排阳性患者的生存状况则较阴性患者差。而单一的C-Myc或Bcl-2基因重排、DHL阳性和阴性病例之间生存状况没有明显差异,COX多因素回归分析发现,3种基因重排及3种蛋白表达都不是C-Myc和Bcl-2双表达DLBCL的预后相关因素。这一结果可能与本研究病例数少和回顾性研究的局限性相关,因此有关C-Myc、Bcl-2和Bcl-6基因重排对于DEL临床过程和预后的研究,还需要进一步开展更大样本量、多中心和前瞻性队列研究。
综上所述,DEL病例中有较高的C-Myc、Bcl-2和Bcl-6基因重排发生率,而且与患者的年龄和Hans分型有关,不同的基因重排发生与DEL的临床过程和预后有一定影响,应该常规进行这3种基因重排检测为临床治疗方案的确定提供依据并发现预后不良的相关因素。

