长链非编码RNA TP73-AS1调控miR-181b及其靶基因HMGB1的表达以及对非小细胞肺癌细胞生物学行为的影响
李 超,何 淼,杨桄权,何小艳,陈兆红
肺癌是全球发病率和死亡率最高的恶性肿瘤之一,2018 年全球新增肺癌209 万例(占癌症总数11.6%),死亡176 万例(占癌症总死亡18.4%)[1]。根据病理类型可将肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)两大类,其中NSCLC 最为常见,约占肺癌的85%[1]。虽然近年来,肺癌的研究取得了巨大进展,但是患者的5 年生存率仅约11%[2],因此寻找新型生物学标志物有重要意义。
长链非编码RNA(long non-coding RNA,LncRNA)是长度超过200 个核苷酸、不能编码蛋白质的RNA,其广泛表达于人体各个组织和器官。LncRNA 在细胞增殖和分化、细胞周期、表观遗传学和免疫监控中起到重要作用,与肿瘤的发生和发展密切相关[3]。LncRNA TP73-AS1 具有重要的生物学功能,在膀胱癌、结直肠癌、乳腺癌和骨肉瘤等肿瘤中异常表达,并且与患者预后密切相关[4-7]。TP73-AS1 在NSCLC 中的作用及机制既往少有报道。
LncRNA 与 微RNA(microRNA,miRNA,miR)的相互作用在癌症发生过程中扮演着重要角色,而miRNA 可以通过调控下游靶基因介导肿瘤的进展[8]。miR-181b 在NSCLC 中表达下调,可发挥抑癌基因的作用[9]。前期,采用生物信息学技术预测到miR-181b 可能是TP73-AS1的靶基因,而高迁移率族蛋白B1(high-mobility group box-1,HMGB1)可能是miR-181b 的靶基因,因此本研究中首先检测了NSCLC 组织和细胞中TP73-AS1 的表达水平,随后探讨了TP73-AS1 通过调控miR-181b/HMGB1 轴 对NSCLC 细胞增殖、侵袭、迁移和凋亡的影响,以期为探寻诊治NSCLC 的标志物提供进一步的理论依据。
1 材料与方法
1.1 细胞、试剂和仪器
人正常肺上皮细胞BEAS-2B 和人NSCLC细胞(A549 和NCI-H1299)均购自中国科学院上海细胞库。shRNA-TP73-AS1(shTP73-AS1)及其阴性对照(shRNA-NC,shNC)、miR-181b-模拟物(mimics)及其阴性对照(NCmimics)、miR-181b-抑制子(inhibitor)及其阴性对照(NC-inhibitor)和携带有HMGB1 全基因的过表达重组载体pcDNA-HMGB1 以及空载体pcDNA 均购自上海吉玛制药技术有限公司。DMEM 培养液和胎牛血清购自上海蓝季科技发展有限公司;CCK-8 试剂盒和Transwell 小室均购自上海宇淳生物科技有限公司;AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自生工生物工程(上海)股份有限公司;转染试剂LipofectAMINETM2000、PCR 相关试剂盒(包括AMV 反转录试剂盒和2×SYBR Green PCR Mastermix 试剂盒)、BCA蛋白提取试剂盒和SDS-PAGE 凝胶快速制备试剂盒均购自日本宝生物工程株式会社;PCR 引物由生工生物工程(上海)股份有限公司合成并提供。兔抗人HMGB1 和GAPDH(内参照)单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG 购自艾博抗(上海)贸易有限公司。
细胞培养 箱(3110 型)为美国Thermo Electron 公司产品,倒置光学显微镜(IX71 型)为日本Olympus 公司产品,电泳仪(164-5050 型)、荧光定量PCR 仪(CFX96 Touch 型)和免疫酶标检测仪(680 型)均为美国Bio-Rad 公司产品,凝胶成像仪(FP-UVCI-2100 型)为美国Major Science 公司生产,流式细胞仪(FACSCanto Ⅱ型)为美国BD 公司产品。
1.2 患者资料及NSCLC 组织样本
选取2012 年1 月—2013 年6 月在德阳市人民医院确诊的42 例NSCLC 患者手术切除的癌组织及对应的癌旁组织(距离癌组织≥5 cm)。其中男性26 例,女性16 例;年龄范围42~69岁,平均年龄(57.34±4.82)岁。所有患者术前均未接受放化疗或免疫治疗。组织标本收集后立即冻存于液氮罐中,随后储存于-80 ℃冰箱保存。术后对所有患者进行门诊随访和电话随访,术后第1 年每3 个月随访1 次,随后每半年随访1 次。随访截止时间为2018 年9 月。
1.3 细胞培养
正常肺上皮细胞BEAS-2B 以及NSCLC 细胞A549 和NCI-H1299 用含10%胎牛血清、链霉素100 μg/mL 及青霉素100 U/mL 的DMEM培养液,置于37 ℃、CO2体积分数为5%培养箱中培养。选取对数生长期的A549 和NCI-H1299细胞,用胰蛋白酶消化后,以1×105个/mL 的密度将2 mL 细胞悬液接种于6 孔板中,置于37 ℃、CO2体积分数为5%条件下培养24 h。
1.4 实时荧光定量PCR 法检测肿瘤组织及细胞中TP73-AS1、miR-181b 和HMGB1 mRNA 的表达水平
取50 mg 组织样本,置于1.5 mL 离心管中,加入1 mL TRIzol 试剂充分匀浆;取BEAS-2B、A549 和NCI-H1299 细 胞5×107个,置于1.5 mL 离心管中,加入1 mL TRIzol 试剂进行处理;室温静置5 min 后依次加入氯仿、异丙醇和75% 乙醇溶液提取总RNA,并进一步反转录为cDNA(反应条件为37 ℃ 15 min,85 ℃ 15 s);随后,以cDNA 为模板进行PCR扩增(反应条件为95 ℃ 10 min,95 ℃ 30 s、60 ℃ 15 s、72 ℃ 20s,共40 个循环;72 ℃ 10 min)。用2-ΔΔCt法计算目的基因相对表达量,引物序列见表1。
1.5 敲减TP73-AS1 对癌细胞增殖、侵袭、迁移和凋亡的影响
1.5.1 转染及转染效率的检测
按照LipofectAMINETM2000 试剂盒说明书。制备LipofectAMINETM2000 复合物,每孔加入240 μL无血清双抗培养液和10 μL LipofectAMINETM2000,温室孵育5 min;制备DNA 复合物,每孔加入246 μL 无血清培养液和4 μg 质粒(1.0 μg/μL);将2 个复合物混匀,制成DNA-LipofectAMINETM2000 复合物,温室静置20 min。将6 孔板中的细胞用无血清培养液清洗2 次,随后将复合物加入6 孔板中,温室培养6 h 后更换为含血清的培养液,继续培养48 h后进行下一步检测。
将细胞分为shNC 组(转入shRNA-NC)和shTP73-AS1 组(转入shRNA-TP73-AS1)。收集转染48 h 后的2 组细胞,用实时荧光定量PCR检测TP73-AS1 的表达水平,实验步骤同1.4 节。
1.5.2 CCK-8 法检测细胞的增殖能力
取转染48 h 后处于对数生长期的细胞,以1×104个/ 孔的密度接种于96 孔板中,每孔100 μL。在A549 和NCI-H1299 细胞中分别转染shTP73-AS1、miR-181b-inhibitor 和pcDNAHMGB1,以未转染细胞作为对照组。待细胞贴壁后,分别于培养0、24、48、72 和96 h 时加入10 μL CCK-8 试剂,培养2 h 后在免疫酶标检测仪波长450 nm 处检测各孔的D450nm值。
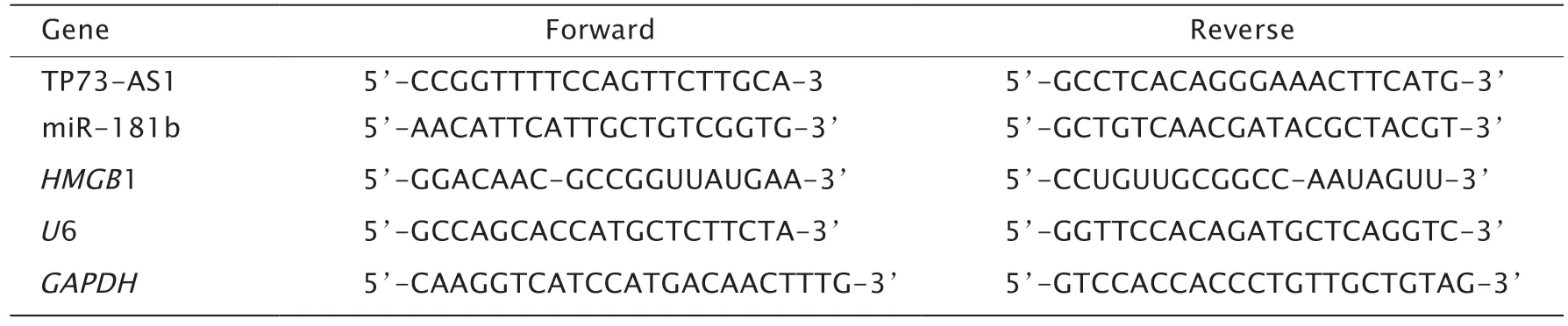
表1 引物序列Table 1 Primer sequence
1.5.3 FCM 法检测细胞凋亡率
取转染48 h 后处于对数生长期的细胞,用500 μL 预冷的1×结合缓冲液将细胞制成1×106个/mL 的悬液。随后加入5 μL 异硫氰酸荧光素标记的Annexin Ⅴ,混匀后孵育10 min;再加入2.5 μL PI,孵育5min。最后上流式细胞仪检测凋亡率。
1.5.4 Transwell 小室实验检测细胞的侵袭能力
首先在Transwell 小室上室中铺设基质胶,随后将各组对数生长期细胞接种于Transwell 小室24 孔板,以2×105个/mL 的密度将细胞加入上室(每孔100 μL),下室中加入含胎牛血清的培养液(250 μL/孔)。培养48 h 后取出小室,用棉签拭去微孔膜上室的细胞。用PBS 冲洗小室上下面2 遍,随后用多聚甲醛溶液固定黏附于下室微孔膜下面的细胞,再用结晶紫染色15 min,干燥后在光学显微镜下观察细胞形态(放大倍数为400 倍),并随机取3~5 个视野进行计数。
1.5.5 细胞划痕愈合实验检测细胞的迁移能力
取转染48 h 后处于对数生长期细胞,以5×104个/孔密度接种于6 孔板中,当细胞融合度达90%~100%时用无菌枪头进行划痕处理。首先吸去原培养液,然后用PBS 洗涤3 次,置于无血清培养液中继续培养24 h。在0 和24 h 时在光学显微镜下观察划痕的距离并拍照,划痕愈合率(%)=(0 h 划痕宽度—24 h 划痕宽度)/0 h划痕宽度×100%[10]。
1.6 双荧光素酶报告基因验证TP73-AS1、miR-181b 和HMGB1 基因间的靶向作用关系
采用双荧光素酶报告基因验证TP73-AS1 和miR-181b 间的靶向关系,将NC-mimics 和miR-181b-mimics 与构建获得的TP73-AS1-野生型(wild type,WT)(将TP73-AS1 针对候选靶基因miR-181b 3’-UTR 的靶序列插入到携带有荧光素有酶报告基因的载体中)和TP73-AS1-突变型(mutant type,MUT)(将突变后TP73-AS1针对候选靶基因miR-181b 3’-UTR 的靶序列插入到携带有荧光素有酶报告基因的载体中)两两组合后转入A549 细胞中,48 h 后检测各组细胞的荧光素酶活性。在A549 和NCI-H1299 细胞中分别转入shTP73-AS1 及其对照shNC,随后采用实时荧光定量PCR 检测miR-181b 的表达水平;实验流程同1.4 节。
采用双荧光素酶报告基因验证miR-181b和HMGB1 基因间的靶向关系,将NC-mimics和miR-181b-mimics 与构建获得的HMGB1 基因-WT(将HMGB1 基因针对候选靶基因miR-181b 3’-UTR 的靶序列插入到携带有荧光素有酶报告基因的载体中)和HMGB1-MUT(将突变后的HMGB1 基因针对候选靶基因miR-181b 3’-UTR 的靶序列插入到携带有荧光素有酶报告基因的载体中)两两组合后转入A549 细胞中,48 h 后检测各组细胞的荧光素酶活性。在A549 和NCI-H1299 细胞中分别转入miR-181binhibitor 及其对照NC-inhibitor,随后采用实时荧光定量PCR检测HMGB1 mRNA的表达水平;实验流程同1.4 节。
1.7 TP73-AS1 通 过miR-181b/HMGB1 轴对细胞增殖、侵袭、迁移和凋亡的影响
取A549 和NCI-H1299 细胞,实验分为4组:NC 组(不进行转染)、shTP73-AS1 组(仅转 入shRNA-TP73-AS1)、TP73-AS1 shRNA +miR-181b-inhibitor 组(同时转染shRNA-TP73-AS1 和miR-181b-inhibitor)、shRNA-TP73-AS1 +HMGB1 组(同时转染shRNA-TP73-AS1 和过表达重组载体pcDNA-HMGB1)。转染步骤同1.5.1 节。
收集转染48 h 后的各组细胞,采用实时荧光定量PCR 法检测细胞中HMGB1 mRNA 的表达水平,检测流程同1.4 节。采用蛋白印迹法检测细胞中HMGB1 蛋白的表达水平:收集转染48 h后的各组细胞,用RAPI 裂解液提取总蛋白,用BCA 试剂盒检测蛋白浓度,行10% SDS-PAGE分离蛋白,用半干转移法将蛋白转至PVDF 膜上。用含5%脱脂奶粉的封闭液封闭处理2 h,加入一抗[兔抗人HMGB1 和GAPDH(内参照)单克隆抗体(体积稀释比例为1 ∶1 000)]4 ℃孵育过夜;次日除去一抗,用TBST 缓冲液洗涤3 次后加入二抗[辣根过氧化物酶标记的羊抗兔IgG(体积稀释比例为1 ∶500)]处理1 h。最后用电化学发光试剂显影后对蛋白条带进行成像处理,用Image J 软件分析蛋白条带的灰度值。
收集转染48 h 后处于对数生长期的细胞,再分别采用CCK-8 法(检测流程同1.5.2 节)、FCM 法(检测流程同1.5.3 节)、Transwell 小室法(检测流程同1.5.4 节)和细胞划痕愈合实验(检测流程同1.5.5 节)检测细胞的增殖、凋亡、侵袭和迁移能力。
1.8 统计学方法

Fig.1 The expression level of long non-coding RNA (LncRNA) TP73-AS1 was detected by real-time fluorescence quantitative PCR.A:Expression level of TP73-AS1 in cancer and adjacent tissues was detected by real-time fluorescence quantitative PCR.**P<0.01;B:Correlation analysis of TP73-AS1 and miR-181b in cancer tissue;C:The overall survival rate curve of non-small cell lung cancer (NSCLC) patients with TP73-AS1 high expression or low expression was analysis by Kaplan-Merier method;D:The expression level of TP73-AS1 in human normal lung epithelial BEAS-2B cells and NSCLC A549 and NCI-H1299 cells was detected real-time fluorescence quantitative PCR .**P<0.01,vs BEAS-2B cells (n=5).图1 实时荧光定量PCR 法检测LncRNA TP73-AS1 在NSCLC 组织和细胞(A549 和NCI-H1299)中的表达水平并分析与miR-181b 的相关性
本研究中各项实验均独立重复5 次。采用SPSS 22.0 软件进行统计学分析,计量资料表示,2 组间比较用t检验或配对t检验;多组间比较用单因素方差分析,组内两两比较用LSD-t检验;2 组重复测量数据的比较用重复测量方差分析;生存分析采用log-rank 检验;相关性采用Pearson 相关性分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 TP73-AS1 在NSCLC 组织和细胞中的表达
实时荧光定量PCR 检测结果(图1A)提示,癌组织中TP73-AS1 的相对表达量为2.14±0.82,明显高于癌旁组织中的1.16±0.41,差异有统计学意义(P<0.01)。癌组织中miR-181b的相对表达量为0.66±0.25,miR-181b 与TP73-AS1 的表达呈负相关(r=-0.623,P<0.001,图1B)。以TP73-AS1 的中位表达量1.95 为临界值,将患者分为高表达组和低表达组,各为21 例。高表达组患者的总生存率明显低于低表达组(P=0.032,log-rank 检验,图1C)。
采用实时荧光定量PCR 检测人正常肺上皮细 胞BEAS-2B 和NSCLC A549 和NCI-H1299细胞中TP73-AS1 的表达水平。结果(图1D)显示,A549 和NCI-H1299 细胞TP73-AS1 的相对表达量分别为3.23±0.64 和2.86±0.77,均明显高于正常肺上皮BEAS-2B 细胞的1.01±0.21,差异有统计学意义(P<0.01)。
2.2 敲减TP73-AS1 表达对NSCLC 细胞增殖、侵袭、迁移和凋亡的影响
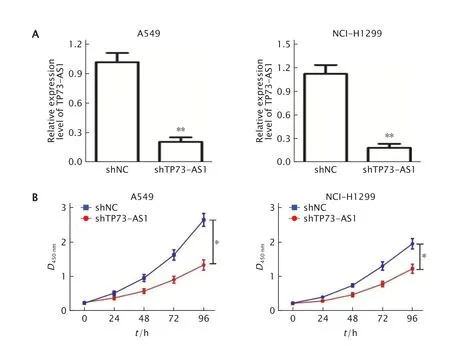
Fig.2 The effect of long non-coding RNA (LncRNA) TP73-AS1 knockdown on the proliferation of nonsmall cell lung cancer (NSCLC) A549 and NCI-H1299 cells.A:The expression level of TP73-AS1 in A549 and NCI-H1299 cells transfected with shRNA-TP73-AS1 (shTP73-AS1) or shRNA-negatice control(shNC) (as the control) was detected by real-time fluorescence quantitative PCR;B:The effect of TP73-AS1 knockdown on the proliferation of A549 and NCI-H1299 cells.*P<0.05,**P<0.01,vs shNC group (n=5).图2 采用实时荧光定量PCR 法检测转入shTP73-AS1 对A549 和NCI-H1299 细胞中TP73-AS1 表达水平的影响(A),以及敲除TP73-AS1 表达对A549 和NCI-H1299 细胞增殖的影响(B)
实时荧光定量PCR 检测结果(图2A)显示,与shNC 组相比,转入shTP73-AS1 后A549 和NCI-H1299 细胞TP73-AS1 表达水平明显降低(P值均<0.01)。A549 细胞中TP73-AS1 的表达量从1.02±0.21 下调至0.21±0.10,NCI-H1299 细胞中TP73-AS1 的表达量从1.13±0.25 下调至0.19±0.11。
CCK-8 法检测结果(图2B)显 示,敲降TP73-AS1 表达可以明显抑制A549 和NCI-H1299 细胞的增殖活力(P值均<0.05)。A549 细胞培养至第96 h 时,shRNA-NC 组和shTP73-AS1 组细胞的D450nm值分别为2.67±0.10 和1.23±0.09,而NCI-H1299 细胞分别为1.92±0.07 和1.13±0.07。

Fig.3 Effect of long non-coding RNA (LncRNA) TP73-AS1 knockdown on invasion (A,crystal violet staining,×100),migration (B,×100) and apoptosis rate (C) of A549 and NCI-H1299 cells transfected with shRNA-TP73-AS1 (shTP73-AS1) were detected by Transwell,Wound healing and FCM methods.A549 and NCI-H1299 cells were transfected with shRNA-negative control (shNC) as the control.**P<0.01,vs shNC group (n=5).图3 敲除TP73-AS1 表达对A549 和NCI-H1299 细胞侵袭(A)、迁移(B)和凋亡率(C)的影响
Transwell 小室法和划痕愈合实验检测结果(图3A 和图3B)显示,A549 细胞中shNC 组发生侵袭的细胞数为(189.32±65.02)个,迁移率为(42.12±11.03)%,均高于shTP73-AS1 组的(82.03±20.11)个 和(18.25±6.11)%(P值均<0.01);NCI-H1299 细胞中shNC 组发生侵袭的细胞数为(178.32±46.92)个,迁移率为(59.87±12.78)%,均高于shTP73-AS1 组的(71.00±24.63)个 和(35.65±11.34)%(P值均<0.01)。敲降TP73-AS1 可以明显抑制A549和NCI-H1299 细胞的侵袭和迁移能力。
FCM 法检测结果(图3C)显示,A549 细胞和NCI-H1299 细胞shNC 组的凋亡率分别为(7.11±1.05)% 和(11.02±1.34)%,均 低于shTP73-AS1组 的(23.05±6.34)% 和(26.98±4.32)%(P值均<0.01)。这一结果提示,敲低TP73-AS1 表达可以明显促进A549 和NCI-H1299 细胞的凋亡。
2.3 TP73-AS1 靶向调控miR-181b 进而介导HMGB1 在NSCLC 细胞中的表达
用Starbase 软件预测到miR-181b 可能是TP73-AS1 的靶基因(图4A)。双荧光素酶报告基因实验结果(图4B)显示,miR-181b-mimics +TP73-AS1-WT 可使荧光素酶活性下降(P<0.01)。实时荧光定量PCR 检测结果(图4C)显示,A549 和NCI-H1299 细胞中敲低TP73-AS1 表达后,miR-181b 的表达水平均被明显上调(P值均<0.01)。上述结果提示,miR-181b 是TP73-AS1 的靶基因。
用TargetScan 在线工具预测到HMGB1 是miR-181b 的候选靶基因(图4D)。双荧光素酶报告基因实验结果(图4E)显示,miR-181bmimics +HMGB1-WT 使荧光素酶活性下降(P<0.01)。实时荧光定量PCR 检测结果(图4F)显示,A549 和NCI-H1299 细胞中敲低miR-181b 表达后,HMGB1 mRNA 的表达水平均明显上调(P值均<0.01)。癌组织中miR-181b与HMGB1 mRNA的表达呈负相关(r=-0.697,P<0.01)。以上结果提示,HMGB1 是miR-181b 的靶基因。
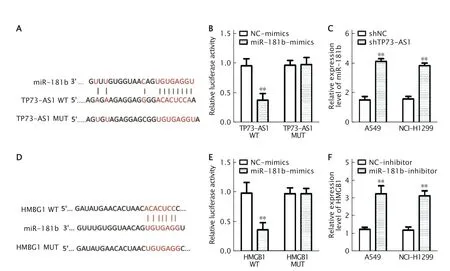
Fig.4 Analysis of targeted regulatory relationship between TP73-AS1 and miR-181b/high mobility group box-1 (HMGB1).A:The bioinformatics analysis result showed that TP73-AS1 had a binding site with miR-181b;B:Dual-luciferase reporter gene assay was used to analyse the relationship between TP73-AS1 and miR-181b;C:The expression level of miR-181b in A549and NCI-H1299 cells transfected with shRNA-TP73-AS1 (shTP73-AS1) or shRNA-negatice control (shNC) (as the control) was detected by real-time fluorescence quantitative PCR;D:The bioinformatics analysis result showed that miR-181b had a binding site with HMGB1;E:Dual-luciferase reporter gene assay was used to analyse the relationship between HMGB1 and miR-181b;F:The expressionlevelof HMGB1 mRNA in A549and NCI-H1299cells transfected with miR-181b-inhibitor or NC-inhibitor(asthe control) wasdetectedby real-time fluorescencequantitative PCR.**P<0.01,vs the controlgroups.图4 采用双荧光素酶报告基因验证TP73-AS1 与miR-181b,以及miR-181b 与HMGB1 基因间的的靶向调控关系
2.4 敲降TP73-AS1 通过上调miR-181b/HMGB1轴对NSCLC 细胞增殖、侵袭、迁移和凋亡的影响
实时荧光定量PCR(图5A)和蛋白质印迹法(图5B)检测结果显示,与对照组相比,敲低TP73-AS1 表达后可以明显抑制A549 和NCI-H1299 细胞中HMGB1 mRNA 和蛋白的表达水平(P值均<0.01)。同时,转染shTP73-AS1 +miR-181b-inhibitor 或 者shTP73-AS1 +HMGB1 过表达重组载体后,HMGB1 mRNA 和蛋白的表达水平均较shTP73-AS1 组明显上调(P值均<0.01)。
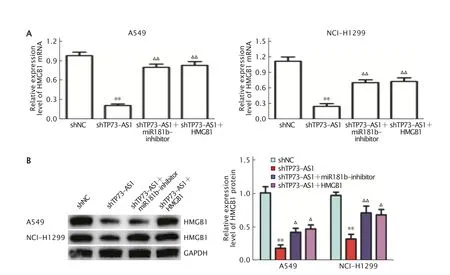
Fig.5 The expression level of high-mobility group box-1 (HMGB1) mRNA (A) and protein (B) in A549 cells and NCI-H1299 cells transfected with shRNA-TP73-AS1 (shTP73-AS1),shTP73-AS1+miR-181b-inhibitor or shTP73-AS1+pcDNA-HMGB1 (HMGB1 overexpression recombinant vector) were detected by real-time fluorescence quantitative PCR and Western blotting,respectively.A549 and NCI-H1299 cells were transfected with shRNAnegative control (shNC) as the control.**P<0.01,vs shNC group;△P<0.05,△△P<0.01,vs shTP73-AS1 group (n=5).图5 实时荧光定量PCR 法(A)及蛋白质印迹法(B)检测敲低TP73-AS 表达后再沉默miR-181b 表达或使HMGB1 过表达对A549 和NCI-H1299 细胞中HMGB1 mRNA 和蛋白表达水平的影响
CCK-8 法(图6A)、FCM 法(图6B)、Transwell小室实验(图6C)及划痕愈合实验(图6D)检测结果显示,敲低TP73-AS1 可明显抑制A549和NCI-H1299 细胞的增殖、侵袭和迁移能力,并促进细胞凋亡(P值均<0.05)。在A549 细胞中,shTP73-AS1 组转染后96 h 时D450nm值为0.98±0.05、侵袭细胞数为(76.25±23.01)个、细胞迁移率为(20.12±6.32)%、细胞凋亡率为(29.36±6.32)%;shTP73-AS1 +miR-181binhibitor 组D450nm值为1.67±0.06、侵袭细胞数为(175.26±34.01)个、细胞迁移率为(51.02±7.23)%和细胞凋亡率为(20.01±3.33)%,shTP73-AS1 +HMGB1 组D450nm值为1.83±0.05、侵袭细胞数为(170.69±27.91)个、细胞迁移率为(49.85±8.69)%和细胞凋亡率为(19.36±4.21)%。在NCI-H1299 细胞中shTP73-AS1 组转染后96 h时D450nm值为0.84±0.05、侵袭细胞数为(70.36±24.12)个、细胞迁移率为(18.36±9.34)% 和细胞凋亡率为(26.34±5.01)%,shTP73-AS1 +miR-181b-inhibitor 组D450nm值 为1.48±0.07、侵袭细胞数为(165.32±38.04)个、细胞迁移率为(51.36±6.85)% 和细胞凋亡率为(15.32±2.85)%,shTP73-AS1 +HMGB1 组D450nm值为1.36±0.05、侵袭细胞数为(170.39±44.28)个、细胞迁移率为(53.34±7.36)%和细胞凋亡率为(16.35±3.87)%。同时敲降miR-181b 或过表达HMGB1 则下调了敲降TP73-AS1 对A549 细胞和NCI-H1299 细胞的抑制作用(P<0.05)。以上结果说明,敲降TP73-AS1 可通过上调miR-181b/HMGB1 轴抑制癌细胞的增殖、侵袭和迁移,并促进凋亡。
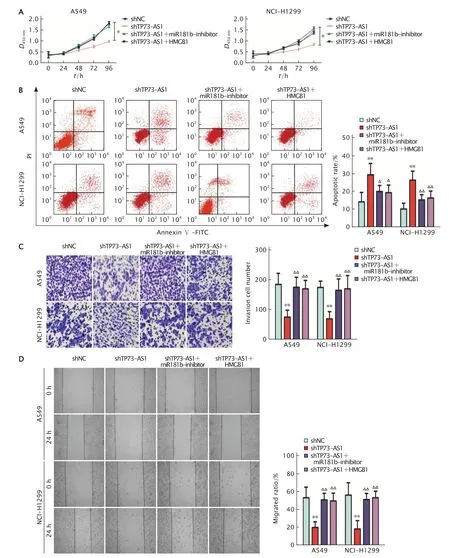
Fig.6 The cell proliferation (A),apoptosis rate (B),invasion (C) and migration (D) abilities of A549 and NCI-H1299 cells transfected with shRNA-TP73-AS1 (shTP73-AS1),shTP73-AS1+miR-181b-inhibitor or shTP73-AS1+pcDNA-HMGB1 (HMGB1 overexpression recombinant vector) were detected by CCK-8 method,FCM method,Transwell experiment (crystal violet staining,×400) and scratch healing experiment.A549 and NCI-H1299 cells were transfected with shRNA-negative control (shNC) as the control.**P<0.01,vs shNC group;△△P<0.01,vs shTP73-AS1 group (n=5).图6 CCK-8 法(A)、FCM 法(B)、Transwell 小室实验(C)和划痕愈合实验(D)检测敲低TP73-AS1 表达后再沉默miR-181b 表达或使HMGB1 过表达对A549 和NCI-H1299 细胞增殖、凋亡、侵袭及迁移能力的的影响
3 讨论
LncRNA 可以通过多种途径在肿瘤的发生和发展中发挥重要作用[11]。LncRNA 可作为一种竞争性内源性RNA 与miRNA 相互作用,参与靶基因的表达调控;反之,miRNA 可通过RNA诱导沉默复合物调控lncRNA 发挥生物学功能[8]。TP73-AS1 也被称为KIAA0495,位 于1p36 染色体上[12]。本研究发现,TP73-AS1 可以调控miR-181b/HMGB1 轴,进而影响NSCLC 细胞的增殖、侵袭、迁移和凋亡。
既往研究发现,TP73-AS1 在多种癌(膀胱癌、结直肠癌和乳腺癌)组织中表达水平升高,其可能通过Wnt/β-连环蛋白、晚期糖基化终产物受体信号通路和上皮-间质转化相关信号通路等促进肿瘤细胞的增殖、侵袭和迁移[12]。TP73-AS1在NSCLC 中的表达及意义既往少有报道。本研究发现,TP73-AS1 在NSCLC 癌组织和细胞中表达上调。TP73-AS1 与癌症患者的预后密切相关,ZHU 等[13]发 现,与NSCLC 组 织TP73-AS1 低表达患者相比,高表达患者的总体生存率较低,本研究结果与之一致。TP73-AS1 与肿瘤细胞的增殖、侵袭、迁移和凋亡密切相关[12]。本研究结果显示,敲低TP73-AS1 表达可以明显抑制A549 和NCI-H1299 细胞的增殖、侵袭和迁移能力,并促进细胞凋亡。以上结果提示,TP73-AS1 在NSCLC 中可能发促癌基因作用。
TP73-AS1 可通过调控miRNA 信号通路影响肿瘤细胞的生物学行为,如TP73-AS1 可以靶向miR-194-5p 调控SDAD1 基因的表达,促进胃癌细胞的增殖和转移[14];靶向miR-490-3p 调控TWIST1 基因的表达,促进三阴性乳腺癌组织中血管生成[6]。本研究中,采用生物信息学技术和双荧光素酶基因报告检测系统证实了TP73-AS1 与miR-181b 间的靶向关系。
既往研究发现,miR-181b 在NSCLC 癌组织和细胞中表达下调,发挥抑癌基因的作用;miR-181b 与NSCLC 发生、发展和患者预后密切相关[9,15]。HMGB1 是miR-181b 的靶基因,本研究中通过生物信息学技术和双荧光素酶基因报告系统证实了miR-181b 与HMGB1 基因的靶向调控关系。HMGB1 作为NSCLC 可能的生物学标志物已得到广泛研究,HMGB1 与NSCLC 患者的临床分期、组织分化程度、病理类型、淋巴结转移和耐药密切相关[16-17]。LIU等[18]发现,miR-181b 可以靶向调控HMGB1,上调miR-181b 表达可以抑制NSCLC 细胞的增殖和侵袭。
为了进一步证实TP73-AS1 通过miR-181b/HMGB1 轴在NSCLC 中的作用,本研究对A549 和NCI-H1299 细胞分别仅转染shTP73-AS1、同时转染shTP73-AS1 +miR-181binhibitor、同时转染shTP73-AS1 +HMGB1 过表达载体,结果显示转染shTP73-AS1 +miR-181b-inhibitor 或 者shTP73-AS1 +HMGB1 过表达载体后,HMGB1 mRNA 和蛋白的表达水平较仅转染shTP73-AS1 明显上调,细胞增殖、侵袭和迁移能力也明显升高,而凋亡水平明显下降。这一结果提示,TP73-AS1 可通过调控miR-181b/HMGB1 轴促进癌细胞增殖、侵袭、迁移,并促进细胞凋亡。既往也有研究发现,HMGB1与肿瘤细胞周期、上皮-间质转化、自噬和耐药等密切相关[19-22],但本研究未对此进行分析,需要未来深入探讨。
综上所述,TP73-AS1在NSCLC组织和细胞中高表达,可通过调控miR-181b/HMGB1轴促进癌细胞增殖、侵袭、迁移,并促进细胞凋亡。TP73-AS1有望为临床上治疗NSCLC提供一个潜在靶点,TP73-AS1在外周血中的表达及意义是本课题组今后研究的重点。
——一种基于空域亮度模型与形态学特征的方法

