错配修复基因hMSH2表达水平与上皮性卵巢癌患者的临床预后相关
滑 天 ,李 琰,李晓飞,孙海燕,陈 娟,康 山
上皮性卵巢癌(epithelial ovarian cancer,EOC)是女性生殖道常见的恶性肿瘤,死亡率占各类妇科肿瘤的首位[1]。由于缺乏早期症状,超过2/3患者确诊时已属晚期,5年生存率不超过40%[2]。肿瘤减灭术和以铂类为基础的化疗是晚期卵巢癌治疗的标准策略。然而,铂类耐药已经成为影响卵巢癌患者预后的重要因素。
铂类耐药是一个受多因素影响的复杂过程,其中个体DNA修复能力的改变是铂类耐药的重要分子基础。错配修复(mismatch repair,MMR)的主要功能包括维持基因组稳定性及保真性,并且参与化疗药物诱导DNA损伤应答,在肿瘤的发生及发展中发挥着重要的作用[3]。错配修复酶人类MutS同系物2(human MutS homolog 2,hMSH2)是MMR系统的核心基因[4]。早期研究表明,hMSH2基因缺陷或丢失与卵巢癌发生和对铂类药物的反应均具有密切的关系[5-6]。然而,有关hMSH2表达与EOC患者预后之间的关系仍不明确。本研究通过分析EOC组织中hMSH2 mRNA表达水平与患者临床病理特征及临床预后的关系,旨在探讨hMSH2表达是否能够成为EOC患者预后判断的分子标志物。
1 资料与方法
1.1 临床资料
选取河北医科大学第四医院2011年11月—2015年6月收治的150例EOC患者作为研究对象。病例纳入标准:(1)初治病例;(2)术前未进行任何治疗(新辅助化疗、生物治疗和放射治疗等);(3)手术方式采取规范的全面分期手术;(4)术后给予规范静脉化疗(紫杉醇联合顺铂或联合卡铂);(5)具有完整的临床资料;(6)具备随访条件。病例排除标准:(1)非初治病例;(2)术前给予其他治疗(新辅助化疗、生物治疗和放射治疗等);(3)手术方式不规范;(4)术后未给予规范化疗;(5)临床资料不完整;(6)转移性卵巢癌;(7)合并其他部位肿瘤。
患者年龄20~78岁,中位年龄56岁。按照国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准:Ⅰ期19例(12.66%),Ⅱ期9例(6.00%),Ⅲ期112例(74.67%),Ⅳ期10例(6.63%)。按照WHO分类法组织学类型:浆液性腺癌90例(60.00%),宫内膜样癌41例(27.33%),黏液性癌13例(8.67%),透明细胞癌6例(4.00%)。组织病理分级:高分化38例(25.33%),中分化67例(44.67%),低分化45例(30.00%)。术后辅助化疗情况:采用紫杉醇联合顺铂(静脉注射)方案者31例(20.71%),紫杉醇联合卡铂(静脉注射)方案者119例(79.39%);化疗完成3~4个疗程者21例(14.00%),6~8个疗程者97例(64.67%),8~10个疗程者32例(21.33%)。
术中获取组织标本,离体后迅速储存至RNA-later溶液中,4 ℃条件下处理过夜,随后置于-20 ℃冰箱保存以备提取RNA。本研究获得患者知情同意并通过河北医科大学第四医院医学伦理委员会批准。
1.2 试剂和仪器
TRIzol购自北京索莱宝生物有限公司;PCR引物购自生工生物工程(上海)股份有限公司;反转录试剂盒购自美国Thermo公司;实时荧光定量PCR试剂盒购自德国Qiagen公司。鼠抗人hMSH2单克隆抗体(EPR3943,ab92473)购自英国Abcam公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔鼠通用IgG、DAB修复液及SP免疫组织化学检测试剂盒购自武汉赛维尔生物科技有限公司。
PCR仪(Mx3005P)为美国Bio-Rad公司产品,光学显微镜为德国蔡司公司产品。
1.3 实时荧光定量PCR法检测EOC组织中hMSH2 mRNA的表达水平
按照TRIzol试剂说明书提取步骤提取150例EOC患者癌组织标本中的总RNA。按照反转录试剂盒说明书提供的操作步骤将提取的总RNA反转录为cDNA,以cDNA为模板,进行实时荧光定量PCR扩增;以GAPDH基因作为内参照,引物序列见表1。PCR扩增条件:94 ℃预变性 3 min;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 1 min,共30个循环;最后72 ℃延伸5 min。采用SYBR染料实时监测扩增产物的含量,实验重复3次。以公式2-ΔCt计算hMSH2基因的相对表达量,ΔCt=CthMSH2-CtGAPDH。
1.4 免疫组织化学法检测EOC组织中hMSH2蛋白的表达水平
从河北医科大学第四医院病理科收集上述150例中的86例EOC组织蜡块,进行切片(厚度为4 μm)并行HE染色。按照SP检测试剂盒说明书提供的步骤进行免疫组织化学法检测,一抗为鼠抗人hMSH2单克隆抗体(体积稀释比例为1∶2 000)。用已知阳性切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。结果判定,采取双盲方式评价染色结果。每张切片选择5个高倍镜下视野(放大倍数为200倍),分别按照阳色细胞所占百分比和染色强度计分。hMSH2蛋白以细胞核内呈现棕黄色颗粒为阳性显色,按阳性细胞所占百分比进行计分:无阳性细胞为0分,阳性细胞所占百分比<10%为1分,10%~50%为2分,51%~80%为3分,>81%为4分;按细胞着色强度:无着色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分。2项评分相乘≥4分定义为hMSH2蛋白高表达,<4分定义为hMSH2蛋白低表达[7]。

表1 hMSH2及GAPDH基因引物序列Table 1 The primer sequences of human MutS homolog 2 (hMSH2) and GAPDH genes
1.5 随访资料
所有研究对象均于手术后开始规律随访,采用门诊随访及电话随访,平均4~6个月1次。随访截止日期为2018年6月1日。预后评价指标为总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)。OS是指以手术日期至死亡或随访截止日期计算,PFS是指以手术日期至疾病进展日期计算。中途失访者12例,终止时间为最后1次随访时间,均纳入生存分析。
1.6 统计学方法
采用SPSS 21.0统计学软件对获得研究数据进行统计学分析。hMSH2表达与EOC患者临床病理参数之间的相关性分析用χ2检验;Wilcoxon秩和检验比较铂耐药组患者和铂敏感组患者肿瘤组织中hMSH2 mRNA表达水平的差异;Kaplan-Meier法进行单因素分析单变量分析,用log-rank检验生存率差异,GraphPad 5绘制生存曲线。多因素分析采用COX回归模型进一步分析预后相关因素。采用Spearman相关性分析hMSH2 mRNA和蛋白表达的相关性。以P<0.05表示差异有统计学意义。
2 结果
2.1 hMSH2 mRNA在EOC患者癌组织中的表达水平
采用实时荧光定量PCR法检测150例EOC患者肿瘤组织中hMSH2 mRNA的表达水平。结果(图1)显示,hMSH2 mRNA相对表达量的中位值为0.024 8。
2.2 hMSH2蛋白在EOC患者癌组织中的表达水平
采用免疫组织化学法检测86例EOC患者肿瘤组织中hMSH2蛋白的表达水平。结果显示,hMSH2蛋白定位于细胞核内。hMSH2蛋白阳性表达率为90.69%,阴性表达率为9.31%。hMSH2蛋白在EOC肿瘤组织中的表达见图2。
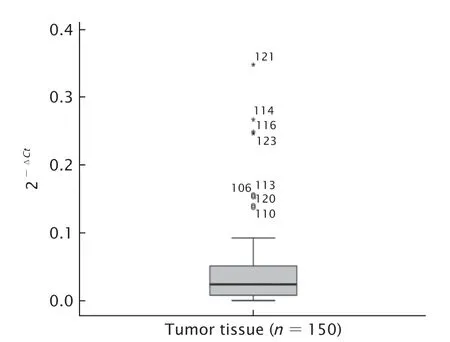
Fig.1 The expression level of human MutS homolog 2 (hMSH2) mRNA in the tumor tissues of 150 patients with epithelial ovarian cancer (EOC) was detected by real-time fluorescent quantitative PCR.图1 实时荧光定量PCR法检测150例患者EOC组织中hMSH2 mRNA的表达水平
2.3 hMSH2 mRNA与蛋白表达之间的关系
采用Spearman分析hMSH2 mRNA表达水平与蛋白表达水平的相关性。结果显示,hMSH2 mRNA表达水平与蛋白表达呈正相关(P=0.024,r=0.517)。
2.4 hMSH2 mRNA表达与EOC患者临床病理特征的关系
依据hMSH2 mRNA表达水平的中位值将150例EOC患者分为高表达组和低表达组。结果(表2)显示,hMSH2 mRNA表达水平与临床分期、肿瘤组织学分级以及淋巴结转移密切相关(P值均<0.05),而与EOC患者年龄、肿瘤病理学类型、肿物大小及是否存在腹腔积液无关(P值均>0.05)。此外,χ2趋势性检验表明,hMSH2 mRNA表达水平存在随着肿瘤组织学分级升高而逐渐下降的趋势。
2.5 hMSH2 mRNA表达水平与EOC患者铂类药物耐药的关系
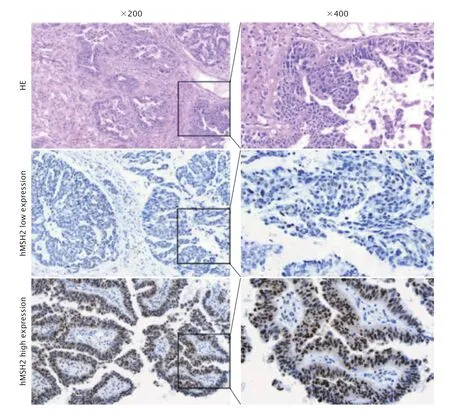
Fig.2 The hematoxylin-eosin (HE) staining of epithelial ovarian cancer (EOC) tissue;the expression of human MutS homolog 2 (hMSH2) protein in EOC tissues was detected by immunohistochemistry (DAB staining,×200,×400).图2 EOC组织的HE染色结果以及免疫组织化学法检测hMSH2蛋白在EOC组织中的表达情况(DAB,×200和×400)
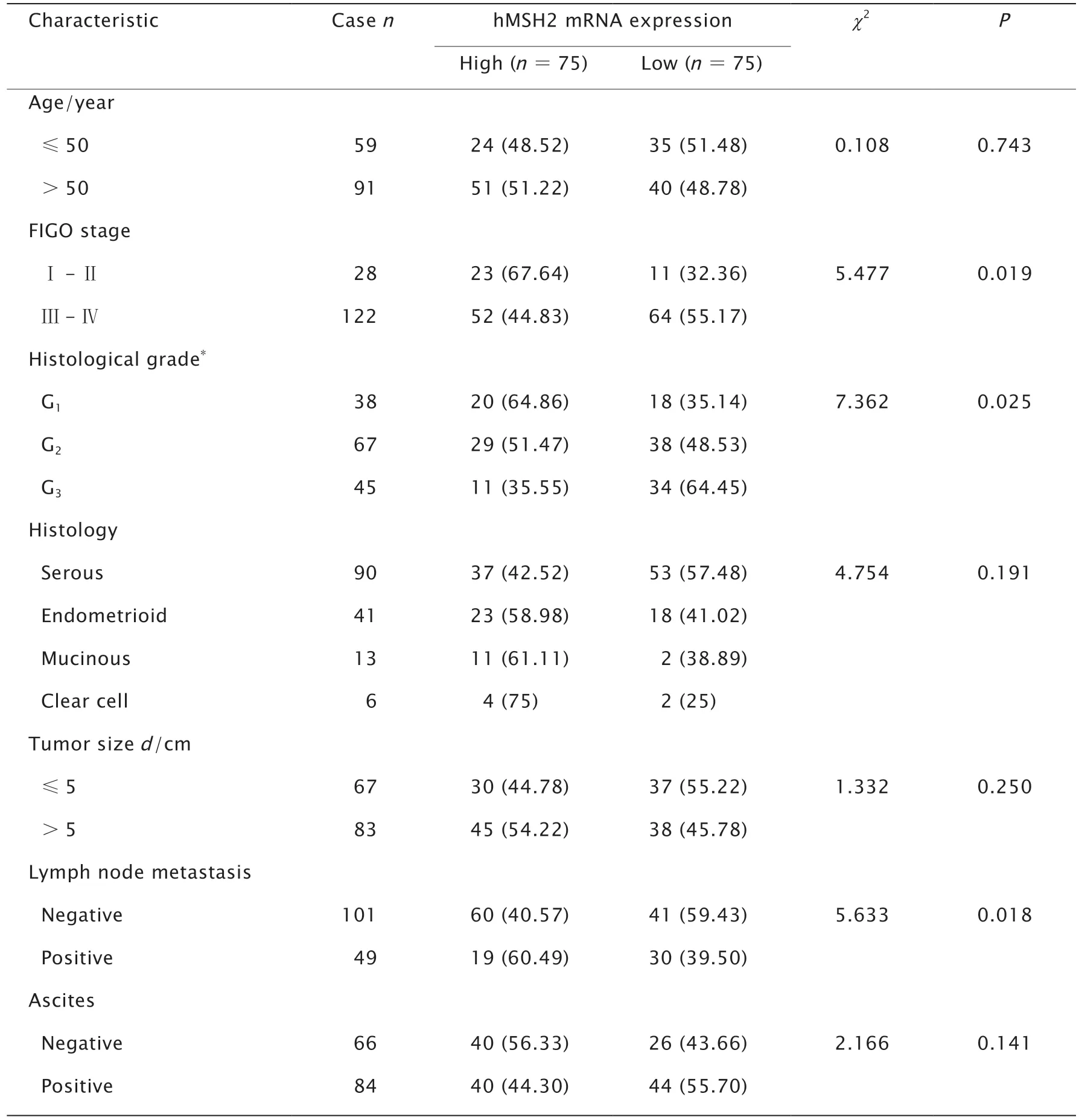
表2 hMSH2 mRNA表达与EOC患者临床病理特征的关系Table 2 Correlations between the human MutS homolog 2 (hMSH2) mRNA and clinicopathological factors of epithelial ovarian cancer patientsn (%)
依据2011年妇科肿瘤协作组(Gynecologic Cancer Inter Group,GCIC)[8]提出的根据无铂间期(platinum-free interval,PFI),即最后一次含铂治疗后的PFS时间,将患者人群分为铂耐药组(最后一次含铂化疗后1~6个月即出现进展的患者)和铂敏感组(最后一次含铂化疗后6~12个月时出现进展的患者)。将150例研究对象分为铂类耐药组(60例)和铂类敏感组(90例),实时荧光定量PCR检测结果(图3)显示,铂耐药组中hMSH2 mRNA的表达水平明显低于铂敏感组,差异具有统计学意义(P=0.002)。
2.6 hMSH2 mRNA表达水平与EOC患者临床预后的关系
本研究对150例EOC患者进行了随访,随访率为92%。以hMSH2 mRNA相对表达量的中位值设置为临界值,将150例EOC患者分为hMSH2 mRNA高表达组(75例)及低表达组(75例)。采用Log-rank检验和Kaplan-Meier分析方法计算hMSH2 mRNA表达水平对患者PFS及OS的影响。Log-rank检验结果(图4)显示,hMSH2 mRNA低表达患者的PFS明显低于高表达组(P=0.011),hMSH2 mRNA低表达组患者OS明显低于高表达组患者(P=0.007)。
单因素分析结果(表3)显示,FIGO分期、初次手术残留病灶大小及hMSH2 mRNA表达水平均与EOC患者预后相关(P<0.05)。将FIGO分期、手术残余病灶大小及hMSH2 mRNA表达水平纳入COX回归模型,结果显示hMSH2 mRNA表达是预测EOC患者生存时间的独立危险因素[风险比(hazard ratio,HR)=1.91,95%可信区间(confidence interval,CI)为1.85~2.31,P=0.033]。以上结果提示hMSH2 mRNA低表达可能与EOC患者的不良预后相关。
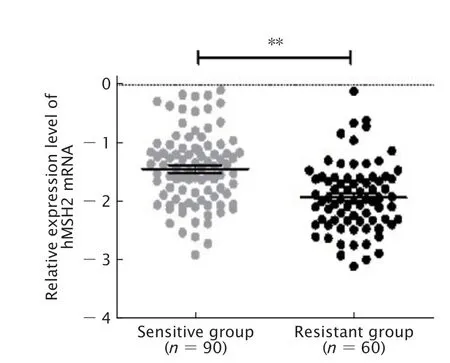
Fig.3 The comparison of human MutS homolog 2 (hMSH2) mRNA expression level between platinumresistant epithelial ovarian cancer (EOC) tissues and platinum-sensitive EOC tissues.**P<0.01.图3 EOC铂类耐药和铂类敏感患者癌组织中hMSH2 mRNA表达水平的比较
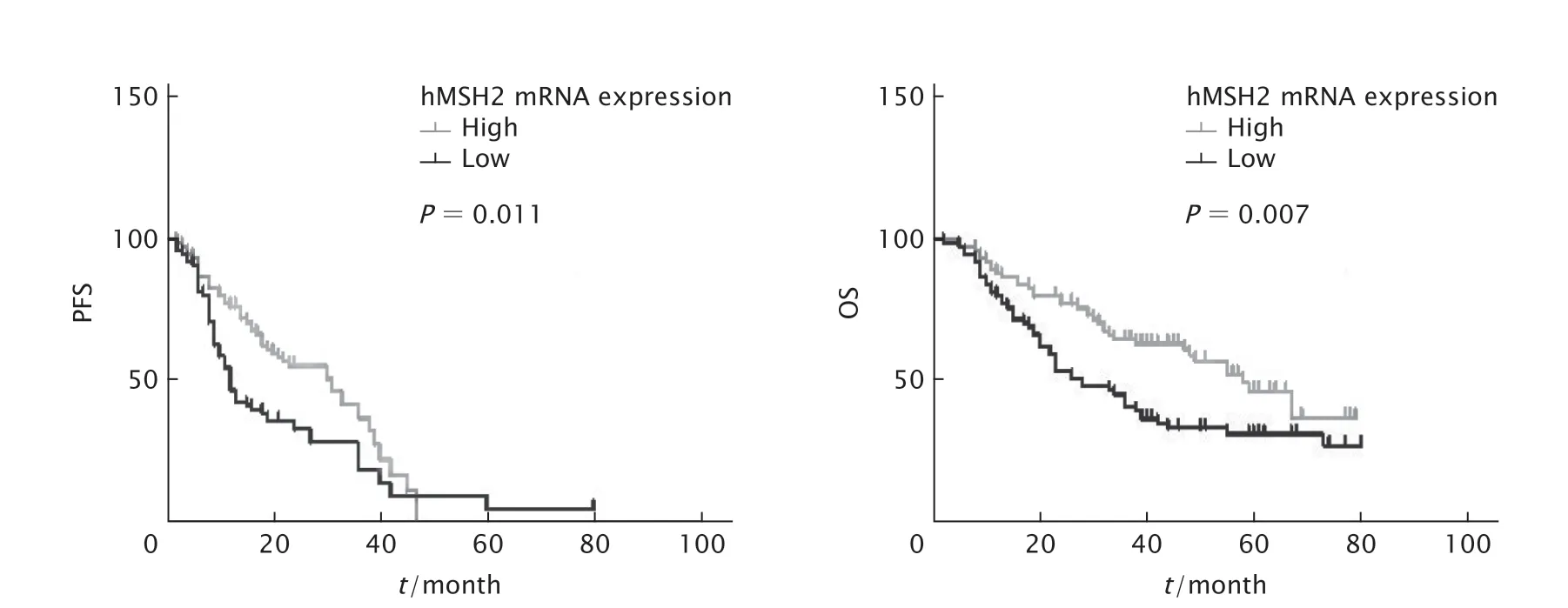
Fig.4 Kaplan-meier analysis of the relationship between human MutS homolog 2 (hMSH2) mRNA expression level and progression free survival (PFS) and overall survival (OS) in epithelial ovarian cancer(EOC) patients.图4 Kaplan-Meier分析hMSH2 mRNA表达与EOC患者PFS以及OS的关系
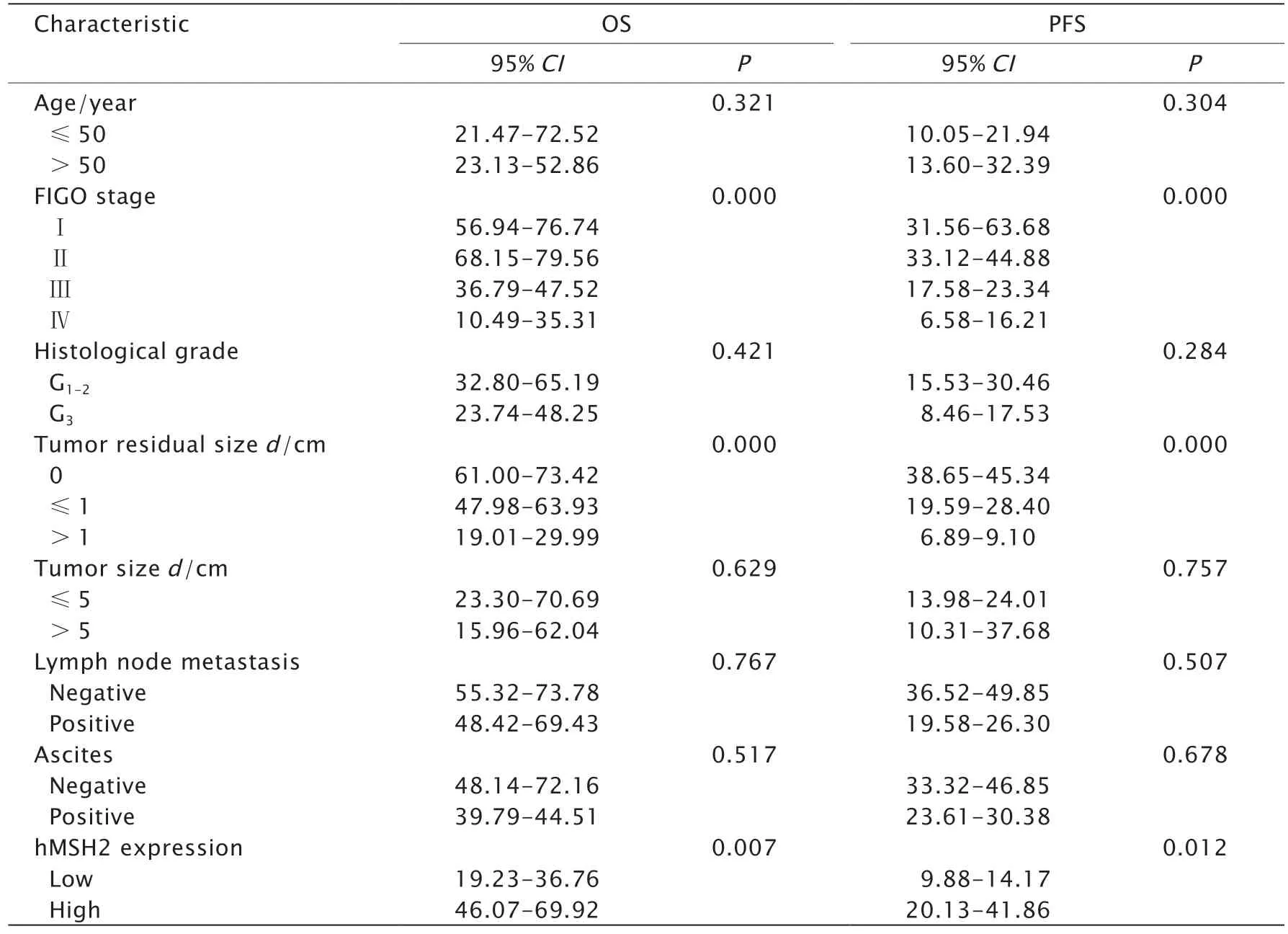
表3 影响EOC预后的单因素分析结果Table 3 Univariate analysis of prognosis in patients with epithelial ovarian cancer (EOC)
3 讨论
目前,晚期EOC的标准治疗方案是肿瘤减灭术和以铂类药物为主的辅助化疗。尽管大多数患者对最初的治疗有应答,但70%的患者最终会出现复发,且产生铂类耐药。铂类药物的作用机制是与肿瘤细胞的DNA形成pt-DNA加合物,从而介导肿瘤细胞坏死或凋亡。既往的研究表明,hMSH2在铂类抗肿瘤药物机制中起着重要作用。在铂类化合物进入肿瘤细胞后与DNA形成pt-DNA加合物时hMSH2与hMSH6形成复合体识别其加合物,继而招募凋亡相关蛋白激活凋亡通路,引发肿瘤细胞凋亡[9-10]。hMSH2功能缺陷将直接影响细胞识别DNA损伤和激活凋亡的能力,肿瘤细胞将忽略铂类药物导致的DNA损伤而继续进行DNA复制,使得药物失去诱导细胞凋亡的作用,发生耐药[11]。舒丹等[12]在体外研究中均发现,在卵巢癌顺铂耐药细胞株中hMSH2表达明显下调。本实验在临床样本中同样证实,铂耐药患者肿瘤组织与铂敏感肿瘤组织相比,hMSH2 mRNA呈现明显的低表达状态。上述结果提示,hMSH2基因的表达缺陷可能与卵巢癌患者的铂类耐药相关。
本研究中进一步采用生存分析模型探讨了150例EOC癌组织中hMSH2 mRNA表达水平与患者临床预后的关系。结果表明,hMSH2低表达的患者PFS和OS期均明显缩短。既往研究显示hMSH2表达在卵巢癌患者中的预后意义并不明确。一项纳入102例EOC患者的研究表明,癌组织中hMSH2蛋白阳性表达是提示卵巢癌患者预后良好的指标[13]。然而,SAMIMI等[14]分析了54例卵巢癌组织hMSH2蛋白的表达,发现其与患者生存之间没有明显关联。本研究结果显示,hMSH2表达下降促使铂类耐药发生可能是导致EOC不良临床结局的原因之一。在膀胱癌的研究中指出对于接受铂类药物治疗的患者,hMSH2低蛋白与较低的存活率相关,在未接受化疗的患者中hMSH2蛋白水平与生存之间并无关联[15]。因此,hMSH2表达在未进行铂化疗患者中是否具有一致的预后意义仍需要进一步的研究。此外,本研究发现EOC患者癌组织中hMSH2 mRNA表达水平随着FIGO分期增高表达量而下降,随着肿瘤组织学分级增加而下降,伴有淋巴结转移的患者表达量低于未转移者,均表明hMSH2表达下调可能与EOC患者不良的临床结局相关。
综上所述,hMSH2 mRNA表达下降与患者铂耐药以及不良预后密切相关,而且hMSH2 mRNA表达是预测EOC患者OS的独立危险因素。基于既往研究中不一致的结论,本研究结果可能有助于阐明一些先前的矛盾意见,但仍需要将来多中心研究进一步验证。此外,hMSH2 mRNA表达水平与FIGO分期、肿瘤组织学分级和淋巴结转移具有密切相关性,间接证实hMSH2 mRNA低表达对于患者不良临床结局的预测价值。

