芝麻素对人外周血中γδ T细胞体外增殖及杀伤胃癌细胞株BCG-823作用的影响▲
王增慧 张传祯 吴 倩 刘 焕 汤琳琳 胡 超 冯均军 陈复兴 周忠海 朱 云
(1 徐州医科大学附属淮海医院消化内科,江苏省徐州市 221004,电子邮箱:wang97yy@163.com;中国人民解放军陆军第七十一集团军医院2 消化内科,3 麻醉科,4 检验-病理科,江苏省徐州市 221004)
芝麻素是天然的木脂类化合物,在芝麻油和芝麻种子中含量均较高,其药理作用十分广泛,如抗氧化、稳定血压、调节血脂、保护肝脏及抑制肿瘤生长等[1-2]。日本东京大学医学院所开展的研究证实芝麻素具有抗肿瘤的功效,低浓度的芝麻素饮食可能对肝癌有抑制作用[3],国内也有研究证实芝麻素对肝癌细胞的增殖具有抑制作用[4-5]。近年来,γδ T细胞在抗肿瘤方面的作用逐渐受到国内外学者们的广泛关注,其主要分布在黏膜及上皮组织内,主要通过主要组织相容性复合物以非限制性方式,以及通过其固有免疫和适应性免疫的辅助作用,来识别及杀伤肿瘤细胞[6-8]。提高γδ T细胞的增殖率及增强其功能,有利于更有效地将γδ T细胞应用于生物学研究以及发挥其临床抗肿瘤作用。因此,本研究探讨芝麻素对人外周血中γδ T细胞体外增殖及杀伤胃癌细胞株BCG-823作用的影响。
1 材料和方法
1.1 实验材料 GT-T551无血清培养基(日本TAKARA公司,批号:AK2P027);淋巴细胞分离液(中国科学院血液病研究所,批号:LTS1077);芝麻素(Sigma公司,批号:#028M4099V);人胃癌细胞株BCG-823(中国科学院上海细胞库,编号:BNO0102269);胰蛋白酶(Gibco公司,批号:011020200528);重组人白细胞介素(interleukin,IL)-2(双鹭药业,批号:S19991007);异戊烯焦磷酸(美国Sigma-Aldrich公司,批号:SLCB2751);流式细胞仪(美国BD公司,型号:BD-FACSCalibur);酶标仪(上海科华实验系统有限公司,型号:ST-360);贝克曼自动生化分析仪(美国贝克曼,型号:AU680);细胞计数检测(cell counting kit-8,CCK-8)试剂(上海碧云天生物技术公司,批号:010919190408);γδ T细胞抗体(美国BD公司,批号:6029567); 穿孔素单抗(eBioscience公司,批号:E020894)、颗粒酶B单抗(eBioscience公司,批号E106781638)、CD107a单抗(eBioscience公司,批号:B181677)、Fix&Perm破膜剂(eBioscience公司,批号:749349340);乳酸脱氢酶试剂 (宁波普瑞柏生物技术公司,批号:LD0359)。
1.2 实验方法
1.2.1 γδ T细胞的培养及表型鉴定:取5名健康男性志愿者(平均年龄为35周岁)外周血各100 mL,肝素抗凝,各取100 μL抗凝血采用异硫氰酸荧光素标记的γδ T细胞抗体进行标记,用流式细胞仪检测γδ T细胞的表型。剩下的抗凝血分别采用淋巴细胞分离液分离后吸取单个核细胞层,加入50 mL磷酸缓冲盐溶液洗涤1遍后,室温下1 500 r/min离心5 min,弃去上清,沉淀即为获得的外周血单个核细胞,将加入GT-T551无血清培养基(含诱导γδ T细胞的细胞因子,购自美国Sigma公司)中,调整细胞浓度为1×108个/mL,放入培养瓶后置于37℃、5% CO2培养箱中,每天观察γδ T细胞生长情况并适量补充培养基;培养10 d后,收集部分γδ T细胞,室温下1 500 r/min离心5 min,磷酸缓冲盐溶液洗涤2遍,用异硫氰酸荧光素标记的γδ T细胞抗体进行标记,用流式细胞仪检测γδ T细胞的表型;当γδ T细胞的表型百分率达到80%以上时方可继续采用此细胞进行以下实验。
1.2.2 胃癌细胞株的培养:从液氮中取出BCG-823胃癌细胞株,经复苏后接种于GT-T551无血清培养基中,置于37℃、5% CO2培养箱中,每天观察BCG-823胃癌细胞生长情况并适量补充培养基。
1.2.3 CCK-8法检测γδ T细胞的增殖情况:取培养10 d且生长状态较好的γδ T细胞接种于96孔板中,每孔培养基200 μL,调整细胞密度为1×105个/孔,加入2 μL不同浓度(浓度分别为0 μg/mL、0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL、10.000 μg/mL、20.000 μg/mL、40.000 μg/mL、80.000 μg/mL、100.000 μg/mL)的芝麻素诱导,设未加细胞及芝麻素组为空白组,0 μg/mL芝麻素为对照组,其余各浓度芝麻素组为实验组。每个浓度设5个复孔。37℃、5% CO2培养箱中孵育48 h后,每孔加入20 μL CCK-8液,置于37℃、5% CO2培养箱中孵育4~6 h后,测定490 nm波长下各孔的吸光度值,计算细胞增殖率。增殖率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
1.2.4 流式细胞仪检测γδ T细胞中颗粒酶B、穿孔素、CD107a的表达:取培养10 d的γδ T细胞接种于6孔板中,1×108个/孔,选取增殖效果较好的芝麻素浓度(浓度分别为0.156 μg/mL、0.313 g/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL)进行诱导,每个浓度设3个复孔,继续于37℃、5% CO2培养箱中孵育48 h,收集细胞,用磷酸缓冲盐溶液洗涤后室温下1 500 r/min离心5 min,重复2遍,每管分别加入异硫氰酸荧光素标记的γδ T抗体、颗粒酶B单抗、穿孔素单抗、CD107a单抗 ,室温下避光孵育15 min,磷酸缓冲盐溶液洗涤后室温下1 500 r/min离心5 min,重复2遍,用流式细胞仪检测γδ T细胞中颗粒酶B、穿孔素、CD107a的表达水平。
1.2.5 乳酸脱氢酶释放法检测γδ T细胞的杀伤活性:以对数生长期的BCG-823细胞株作为靶细胞,以经不同浓度(分别为0 μg/mL、0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、 5.000 μg/mL、10.000 μg/mL)芝麻素诱导且在37℃、5% CO2培养箱中孵育48 h后的γδ T细胞为效应细胞,其中0 μg/mL的芝麻素为对照组。调整靶细胞浓度为2×105个/mL,调整效应细胞浓度为2×106个/mL,将效靶细胞按体积比为10 ∶1比例混合置于试管中,每个浓度设3个复管。500 r/min离心3 min后置于37℃、5% CO2培养箱中孵育6 h,1 500 r/min离心10 min,吸取上清液,加入乳酸脱氢酶试剂后在生化分析仪上测定各管上清液的活性单位,计算γδ T细胞的杀伤活性。设经各浓度芝麻素诱导后的γδ T细胞与BCG-823细胞混合的试管为测定管,只加BCG-823细胞与培养基的试管为靶细胞自然释放管,只加γδ T细胞和培养基的试管为效应细胞自然释放管,BCG-823细胞与乙基苯基聚乙二醇溶液按体积比为10 ∶1混合的试管为靶细胞最大释放管。γδ T细胞的杀伤活性=(测定管活性单位-效应细胞自然释放管)/(靶细胞最大释放管-靶细胞自然释放管)×100%。
1.3 统计学分析 采用SPSS 16.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 γδ T细胞表型鉴定 培养前外周血中γδ T细胞百分率约为6.14%,培养10 d后外周血中γδ T细胞百分率高达90.34%,见图1。

培养前 培养10 d后
2.2 不同浓度芝麻素对γδ T细胞增殖的影响 与对照组相比,0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素组的γδ T细胞增殖率均升高(P<0.05),当芝麻素浓度为1.250 μg/mL时γδ T细胞增殖率最高;而当芝麻素浓度达到5.000 μg/mL以上时,对γδ T细胞的生长起抑制作用。见表1。

表1 不同浓度芝麻素对γδ T细胞增殖率的影响(x±s,%)
2.3 不同浓度芝麻素对γδ T细胞中颗粒酶B、穿孔素和CD107a表达的影响 0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素组γδ T细胞的颗粒酶B表达水平均高于对照组(均P<0.05),2.500 μg/mL芝麻组的表达水平最高。0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素组γδ T细胞的穿孔素表达水平均高于对照组(均P<0.05),2.500 μg/mL芝麻组的表达水平最高。0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素组 γδ T细胞的CD107a表达水平均高于对照组(均P<0.05)。见表2。

表2 不同浓度芝麻素作用48 h后γδ T细胞中颗粒酶B、穿孔素及CD107a的表达水平(x±s,%)
2.4 不同浓度芝麻作用后γδ T细胞对胃癌细胞BCG-823的杀伤活性 0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL芝麻素作用48 h后,γδ T细胞对胃癌细胞BCG-823的杀伤活性均高于对照组(均P<0.05),且在芝麻素浓度为2.500 μg/mL时对胃癌细胞BCG-823的杀伤活性最高,见表3。
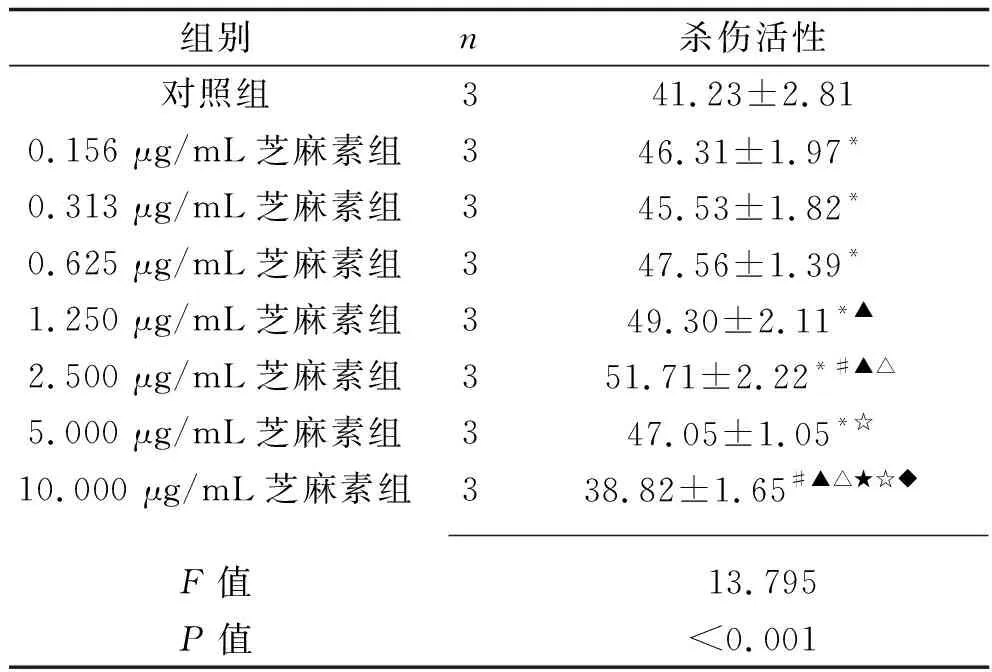
表3 不同浓度芝麻素作用后γδ T细胞对胃癌细胞BCG-823的杀伤活性(x±s,%)
3 讨 论
研究证实,芝麻素具有抗氧化、清除自由基、改善脂代谢、降压降糖、抗癌、杀菌、免疫调节、保肝护肾及神经保护等功效[9-11]。近年来,国内外研究均显示芝麻素具有抗肿瘤特性,其可通过抑制肿瘤细胞的增殖,引起肿瘤细胞周期阻滞,触发肿瘤细胞凋亡[6,12-15]。凋亡是由基因调控下游死亡信号诱发的细胞主动程序性死亡,而芝麻素可能通过激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-3、Caspase-8和Caspase-9等通路,诱导肿瘤细胞凋亡[16-17]。
γδ T细胞是存在于人体黏膜组织的固有免疫细胞,具有免疫调节的功能及非特异性免疫的特性,对于人体维持免疫稳态具有重要作用[18]。随着细胞体外培养技术的成熟,γδ T细胞可单独使用,或者与其他免疫细胞如记忆T细胞、树突状细胞、自然杀伤细胞等联合应用治疗多种肿瘤,且具有较好的疗效[7,19]。γδ T细胞主要是通过主要组织相容性复合物,以非限制性的形式特异性识别肿瘤抗原,并释放颗粒酶、穿孔素来杀伤肿瘤细胞[20]。γδ T细胞还可以通过自然杀伤细胞2族成员D与其配体的相互作用,杀伤具有相应配体的肿瘤细胞[20]。此外,γδ T细胞还可通过穿孔素-颗粒酶途径、Fas/Fas配体途径,以及分泌肿瘤坏死因子α、γ-干扰素、IL-12等细胞因子,来发挥其抗肿瘤作用[21]。
学者们在如何提高γδ T细胞的体外培养细胞数量和增强其杀伤功能方面进行了很多研究,证实了IL-15、IL-21、CD28单克隆抗体等生物制剂和一些中药单体成分可以增强γδ T细胞体外培养的扩增效率及其抗肿瘤细胞毒活性[22-23]。芝麻素是一种木脂类中药单体成分,但将其应用于体外诱导扩增γδ T细胞以及免疫治疗,未见有研究报告。本研究结果显示,与对照组相比,0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素组的γδ T细胞增殖率均升高(P<0.05),而当芝麻素浓度大于5.000 μg/mL时,对γδ T细胞的生长起抑制作用,提示适当浓度的芝麻素对γδ T细胞的增殖有促进作用,这为将芝麻素作为γδ T细胞免疫调节剂提供了实验依据。
本研究结果显示,0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素组γδ T细胞的颗粒酶B表达水平均高于对照组(P<0.05);0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素组γδ T细胞的穿孔素表达水平均高于对照组(P<0.05);0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素组 γδ T细胞的CD107a表达水平均高于对照组(P<0.05);0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL芝麻素作用48 h后γδ T细胞对胃癌细胞BCG-823的杀伤活性均高于对照组(P<0.05),提示适宜浓度的芝麻素可能通过上调γδ T细胞中颗粒酶B-穿孔素通路及CD107a的表达,来增强其对肿瘤细胞杀伤活性。
综上所述,采用适宜浓度的芝麻素诱导人外周血γδ T细胞,可提高γδ T细胞的增殖率及杀伤胃癌细胞BCG-823的功能,机制可能与其上调γδ T细胞的颗粒酶B-穿孔通路和CD107a的表达有关。

