核型多角体病毒侵染及其与宿主免疫系统互作的研究进展
黄 博,朱梦瑶,丘霈珊,张若男,张文庆,余小强,卢玉珍*
(1. 华南师范大学生命科学学院,广东省昆虫发育生物学与应用技术重点实验室,广州 510631;2. 中山大学有害生物控制与资源利用国家重点实验室,广州 510275;3. 华中师范大学生命科学学院,武汉 430079)
杆状病毒(baculovirus)是具有囊膜包裹的双链环状DNA病毒,基因组大小为80~180 kb,只专一性感染昆虫,主要以鳞翅目、双翅目和膜翅目昆虫为宿主(Langeetal., 2004;Harrisonetal., 2018)。杆状病毒包括核型多角体病毒(nucleopolyhedrovirus, NPV)和颗粒体病毒(granulovirus, GV),其中NPV能在细胞核内形成截面约为0.6~2 μm的多面型包涵体(occlusion body, OB),又名多角体(polyhedron)。杆状病毒在感染周期可以产生两种物理形态和结构不同的病毒粒子:包埋型病毒粒子(occlusion-derived virus, ODV)和芽生型病毒粒子(budded virus, BV)。环境中的NPV病毒以包涵体/多角体的形式存在,ODV包埋于包涵体蛋白晶体中。包涵体内包埋多个ODV,一个ODV囊膜中存在单个或多个核衣壳,如家蚕核多角体病毒Bombyxmorinucleopolyhedrovirus(BmNPV)属于单粒包埋核多角体病毒,苜蓿银纹夜蛾核型多角体病毒Autographacalifornicamultiple nucleopolyhedrovirus(AcMNPV)属于多粒包埋核多角体病毒。包涵体在自然环境中非常稳定,可以长期保护ODV的活性。
目前已有100多种杆状病毒完成基因组测序,基于进化树、宿主以及病毒粒子包埋等信息,可将NPV划分为四个属:α-杆状病毒属(鳞翅目特异NPVs)、β-杆状病毒属(鳞翅目特异GVs)、γ-杆状病毒属(膜翅目特异NPVs)和δ-杆状病毒属(双翅目特异NPVs)(Jehleetal., 2006; Williamsetal., 2017)。其中,α-杆状病毒的研究最为透彻,包括AcMNPV、BmNPV、黄杉毒蛾核多角体病毒Orgyiapseudotsugatamultiple nucleopolyhedrovirus(OpMNPV)、甜菜夜蛾核型多角体病毒Spodopteraexiguamultiple nucleopolyhedrovirus(SeMNPV)和棉铃虫核型多角体病毒Helicoverpaarmigerasingle nucleopolyhedrovirus(HaSNPV)等。根据BV病毒粒子囊膜上的膜融合蛋白差异,α-杆状病毒可分为两个类群:利用glycoprotein 64(GP64)作为BV膜融合蛋白的Group I NPVs,包括AcMNPV、BmNPV等;以F蛋白(fusion protein)为膜融合蛋白的Group II NPVs,包括SeMNPV、HaSNPV等。本文将重点介绍鳞翅目昆虫与核型多角体病毒的互作研究。
1 核型多角体病毒生活史
当昆虫取食被包涵体污染的食物后,包涵体进入中肠并在碱性的肠道中被蛋白酶溶解,释放出ODV(图1)。ODV穿过中肠围食膜,其囊膜与中肠上皮细胞微绒毛膜融合之后,核衣壳侵入中肠柱状上皮细胞,形成初级感染(primary infection)。随后,部分病毒核衣壳可以直接从中肠上皮细胞的基底膜上出芽释放,快速形成少量的BV;另一部分核衣壳则进入细胞核并解聚释放病毒基因组,调控病毒基因的表达、病毒基因组DNA的复制和结构蛋白合成。子代核衣壳在病毒发生基质(virogenic stroma, VS)中形成后通过核膜出芽进入细胞质,而后脱去从核膜获得的包膜,并通过被病毒编码的糖蛋白修饰的质膜出芽,获得囊膜并形成BV(图2)(Blissard and Theilmann, 2018)。释放出的BV穿过肠道基膜(basal lamina)进入血淋巴系统迅速扩散感染全身的组织细胞,也可以直接感染某些类型的细胞(如气管细胞、血细胞),从而引发次级感染(secondary infection)(图1)。BV通过胞吞作用进入细胞质,在晚期内吞体的酸性环境下,BV囊膜蛋白发挥膜融合作用,释放核衣壳到细胞质中。肌动蛋白多聚体可推进核衣壳的运输和穿过核孔,释放病毒基因组开始新一轮的复制。次级感染过程中产生的新的BV能在虫体内部的细胞和组织间传播扩散。而在病毒感染的晚期,BV的生成减少,大量的病毒核衣壳被包装成ODV,并被多角体蛋白包埋,多角体蛋白聚合结晶形成包涵体。随着感染进入到极晚期,被感染的宿主细胞膜裂解,虫体液化(Donlyetal., 2014)。杆状病毒编码的几丁质酶(v-chiA)和组织蛋白酶(v-cath)能降解昆虫的外骨骼,使得包涵体释放到环境中(Hawtinetal., 1997)。
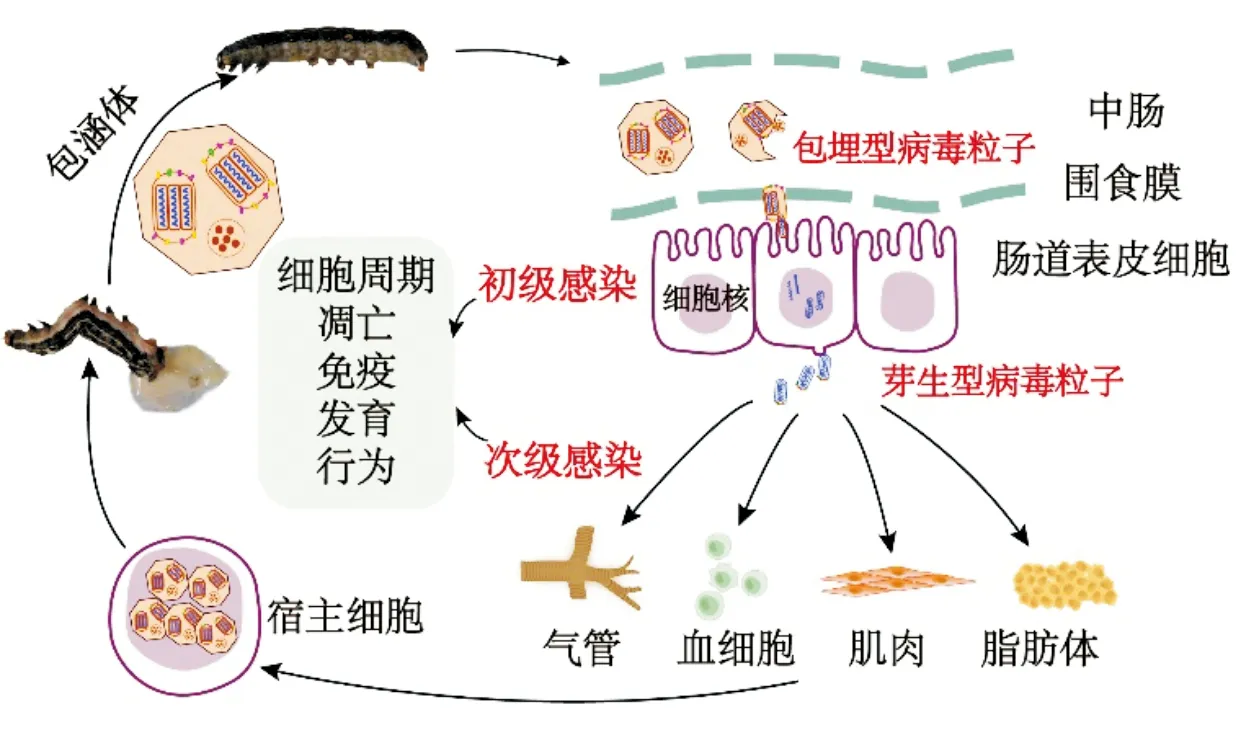
图1 核型多角体病毒的侵染周期Fig.1 The infection cycle of nucleopolyhedrovirus
虽然ODV和BV的基因组相同,核衣壳的结构和组成上基本相似,但是囊膜有很大差别,导致其在病毒侵染过程中的功能显著不同(Blissard and Theilmann, 2018)。BV从宿主细胞中出芽产生,其单层囊膜来源于被病毒蛋白修饰的细胞质膜;ODV在细胞核内组装,其多层囊膜来源于被修饰的细胞核膜(Feietal., 2018)。ODV和BV的核衣壳和囊膜上存在特异性和共有的蛋白,如PTP(protein tyrosine phosphatase)、BRO(baculovirus repeated ORFs)等蛋白是AcMNPV的BV核衣壳特异性蛋白,GP64、v-UBI(viral-ubiquitin)等是BV囊膜特异性蛋白,P33、Ac5等是ODV核衣壳特异性蛋白,PIF、ODV-E66等是ODV囊膜特异性蛋白,P78/83、Ac58、VP39等是ODV和BV共有的核衣壳蛋白,ODV-E25、ODV-E18是共有的囊膜蛋白。
BV和ODV囊膜脂质组成也有很大的不同,如AcMNPV感染草地贪夜蛾Sf9细胞后产生的BV囊膜磷脂约含有50%磷脂酰丝氨酸、13%鞘磷脂、12%磷脂酰肌醇、11%磷脂酰胆碱、8%磷脂酰乙醇胺以及6%溶血卵磷脂(Braunagel and Summers, 1994; Faulkneretal., 1997),而AcMNPV的ODV囊膜脂质大约由39%磷脂酰胆碱、30%磷脂酰乙醇胺、20%磷脂酰丝氨酸以及少量的溶血卵磷脂组成。脂质组分的差异可能在ODV和BV侵染宿主细胞以及组装和出芽中有着重要作用。
2 核型多角体病毒侵染特征
2.1 包涵体溶解与ODV释放
包涵体/多角体蛋白(polyhedrin)是包涵体/多角体的主要蛋白,其三聚体通过二硫键相连形成结晶并将ODV包埋(Jietal., 2010)。多角体蛋白的N-末端区域含有约40个残基的无序氨基酸序列,可能参与ODV病毒颗粒与多角体晶体的互作。包涵体表面由糖类和蛋白质所组成的光滑无缝的多角体膜(polyhedron envelope, PE)包裹,用于密封表面和提高多角体的稳定性。鳞翅目特异性的NPVs都含有PE蛋白(Ac131),PE蛋白和P10纤维化结构有关,而P10蛋白参与多角体膜的组装(Vlaketal., 1988; Whitt and Manning, 1988)。包涵体表面的蛋白酶可能来源于虫体、细菌和病毒的混合物,可被热失活。在昆虫肠道碱性肠液的刺激下,包涵体迅速被肠道或多角体上的蛋白酶溶解,其中早期被破坏的就是连接三聚体的二硫键(Wang and Granados, 2000;Pengetal., 2011)。破坏肠道的围食膜能降低杆状病毒的半致死剂量,表明围食膜是抵御ODV病毒侵染的物理屏障(Wang and Granados, 2000)。一些α-杆状病毒和β-杆状病毒的包涵体含有一种叫做增强子素(enhancins)的金属蛋白酶,enhancins能消化围食膜组分粘蛋白,破坏围食膜从而提高病毒感染效率(Topraketal., 2012)。AcMNPV编码ODV-E66(Ac46)降解围食膜上的硫酸软骨素从而增强初级感染(Sugiuraetal., 2013)。ODV囊膜上ac145和ac150编码的几丁质结合蛋白也可能参与肠道感染(Dalletal., 2001)。
2.2 ODV与中肠细胞
ODV对昆虫上皮细胞的识别有很高的特异性,ODV病毒颗粒首先和微绒毛膜直接接触并融合进入中肠上皮细胞(Granados and Lawler, 1981)。目前的实验结果显示,ODV囊膜表面的病毒口服感染因子(perosinfectivity factors,PIFs)复合物介导ODV与微绒毛膜的结合和融合(Genceretal., 2018; Wangetal., 2018; Wangetal., 2019)。PIF复合物包括9种组分,P74(Ac138/PIF0)最早被发现,敲除p74基因不会影响BV的产生,却使ODV口服感染能力丧失(Kuzioetal., 1989;Haas-Stapletonetal., 2004)。之后发现了9种PIFs,分别命名为PIF1到PIF9,除了PIF5外,其他PIFs都参与PIF复合物的组装。其中PIF1、2和3是核心成分,可以形成约230 kDa的核心复合物。PIF0、4、6、7和9依赖PIF1-3核心复合物而聚集形成约400 kDa的蛋白复合物,最终PIF8加入后形成完整的PIF复合物(Wangetal., 2019)。
AcMNPV的ODV与中肠微绒毛细胞融合后,释放出ODV的核衣壳(Granados and Lawler, 1981)。中肠微绒毛细胞靠近肠腔侧含有很多交联的肌动蛋白丝,间接的证据表明肌动蛋白丝与ODV核衣壳的入核有关(Ohkawaetal., 2010)。除了入核,核衣壳也能绕过细胞核直接穿过肠道表皮细胞到达微绒毛细胞下的基膜,随后直接进入血淋巴(Granados and Lawler, 1981; Hofmannetal., 1995)。BV在病毒感染1~2 h后就会出现在基膜附近(Granados and Lawler, 1981),表明同时入核的基因组编码了早期基因参与到病毒对肠道细胞的快速穿过,从而逃避细胞和肠道免疫。
2.3 BV感染宿主细胞
GP64是AcMNPV的BV粒子的主要囊膜蛋白,属于第三类病毒膜融合蛋白,其同源基因存在于所有的Group I NPVs中。GP64单体通过二硫键相互连接形成三聚体融合蛋白复合物,参与受体结合(Falangaetal., 2012)。当BV感染细胞时,病毒通过GP64与细胞膜表面的潜在受体结合而吸附在细胞表面。随后BV通过网格蛋白(clathrin)介导的内吞途径进入中肠上皮细胞以外的其它组织细胞或离体培养的细胞(Longetal., 2006)。F蛋白广泛分布于杆状病毒中,是α-杆状病毒属Group II NPVs囊膜的主要糖蛋白,β-杆状病毒属和δ-杆状病毒属的BV囊膜的主要糖蛋白,敲除Group II杆状病毒的F蛋白导致BV无法产生(Wangetal., 2008)。F蛋白能替代GP64并在GP64缺失的AcMNPV中发挥功能,但是两者的三级结构和构象变化存在较大差异(Lungetal., 2002)。虽然Group I NPVs也含有F蛋白(称为F-like蛋白),如AcMNPV中的Ac23,但是该蛋白含量低。AcMNPV的Ac23不是BV病毒的复制和感染所必须的,但会影响到ODV的囊膜化和致病活力(Lungetal., 2003)。结合进化关系和功能实验显示,Group I杆状病毒获得GP64之后,F蛋白的功能可能就被取代。
AcMNPV的BV囊膜上还含有其他低丰度的蛋白,如v-UBI(Ac35)、GP37(Ac64)、ODV-E25(Ac94)、ODV-E18(Ac143)和BV/ODV-E26(Ac16)等(Dengetal., 2007)。ODV-E25(Ac94)和ODV-E18(Ac143)对于感染性BV的产生非常重要,v-UBI、GP37和BV/ODV-E26蛋白虽然能影响BV的数量,但是并非BV的感染和增殖所必须的(Volkmanetal., 1984;Volkman and Goldsmith, 1985; Pearsonetal., 2001)。
BV病毒颗粒内吞体的形成和转运与宿主细胞内吞分选转运复合体(the endosomal sorting complex required for transport, ESCRT)及可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体(soluble N-ethylmaleimide-sensitive factor attachment protein receptors,SNARE)系统有关(Votteler and Sundquist, 2013)。病毒颗粒被内吞之后,在内吞体膜上质子泵的作用下,内吞体酸化,GP64的构象发生改变进而诱导病毒囊膜与内吞体膜或内吞体内的囊泡膜融合,从而释放核衣壳到细胞质中(Backovic and Jardetzky, 2011; Dong and Blissard, 2012)。BV感染后能诱导细胞核周围的肌动蛋白骨架发生聚合,病毒非必须基因arif-1参与了肌动蛋白的定位。病毒的P78/83(Ac9)定位于核衣壳末端,通过招募成核剂Arp2/3复合物促进肌动蛋白聚合,推进病毒核衣壳穿过核孔复合体进入细胞核(Muelleretal., 2014)。随着细胞核内病毒基因的表达和DNA的复制,子代核衣壳在病毒发生基质VS中组装后被运输到环带区域,该运输过程依赖于核内于F-肌动蛋白的聚合以及核衣壳蛋白VP80(Ac104)、P78/83(Ac9)、VP1054(Ac54)和BV/ODV-C42(Ac101)的参与(Mareketal., 2011; Guanetal., 2016)。
2.4 BV从宿主细胞中释放
AcMNPV在核內组装好的一部分核衣壳会从核膜出芽用于产生BV,另一部分核衣壳仍然留在细胞核内用于ODV的组装(图2)。决定核衣壳从核膜出芽还是留在细胞核的机制尚不清楚,可能受BV或ODV的核衣壳特异性蛋白的调控(Braunageletal., 2003; Xuetal., 2015)。BV核衣壳的泛素化修饰多于ODV核衣壳,泛素化可作为核衣壳出核的标记并参与出核过程的调控(Biswasetal., 2018)。核衣壳通过细胞核膜上由病毒和宿主蛋白构成的蛋白复合物出核,核衣壳出核后被包裹在核膜形成的运输泡中。微管可能参与运输泡在细胞质中的运输,SNARE蛋白也参与运输泡的产生或核衣壳从运输泡中释放(Guoetal., 2017),释放后的核衣壳借助肌动蛋白聚合或微管被运输到细胞质膜(Ohkawaetal., 2010;Danquahetal., 2012)。ESCRT也介导了核衣壳从核膜或细胞质膜的出芽释放过程(Yueetal., 2018)。大量的病毒膜融合蛋白(GP64或F蛋白)在细胞质中合成并被转运至细胞质膜,核衣壳通过病毒膜融合蛋白区域的细胞质膜包裹而出芽形成子代BV。AcMNPV囊膜GP64融合蛋白极大地决定了BV的组装效率(Oomens and Blissard, 1999)。
2.5 ODV的组装
在病毒复制的晚期,大量组装的核衣壳滞留于细胞核内并被内核膜(inner nuclear membrane, INM)内陷产生的核内微囊泡包裹形成ODV(图2)。ODV的组装是复杂的,涉及到ODV膜蛋白向宿主细胞核的转运、核内膜的形成、核衣壳的装配及其与核内膜的结合、核内膜对核衣壳的包裹,最终包涵体蛋白晶体将单个或多个ODV包埋,形成包涵体(Shietal., 2015;Qinetal., 2019)。ODV囊膜蛋白在核内表达后转移到细胞质中加工成熟后入核,定位在细胞核内膜,诱导微囊泡形成。微囊泡在细胞核膜处形成后脱离,Ac76、Ac75和Ac93参与了该过程,这三个蛋白也参与了核衣壳出核和BV的形成(Yuanetal., 2011;Weietal., 2014)。随着核衣壳与核内病毒膜的互作,核衣壳聚集,其末端与微囊泡关联,微囊泡变长,其内的核衣壳平行排列(Shietal., 2015)。病毒极晚期基因高表达,产生大量包涵体蛋白和P10蛋白参与包涵体的形成。
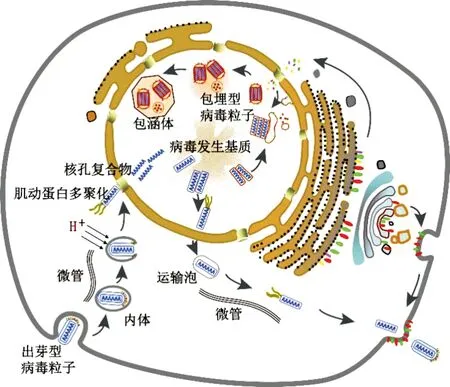
图2 芽生型病毒粒子侵染非中肠细胞Fig.2 The infection process of budded virus in nonmidgut host cells
3 NPV与昆虫免疫
昆虫虽然缺乏获得性免疫,但在长期进化过程中形成了一套较为完善的先天免疫系统,抵御病原物(包括病毒)的入侵。昆虫的免疫系统可分为体液免疫和细胞免疫。体液免疫主要通过Toll-Spätzle、IMD(immune deficiency)、JAK-STAT(janus kinase/signal transducer and activator of transcription)等信号通路上调抗菌肽、活性氧和溶菌酶等效应分子(effectors)的表达,杀灭病原物;而RNAi是昆虫体内重要的抗病毒机制(Voinnet, 2005)。细胞免疫主要通过血细胞参与吞噬、包囊和节结形成等过程清除异物(Lemaitre and Hoffmann, 2007)。酚氧化酶(phenoloxidase,PO)属于体液蛋白,激活后引发黑化反应以杀灭病原物,能同时激活体液免疫和细胞免疫(Luetal., 2014; Yietal., 2014)。此外,细胞凋亡、活性氧(reactive oxygen species, ROS)系统在昆虫免疫中也发挥功能。
3.1 NPV侵染与免疫信号通路
昆虫识别病原微生物后能将免疫信号转到细胞内级联放大,诱导产生效应因子,如抗菌肽(Luetal., 2018)。抗性和易感品系的家蚕感染BmNPV后,抗菌肽Gloverin在抗性品系中的表达显著高于易感品系,表明被病毒侵染的抗性品系的免疫反应被显著激活(Baoetal., 2010)。在AcMNPV感染的细胞中添加Gloverin能降低BV的产量(Moreno-Habeletal., 2012)。但是,也有报道显示AcMNPV感染的幼虫中,抗菌肽Gloverin和Attactin的表达是下调的(Choietal., 2012),可能跟侵染的时期和对象有关。JAK/STAT通路调控细胞增殖、分化、凋亡和免疫,JAK/STAT通路的关键蛋白STAT被激活后从细胞质转移到细胞核内调控基因表达。饲喂BmNPV后的家蚕血细胞中BmSTAT的表达量上调,而Toll受体的配体Spätzle-1的表达量并没有显著升高(Liuetal., 2015)。降低BmSTAT的表达量导致细胞对BmNPV的抗性下降,增加BmSTAT的表达量后细胞对NPV的抗性也增加,表明JAK/STAT通路可能参与了抗病毒防御(Zhangetal., 2016)。感染BmNPV后,Toll家族受体在抗性品系的家蚕中肠中表达高于易感品系(Zhouetal., 2013)。AcMNPV会通过TLR9(toll-like receptor 9)激活小鼠的先天免疫(Abeetal., 2005)。唾液酸结合免疫球蛋白样凝集素(sialic acid binding immunoglobulin-like lectin, Siglec)作为Ⅰ型膜蛋白,能参与识别流感病毒和触发病毒的内吞(Shinyaetal., 2006;Crockeretal., 2007),Siglec通过TLR信号通路来调节免疫反应(Paulsonetal., 2012)。Siglec在家蚕抗性品系的中肠中被BmNPV上调,Siglec和Toll在NPV感染过程中的功能有待后续研究进一步验证。
RNAi(RNA interfering)作为一种先天的抵抗病毒感染的防御机制广泛存在于植物、线虫和动物中(Ding, 2010)。RNAi是利用非编码小RNA分子切割靶标mRNA抑制基因表达。果蝇的micro RNA(miRNA)和small interfering RNA(siRNA)分别被Ago1(argonaute proteins 1)和Ago2(argonaute proteins 2)识别后,被加载到RNA诱导的沉默复合体(RNA-induced silencing complex, RISC),剪切或抑制靶标基因(Ding, 2010)。此外,Piwi- RNA(piwi-interacting RNA, piRNA)通路可在siRNA途径缺陷的条件下进行抗病毒免疫(Ding, 2010)。这三种RNAi通路中,siRNA通路是果蝇的主要抗病毒通路。感染HaSNPV的棉铃虫中能检测到大约20 nt的来源于病毒的小核酸片段,沉默Dicer-2后细胞中对应的病毒转录本增加,表明病毒的转录本通过宿主的RNAi途径被降解(Jayachandranetal., 2012)。虽然RNAi是有效的抗病毒途径,但是病毒能编码不同的RNAi抑制蛋白(viral suppressors of RNA silencing, VSRs)以逃避宿主免疫。如DNA病毒IIV6的340R能结合dsRNA和siRNA抑制其被Ago2剪切,敲除340R的病毒毒力显著减弱(Bronkhorstetal., 2019)。研究表明感染了BmNPV、家蚕质型多角体病毒B.moricytoplasmic polyhedrosis virus(BmCPV)和家蚕二分浓核病毒B.moribidensovirus(BmBDV)的家蚕中,Dicer-2并没有被激活,表明RNAi通路没有被激活,具体机制有待后续研究(Liuetal., 2015)。
3.2 昆虫血淋巴与NPV的免疫互作
酚氧化酶是黑色素合成的关键酶,可以响应病原的侵染产生具有细胞毒性的氧自由基和潜在毒性的半醌和三羟酚。当模式识别受体(pattern recognition receptors, PRRs)识别病原物后,可触发丝氨酸蛋白酶级联途径,剪切酚氧化酶原(prophenoloxidase, PPO)形成有活性的酚氧化酶。丝氨酸蛋白酶抑制剂Serpins通过反应中心环插入到蛋白酶的活性区域,从而导致蛋白质的构象变化而失活(Huntington, 2011)。对AcMNPV有抗性的美洲棉铃虫中,血细胞中的病毒滴度低,黑化和包裹反应能抑制病毒的感染(Trudeauetal., 2001)。酚氧化酶原2s(prophenoloxidase 2s)和磷脂酶A2(phospholipase A2)通过释放溶血磷脂也能激活酚氧化酶原系统,抗病毒的家蚕血淋巴中这两个基因在BmNPV感染后显著上调表达(Bao and Lvetal., 2010),表明酚氧化酶原系统参与宿主对NPV的抵抗。为了成功侵染宿主,NPV进化出不同的策略抑制宿主的黑化反应。Hemileucasp. NPV的hesp018基因编码丝氨酸蛋白酶抑制剂,能抑制酚氧化酶的活性(Ardisson-Araújoetal., 2015)。棉铃虫NPV病毒则能上调宿主的丝氨酸蛋白酶抑制剂(serpin5/9)抑制PPO的激活(Yuanetal., 2017)。AcMNPV的conotoxin-like(ctx)基因能抑制血淋巴的黑化(Caoetal., 2012)。
3.3 NPV和宿主凋亡的发生
细胞凋亡是一种由基因控制下的程序性死亡,由多种凋亡因子诱导而发生,在机体发育、组织稳态平衡以及免疫中发挥着重要作用(Ikedaetal., 2013)。NPV感染昆虫初期,细胞凋亡被激活以抑制病毒复制和扩增;而在昆虫感染后期,病毒则会抑制宿主的凋亡以促进病毒扩增(Roulstonetal., 1999;Ikedaetal., 2013)。多种NPV(如BmNPV, SeMNPV, OpMNPV)感染舞毒蛾Ld652Y细胞均会诱导凋亡(Ishikawaetal., 2003),感染AcMNPV会诱导Sl-zsu-1细胞凋亡(Zhangetal., 2002)。在没有病毒DNA复制时,受斜纹夜蛾核型多角体病毒Spodopteralituramultiple nucleopolyhedrovirus(SpltMNPV)和大豆夜蛾核型多角体病毒Anticarsiagemmatalismultiple nucleopolyhedrovirus(AgMNPV)感染的家蚕Bm-5细胞会引发凋亡(Ishikawaetal., 2003),这些结果表明杆状病毒通过多种机制诱导昆虫细胞的凋亡。
随着病毒的进化,病毒拥有不同的策略可以抑制宿主细胞凋亡,促使自身得以继续增殖。目前在杆状病毒基因组已发现有3种凋亡抑制机制:p35类凋亡抑制剂、凋亡抑制蛋白(inhibitor of apoptosis, iap)和凋亡抑制因子(apoptotic suppressor, apsup)(Huangetal., 2019)。Caspase半胱氨酸酶是诱导凋亡发生的关键组分,其中起始caspase能剪切自激活,引起caspase级联反应,效应caspase可直接降解胞内蛋白,引起凋亡(Denton and Kumar, 2015)。AcMNPV的p35蛋白能直接抑制效应caspase大亚基的剪切从而避免caspase被激活,阻断凋亡的发生(LaCountetal., 2000)。海灰翅夜蛾核型多角体病毒Spodopteralittoralisnucleopolyhedrovirus(SpliNPV)、粘虫核型多角体病毒Leucaniaseparatamultiple nucleopolyhedrovirus(LsNPV)和SpltMNPV含有p35的同源基因p49,p49蛋白能抑制效应caspase和水解起始caspase(Linetal., 2010)。与细胞编码的IAPs相比,病毒编码的IAPs缺少N端不稳定基序,OpMNPV的Op-IAP也能抑制caspase的激活。Caspase大小两个亚基间的TETE-G位点被剪切后能激活caspase, Op-IAP能阻塞剪切位点从而抑制凋亡(Lamkanfi and Dixit, 2010)。被舞毒蛾核型多角体病毒Lymantriadisparmultiple nucleopolyhedrovirus(LdMNPV)感染的Ld652Y细胞中病毒基因apsup在早期表达,能抑制由p35缺失的AcMNPV诱导的凋亡(Yamadaetal., 2011)。Ld652Y细胞中apsup能阻止Ld-Dronc(caspase)的蛋白酶解过程和失活caspase-3-like蛋白酶,从而抑制凋亡发生(Yamadaetal., 2013)。
4 NPV与宿主的其他互作过程
杆状病毒的感染会改变宿主的细胞周期,创造适合病毒扩散的条件。杆状病毒在侵染过程中能阻碍宿主的细胞周期但不影响DNA的复制,从而促进病毒扩增。AcMNPV的转录活化因子ie2在感染草地贪夜蛾SpodopterafrugiperdaSf细胞早期表达,参与阻止细胞有丝分裂的进行。AcMNPV病毒对细胞周期的阻滞取决于侵染时细胞所处的周期状态(Prikhod’ko and Miller, 1998; Mainzetal., 2002; Tungetal., 2016)。HaSNPV和BmNPV分别感染棉铃虫和家蚕细胞系后,导致细胞有丝分裂停留在G2/M期(Zhangetal., 2012; Zhouetal., 2004)。
鳞翅目昆虫的变态发育受保幼激素和蜕皮激素的调控,蜕皮激素由昆虫的前胸腺分泌,能促使幼虫蜕皮。杆状病毒基因组中的egt基因可以编码蜕皮甾体尿苷5′-二磷酸葡萄糖基转移酶(ecdysteroid uridine 5′-diphosphate glucosyltransferase),可以催化尿苷5′-二磷酸糖基(uridine 5′-diphosphate glucosyl)添加到蜕皮激素上,形成没有活性的蜕皮激素22-β-D-吡喃葡萄糖苷(ecdysone 22-β-D-glucopyranose),进而延迟蜕皮和化蛹,以利于病毒大量繁殖(Rodriguesetal., 2001)。当昆虫被病毒感染后,杆状病毒能增加宿主的活动能力以及促使其向高处攀爬,虫体死亡液化破裂时能促进病毒的传播(Kamitaetal., 2005; Wangetal., 2015)。LdMNPV的egt基因表达可以增强舞毒蛾L.dispar的攀爬行为,这种行为可能与egt导致的蜕皮激素的失活有关(Hooveretal., 2011)。蛋白质酪氨酸磷酸酯酶(protein tyrosine phosphatase, PTP)能将蛋白或者RNA去磷酸化,ptp基因缺失的BmNPV无法诱导典型的病毒诱导性爬行症状(Kamitaetal., 2005; Katsumaetal., 2012)。但是BmPTP的磷酸化活性与病毒对宿主的行为控制无关(Katsumaetal., 2012)。此外,NPV感染晚期的幼虫呈现能量代谢被抑制,食欲减退,体色变黄、发白的症状。
5 总结与展望
昆虫和杆状病毒的相互作用是复杂而多样,杆状病毒感染的过程中涉及病毒形态转化、宿主的免疫防御与病毒对免疫的抑制、宿主细胞的凋亡、病毒对宿主基因组的整合等过程,病毒和宿主双方博弈过程中的主导方如何变化仍不清楚。当前的研究大多集中在细胞中,细胞和虫体中病毒与宿主的互作关系存在较大差异,未来需要开展更多的活体研究。尽管当前对杆状病毒的感染过程研究的比较深入,但是更多的实验结果还是集中在杆状病毒外壳蛋白的结构和功能的研究上,如GP64蛋白。GP64蛋白从1995年首次被发现到现在得到了广泛研究,而对于病毒入侵细胞的具体过程还不是很清楚。ODV是NPV启动侵染的重要病毒颗粒形态,尽管ODV的关键组分已被鉴定,但是ODV结合与进入细胞的机制有待深入研究。随着CRISPR-Cas9等技术的发展,开发特定昆虫细胞系(如ODV可侵染的细胞系)和转基因昆虫,将会更有利于研究ODV与宿主中肠细胞的相互作用。
杆状病毒的应用前景巨大,从农业到医学都具有很好的实用性。杆状病毒对靶标害虫有很强的杀虫毒力,而且对环境友好,已被开发成农业害虫杀虫剂。已发现的600多种杆状病毒中只有个别NPV的寄主范围是广谱的,其中甘蓝夜蛾核型多角体病毒Mamestrabrassicaemultiple nucleopolyhedrovirus(MbMNPV)的应用最多。针对目前NPV杀虫剂价格偏贵以及作用时间长的劣势,扩展杆状病毒的寄主范围,提升NPV的毒力,缩短杀虫时间是亟待解决的问题。近年来杆状病毒表达载体系统被大量应用于高质量重组蛋白的表达,已被用于多种疫苗的生产。重组杆状病毒BacMam作为质粒可以将携带的基因转移到哺乳动物细胞中,并且因为哺乳动物细胞中没有杆状病毒的启动子,所以重组病毒并不能在细胞中复制,因此BacMam作为哺乳动物细胞基因载体,在疾病的基因治疗方面也有很好的潜在应用。

