短角瓢虫属Novius Mulsant的研究(鞘翅目:瓢虫科:短角瓢虫族)
唐雪飞,庞 虹
(有害生物控制与资源利用国家重点实验室,中山大学生命科学学院/生态学院,广州 510275)
短角瓢虫属NoviusMulsant,1846隶属于鞘翅目Coleoptera瓢虫科Coccinellidae短角瓢虫族Noviini Mulsant。目前世界上已记录70多种,其中包含了多种在经典生物防治中重要的天敌瓢虫。该属分布于世界各地,大多种类分布在热带和亚热带地区(庞虹等; 2004; 任顺祥等, 2009; 虞国跃, 2011; Pangetal., 2020a)。
短角瓢虫属以其丰富的种类、广泛的分布范围以及有效控制介壳虫的能力被视为重要的天敌昆虫种质资源。许多种类作为天敌已经成功应用于生物防治,在害虫防控方面发挥重要作用,特别是澳洲短角瓢虫Noviuscardinalis(Mulsant, 1850)(原澳洲瓢虫Rodoliacardinalis(Mulsant, 1850))。1888年Koebele将澳洲短角瓢虫从澳大利亚引入到美国加利福尼亚州,防治当时为害严重的柑橘吹绵蚧IceryapurchasiMaskell, 1879,取得了巨大的成功(Craw and Koebele, 1892),被广泛认为是利用瓢虫进行生物防治最成功的案例(Majerus, 1994),为近代生物防治科学的诞生奠定了基石(包建中, 1988),同时使得引进天敌控制害虫成为一项重要的防治举措。自此在害虫的防治研究中天敌的作用愈加受到重视,从而推动了整个生物防治领域科研工作的开展(庞雄飞, 1991)。
1 短角瓢虫属形态学特征
短角瓢虫属瓢虫为完全变态发育昆虫,历经卵、幼虫、蛹和成虫4个发育阶段。
卵:呈椭圆形,洋红色,覆盖着一层薄薄的蜡状渗出物。近孵化时为深红色。卵的表面颗粒状,含有许多卵孔。这些卵孔可能用来促进精子的进入以及氧气的扩散(Majerus, 1994)。
幼虫:虫体背面有毛瘤,两侧的毛瘤向外突出,体外常披白色的蜡粉。
蛹:蛹体几乎完全被4龄幼虫的蜕皮所覆盖。
成虫:体长2.5~5.0 mm,虫体卵圆形或长圆形,背面拱起;头部宽,复眼大;鞘翅硬化度相对较弱,通常为红色、淡黄色、棕色或者黑色;背面密被紧凑浓密的细毛;触角粗短,8节;前胸背板后角钝圆,可见腹节6节;附爪端节1节。
2 短角瓢虫生物学及生态学特性
短角瓢虫属的成虫和幼虫均为捕食性,且具有高度的寡食性,是农林业上一类重要的捕食性天敌。猎物种类多为柑橘类或豆科等植物上为害较严重的蚧虫(图1)。主要捕食绵蚧科的少数几个属,尤其是吹绵蚧属Icerya,如:柑橘吹绵蚧IceryapurchasiMaskell, 1879,银毛吹绵蚧Iceryaseychellarum(Westwood, 1855)和埃及吹绵蚧Iceryaaegyptiaca(Douglas, 1890)等(Caustonetal., 2004; Pangetal., 2020b);有时也会取食其他蚧虫以及蚜虫和烟粉虱BemisiatabaciGennadius等(虞国跃等, 2006; Lietal., 2011)。有研究报道柑橘吹绵蚧如果取食了鹰爪豆属Spartium或者染料木属Genista的植物,会明显降低澳洲短角瓢虫对其的捕食效率,甚至导致澳洲短角瓢虫不取食(Quezada and DeBach, 1973; Mendeletal., 1992);如蚧虫被其它天敌寄生,澳洲短角瓢虫也同样不会取食(Hodek and Honěk, 1996)。王良衍(1985)曾尝试用20多种不同成份和比例的猪肝、蜂蜜、酵母粉、鱼肉、糖、蜂蜜及雄蜂蛹作为代饲料来饲喂红环短角瓢虫NoviuslimbatusMotschulsky, 1866,其幼虫均不取食,成虫也是仅仅可以少量取食小部分的代饲料,并且产卵效果很差。由于其高度的寡食性,目前该属瓢虫的人工繁育基本还是依赖其天然猎物,然而空间的局限性以及其猎物的寄主植物生长缓慢,并且该类群的瓢虫食量大等原因,在实验室条件下人工大量扩繁该属的瓢虫种群并不容易(Schmaedick, 2007; Forrester, 2008)。

图1 短角瓢虫属常见种的猎物图谱Fig.1 Prey map of common species of Novius注:1, 柑橘吹绵蚧Icerya purchasi Maskell (Zimmerman,1948; Kapur, 1949; Puttarudriah and Channabasavanna, 1953; Quezada and DeBach, 1973; Clausen, 1978; Caltagirone and Doutt 1989); 2, 银毛吹绵蚧 Icerya seychellarum (Westwood)(Kapur, 1949; Bedford, 1965); 3, 埃及吹绵蚧Icerya aegyptiaca (Douglas)(Kapur,1949; Muzaffar, 1970; Mendel and Blumberg, 1991); 4, 帕氏巨绵蚧Gigantococcus pattersoni (Newstead)(Kairo and Murphy, 1995); 5, 大蓟巨绵蚧Gigantococcus euphorbiae (Brain)(Bedford, 1965); 6, 白毛吹绵蚧Icerya pilosa Green (Kapur, 1951); 7, 多痂隐绵蚧Crypticerya multicicatrices Kondo and Unruh (Pinchao, 2015, 2018); 8, 豆隐绵蚧Crypticerya genistae (Hempel)(Forrester and Vandenberg, 2008; Ciomperlik, 2010; Kondo et al., 2016); 9, 单痂隐绵蚧Crypticerya palmeri (Riley and Howard)(Kondo et al., 2016); 10, 蒙隐绵蚧Crypticerya montserratensis (Riley and Howard)(Kondo et al., 2016); 11, 日本履绵蚧Drosicha corpulenta (Kuwana)(张军灵等, 2002); 12, 史氏履绵蚧Drosicha stebbingi (Green)(Rasheed et al., 1986; Pathan et al., 2018); 13, 加纳蚁粉蚧Formicococcus njalensis (Laing)(Kairo and Murphy, 1995); 14, 吹绵平刺粉蚧Rastrococcus iceryoides (Green)(Omkar and Pervez, 2004); 15, 竹秆寡链蚧Pauroaspis rutilan Wu (肖水根, 2015); 16, 甘蓝蚜Brevicoryne brassicae (Linnaeus)(Omkar and Pervez, 1999); 17, 萝卜蚜Lipaphis erysimi (Kaltenbach)(Omkar and Pervez, 1999); 18, 黑刺粉虱Aleurocanthus spiniferus (Quaintance)(Li et al., 2011); 19, 温室粉虱Trialeurodes vaporariorum (Westwood)(Li et al., 2011); 20, 烟粉虱Bemisia tabaci (Gennadius)(Li et al., 2011)。
该属瓢虫往往只出现在有蚧虫的地方,喜欢在蚧虫或者基质上爬行。无论成虫还是幼虫,多喜欢分散在叶背面活动,幼虫多通过它们的尾部将自己固定在基质上并进食几个小时(Stebbing, 1904)。卵一旦孵化,幼虫便可以立即进食。通过口器咬住猎物,咬破虫体后取食其体液,使猎物最终干瘪而死。初孵幼虫多钻进吹绵蚧卵囊及其2、3龄若虫的腹下取食(González and Kondo, 2014)。4龄幼虫化蛹之前会有一个预蛹阶段,固定于树干或者树叶背面,停止取食,一般持续一天到几天(Majerus, 1994),然后体背裂开进入蛹期,蛹期通过尾部附着于基质上,处于静止状态。成虫羽化一般需要几分钟的时间,羽化后会继续停留在蛹壳内1~2 d,这个过程中鞘翅和前翅则会扩张并逐渐变得干燥,鞘翅的颜色也会随着羽化的时间而逐渐变深。成虫羽化后很快就可以交配,有多次交配的习性 (张格成和黄良炉, 1963)。产卵一般在猎物附近,有时候也直接在猎物的卵囊下面产卵。抱卵的雌虫通常比未交配的雌虫或者雄虫取食更多的猎物,这表明食物消耗和产卵率之间可能有着一定的相关性(Balduf, 1935)。此外,吹绵蚧有限的扩散能力也有利于该属瓢虫的取食。
在不同栖境下该属瓢虫各龄期的发育历期、产卵量和存活率等存在差异。Grafton-Cardwelletal.(2005)研究了不同温度对澳洲短角瓢虫的影响,结果表明澳洲短角瓢虫成虫于25、28、31、34和37℃温度下72 h,取食柑橘吹绵蚧,其存活率在95%~100%之间,但是在34℃和37℃温度下成虫的产卵量显著减少;此外34℃下保存的卵孵化率和幼虫存活率均降低,而37℃下保存的卵将无法孵化。在10、14、18、22和25°C温度条件下对澳洲短角瓢虫各个龄期的发育时间和存活率的研究表明,10℃条件下卵无法孵化;从14℃到25℃,卵到成虫羽化的发育时间由79 d降至18 d,但是温度对澳洲短角瓢虫的性别比例没有影响(Grafton-Cardwelletal., 2005)。小短角瓢虫Noviuspumilus(Weise, 1892)在我国福州一年发生6代,少数发生7代,在日均温27.8℃条件下各个虫态的发育历期均比31.6℃的短,适宜于其成虫发育的温度为25~30℃;越冬期的虫态以老龄幼虫和蛹为主,少数为成虫,且需要较为干燥的环境条件(黄邦侃等, 1988)。
张格成和李继祥(1991)在我国重庆地区研究了气候因子对澳洲短角瓢虫的影响,结果表明澳洲短角瓢虫喜阴暗环境,耐低温能力强,在冬季没有真正的休眠期;适宜其卵孵化的相对湿度为60%左右,而在相对湿度较高时(85%左右),成虫的寿命会减短、产卵量也显著减少。褐短角瓢虫Noviusiceryae(Janson, 1889)在温度27℃、相对湿度70%的条件下取食帕氏巨绵蚧Gigantococcuspattersoni(Newstead, 1917)发育历期为幼虫期36.3 d,成虫寿命15~74 d (Kairo and Murphy, 1995)。张格成(1994)比较了相同条件下澳洲短角瓢虫和大短角瓢虫Noviusrufopilosus(Mulsant, 1850)各虫态的发育历期,结果表明前者比后者快3.7~26.5 d/代,澳洲短角瓢虫在我国重庆一年发生10代,大短角瓢虫则为4代;同一区域内澳洲短角瓢虫的群落组建和竞争力要远远强于大短角瓢虫(张格成, 1994)。
3 短角瓢虫分类历史

Mulsant(1846)在对法国瓢虫科的研究中,根据瓢虫体表是否附毛将其分为无毛的“Gymnosomides”和被毛的“Trichosomides”两大类;并在被毛类群的Scymniens中基于新属Nomius建立了Nomiaires属团。后来他发现该属名已被占用,在该文章的“附录和勘误”中用Novius代替,并将该属团名称修改为Noviaires。Mulsant(1850)在他的专著《鞘翅目瓢虫科的分类》中,描述了Rodolia属,并在Ortaliens族中建立了Rodoliares属团,在文中也提及了他之前在Scymniens族中描述的Noviaires以及Novius属。
Crotch(1874)对瓢虫科的分类系统进行了修订,认为Rodolia属与Novius属之间非常相似,唯一的区别就是Rodolia属的触角只有8节,并将这两个属归入到Exoplectrae,同时指定RodoliaruficollisMulsant, 1850为Rodolia属的模式种。然而,Korschefsky(1931)认为Crotch(1874)这种做法是无效的,他指出Crotch(1874)并未将R.ruficollis归入到Rodolia属中,而是将其放在了VedaliaMulsant中。因此,Korschefsky(1931)重新指定了RodoliarubeaMulsant, 1850为Rodolia的模式种。Korschefsky(1931)的研究中在短角瓢虫族中包含了5个属,分别为AnoviaCasey、EurodoliaWeise、NoviusMulsant和RodoliaMulsant以及VedaliaMulsant。
Gordon(1972)在对新世界(西半球或南、北美洲及其附近岛屿)短角瓢虫族Noviini的修订中,将Vedalia从短角瓢虫族移到了Exoplectrini族并重新界定了短角瓢虫族。Gordon指出如果不考虑幼虫,仅凭成虫的特征很难将Rodolia属和Anovia属区分,因此暗示要把这两个属合并为一个 (Gordon, 1972)。然而此前Rees(1947)报道这两个属的幼虫的触角节数不同,Rodolia属幼虫的触角2节,Anovia属的则仅有1节(Rees, 1947),因此Gordon(1972)把这个特征作为区别这两个属的依据,保留其为两个独立的属。随后的学者继续基于幼虫的触角是否有2节来区分Rodolia属和Anovia属(Gordon, 1972; Gordon, 1985; Reesetal., 1994)。Rees(1947)的研究第一次尝试仅仅根据幼虫形态来定义Noviine,但是他仅检视了Anovia的一个种,却被用来作为整个属的幼虫的特征,因此Forresteretal.(2009)对其幼虫触角特征的有效性提出了质疑,并描述了Anoviacircumclusa(Gorham, 1899)的幼虫触角有明显的2节,这与先前文献报道的欧洲的Noviuscruentatus幼虫的触角2节一致 (Klausnitzer and Schulze, 1975)。此外还指出Rodolia和Anovia两个属的形态极为相似,需要结合成虫和幼虫特征进行系统发育分析来进一步区分和明确 (Forresteretal., 2009)。

Forrester(2008)在其博士学位论文中根据形态学特征,认为NoviusMulsant, 1846、RodoliaMulsant, 1850和AnoviaCasey, 1908为同物异名,基于Rodolia的属名在各种生物防治文献中已经使用了100多年,建议将其作为有效名,而把Novius、Anovia列为Rodolia的次异名:这一建议被Iqbaletal. (2018)所采用。Pangetal.(2020a)在对澳大利亚短角瓢虫属的修订中,根据《国际动物命名法规》“优先权原则”,恢复Novius作为该属的有效名,将Rodolia和Anovia作为Novius的次异名,把Rodolia和Anovia的63个种移到了Novius属。此外提供了短角瓢虫属Novius的有效种名录,并且提出了以下异名:NoviusbellusBlackburn, 1889 =EurodoliaseveriniWeise, 1895=NoviusimmaculatusLea, 1902;NoviuskoebeleiOlliff in Craw, 1892=NoviusruberBlackburn, 1889=NoviuslimbatusBlackburn, 1895=NoviussimplicipennisBlackburn, 1895=NoviusdiscoidalisBlackburn, 1895=NoviustripustulatusBlackburn, 1895 =NoviustridensLea, 1902=RodoliablackburniUkrainsky 2009。
附:短角瓢虫属和澳洲短角瓢虫的分类沿革:
短角瓢虫属NoviusMulsant,1846
NomiusMulsant, 1846: 213. Type species:NomiuscruentatusMulsant, 1846, by monotypy. Junior homonym ofNomiusLaporte, 1835 (Coleoptera: Carabidae).
NoviusMulsant, 1846: addenda et errata [p. 4]. Replacement name forNomiusMulsant. Treated as synonym ofRodoliaby Iqbaletal., 2018:1104; Pangetal., 2020a: 4.

MacronoviusWeise, 1885: 63. Type species:NoviuslimbatusMotschulsky, 1866 (subgenus ofRodolia). Weise, 1895: 149 (synonym ofRodolia). Sicard, 1907: 68.

AnoviaCasey, 1908: 408. Type species:ScymnusvirginalisWickham, 1905, by monotypy. Synonymized by Iqbaletal., 2018: 1104.
澳洲短角瓢虫Noviuscardinalis(Mulsant, 1850)
VedaliacardinalisMulsant 1850: 906. TL: Australia.
Noviuscardinalis: Crotch, 1874: 283; Pangetal., 2020a: 6.
Eurodoliacardinalis: Weise, 1895: 150.

RodoliaaegyptiacaSicard, 1907: 67; Korschefsky, 1931: 99.Macronoviuscardinalis: Weise, 1922:104.
Macronoviuscardinalisab.obnubilatusWeise, 1922: 104; Korschefsky, 1931: 98.


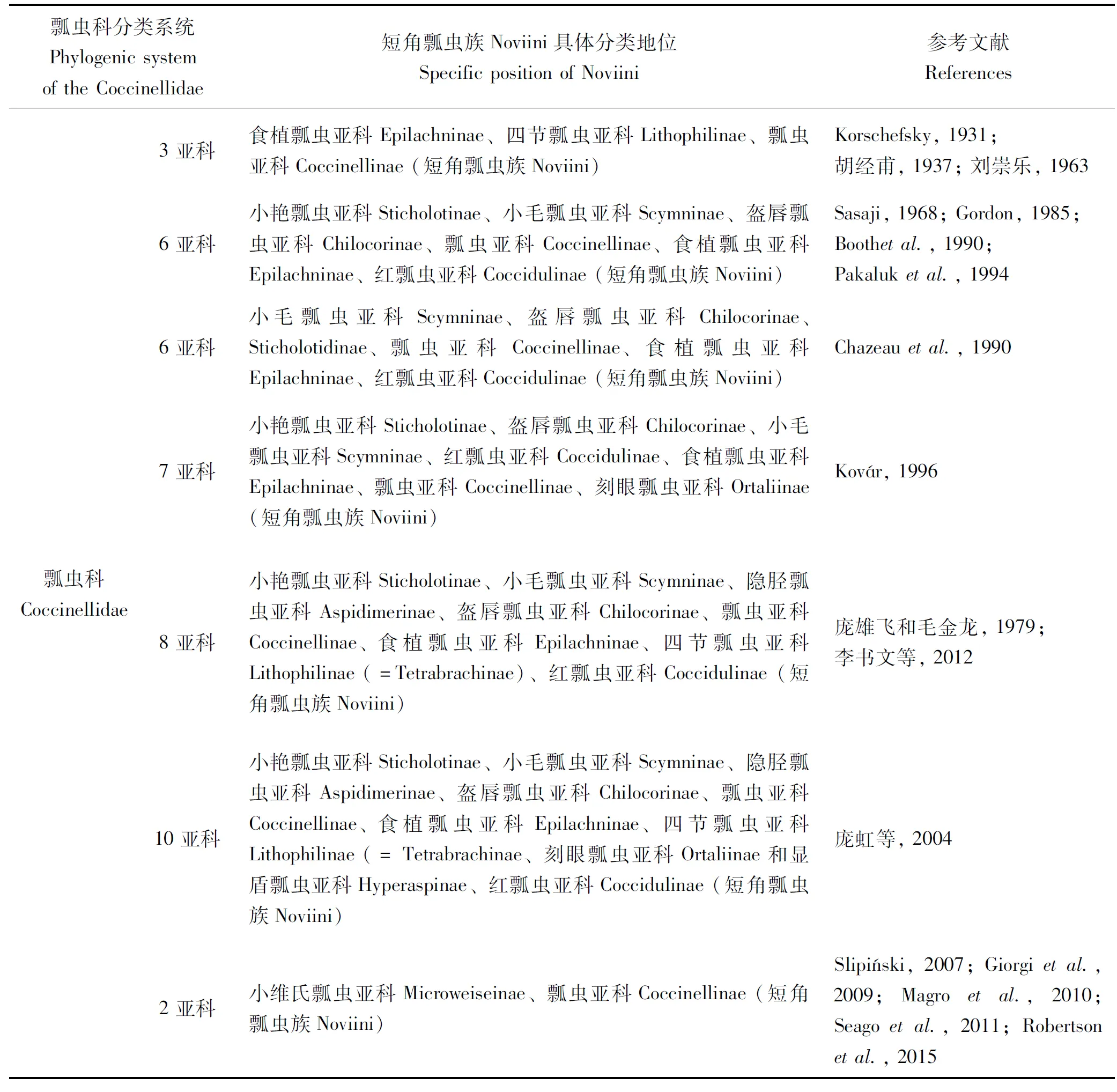
表1 不同分类系统中短角瓢虫族Noviini的地位
短角瓢虫属的系统学研究多基于其形态学特征,以往多数分类学家将其归属于红瓢虫亚科的短角瓢虫族(表1)。而仅仅依靠比较形态学方法研究相关类群的系统发育有较大局限性,迅速发展的分子生物学技术为系统学的研究提供了更多途径。近年来,不少学者通过分子数据对瓢虫科的系统发育关系进行重建,取得了一定的进展:

Margoetal.(2010)选取核基因18S rRNA、28S rRNA和线粒体基因12S rRNA、16S rRNA和COⅠ构建最大似然树和贝叶斯树,探究瓢虫科的系统发育关系,其涉及到短角瓢虫属的只有一个种—澳洲短角瓢虫N.cardinalis,结果显示澳洲短角瓢虫与食植瓢虫族的苜蓿瓢虫Subcoccinellavigintiquatuopunctata(Linnaeus, 1758)聚在了一支。Seagoetal.(2011)将形态特征和核基因28S rRNA、线粒体基因COⅠ和COⅡ 等分子数据相结合,对瓢虫科的系统发育关系进行验证,共选取116个物种,其中短角瓢虫属仅有两个种,系统发育树中这两个种与小毛瓢虫族的Horniolussp.形成一支。Cheetal.(2021)对214种瓢虫和14个外群的94个核蛋白编码基因进行了测序,共选取短角瓢虫族物种6个,系统地研究了瓢虫科的系统发育关系,结果显示氨基酸水平的系统发育推断与核苷酸的结果并不一致,前者的结果为短角瓢虫族与小毛瓢虫族Scymnini的一些类群聚为一支,而后者短角瓢虫族则与Azyini族的一支聚在了一起;此外结果还显示短角瓢虫族的氨基酸取代率远高于瓢虫亚科的其他类群,可能会影响系统发育的推断。以上这些研究中选用的短角瓢虫属的物种数量非常有限,代表性不够,难以真正反映该属与瓢虫科其他类群以及该属内部的系统发育关系。因此,亟需选取更多种类,把形态学特征和分子数据结合起来,对短角瓢虫属的系统发育关系作更加全面深入的研究,从而建立更合理的系统树,以更客观准确地反映该类群的亲缘关系和进化历史。
4 短角瓢虫属应用研究历史
Koebele于1888年将澳洲短角瓢虫从澳大利亚引入到美国加利福尼亚州,防治柑橘吹绵蚧,取得显著成效(Craw and Koebele, 1892),推动了整个生物防治工作的开展,开创了传统生物防治的新纪元(万方浩等, 2000),使得害虫生物防治成为家喻户晓的害虫控制手段 (陈学新, 2010)。如今,澳洲短角瓢虫已被引进到世界各地。由于其适应能力强,基本上都起到了长期控制吹绵蚧种群数量的作用。我国于1909年首次引进了澳洲短角瓢虫,从美国加州和夏威夷引入到台湾(蒲天胜, 1989;庞虹, 1996);文献记载1929年曾从澳洲引入至上海,防治海桐花上的吹绵蚧(刘崇乐, 1963),但引进后未见进一步的报道(蒲蛰龙, 1991);1932年从台湾引入至浙江,防治柑橘上的吹绵蚧(蒲蛰龙, 1978);1955年在蒲蛰龙教授的主持下,从前苏联农业部植物检疫室引进澳洲短角瓢虫至广州,随后在广东多地进行吹绵蚧的防控,均取得了良好的控害效果(张格成, 1994)。澳洲短角瓢虫的成功引入,很好地解决了我国南方地区果树和木麻黄等林木的吹绵蚧为害问题(鲁布卓夫, 1955; 黄邦侃和罗肖南, 1956; 蒲蛰龙和邓德蔼, 1957; 蒲蛰龙等, 1959; 黄邦侃, 1985a, 1985b; 任伊森, 1991)。此外,经过长期的研究、观察和田间试验表明,澳洲短角瓢虫对本地的吹绵蚧天敌大短角瓢虫N.rufopilosus(Mulsant, 1850)没有不良影响(蒲蛰龙, 1991)。
短角瓢虫属瓢虫在生物防治方面发挥着极其重要的作用,除澳洲短角瓢虫外,该属的其他物种在蚧虫防治方面也是功不可没。目前已有很多个物种成功应用于生物防治(表2)。寇氏短角瓢虫N.koebeleiOlliff, 1892同样是被Koebele从澳大利亚引进到美国进行吹绵蚧的防治,取得了喜人的效果(Craw and Koeble, 1892; Clausen, 1978; Caltagirone and Doutt, 1989; Salisbury and Booth, 2004)。小短角瓢虫N.pumilus,分布于东洋区,是我国南方和日本的常见种,1928年小短角瓢虫从日本和我国台湾引进至西太平洋的马里亚纳、加罗林、马绍尔和马里亚纳群岛防治银毛吹绵蚧;1947-1949年小短角瓢虫自马里亚纳群岛引入至加马绍尔群岛等防治埃及吹绵蚧,都取得了一定的控制效果(Sweetman, 1958; 黄邦侃, 1985a; 蒲天胜, 1989; 庞雄飞, 1991)。广泛分布于非洲热带地区的褐短角瓢虫N.iceryae(Janson, 1889)被引进到新西兰进行吹绵蚧的控制(Ormerod and Janson 1889)。加利福尼亚从南非引进了短角瓢虫属的多个物种来提高吹绵蚧的生物防治效率(Clausen, 1978)。我国的土著种红环短角瓢虫N.limbatusMotschusky, 1866和大短角瓢虫N.rufopilosus(Mulsant, 1850)分别为日本履绵蚧Drosichacorpulenta(Kuwana, 1902)和柑橘吹绵蚧的捕食性优势天敌昆虫(张格成等, 1994;郭加忠等, 2010),在防治柑橘吹绵蚧中扮演重要角色(包建中和古德祥, 1988)。短角瓢虫在减少农业生产损失方面,有着很好的害虫可持续治理效果,并且该属物种数量丰富,在蚧虫防控方面有着很大的利用前景。
为提高生物防治的效率,更好地发挥瓢虫的控害作用,国内外学者开展了一系列的研究。国内主要集中在澳洲短角瓢虫的引进、繁殖和利用以及我国一些常见种类如大短角瓢虫、红环短角瓢虫和小短角瓢虫的生物学习性、发生规律、保护措施、应用技术以及蚧虫控制效果等方面的研究(蒲蛰龙等, 1959; 任伊森, 1965; 江洪, 1980; 郭加忠等, 2010; 安新城, 2011)。国外在该属瓢虫的生活史以及控制不同种蚧虫的潜在效能方面也做了大量的研究(Cressman, 1930; Kairo and Murphy, 1995; Ragab, 1995; Awadalla, 2015),并评估了澳洲短角瓢虫对加拉帕戈斯群岛的鸟类及非靶标猎物的影响及其捕食范围 (Caustonetal., 2004; Lincangoetal., 2011; Alvarezetal., 2012 Hoddleetal., 2013),结果表明澳洲短角瓢虫的食性范围较为狭窄,没有发现对应用区域的其它无脊椎动物群落造成明显威胁。此外还着重研究了对该属瓢虫的保护和利用,比如新型杀虫剂的应用对澳洲短角瓢虫的存活率的影响 (Grafton-Cardwell and Gu, 2003),结果表明新烟碱类杀虫剂和拟除虫菊酯对澳洲短角瓢虫的成虫和幼虫的存活率有着显著的负面影响,此外还会降低成虫的寿命和子代的产卵量。这些研究评价了不同生态因子对短角瓢虫属瓢虫捕食效率、生长发育和繁殖等方面的影响,将不断优化短角瓢虫属各物种的种群管理,也为更好地开展生物防治研究和应用提供理论依据。
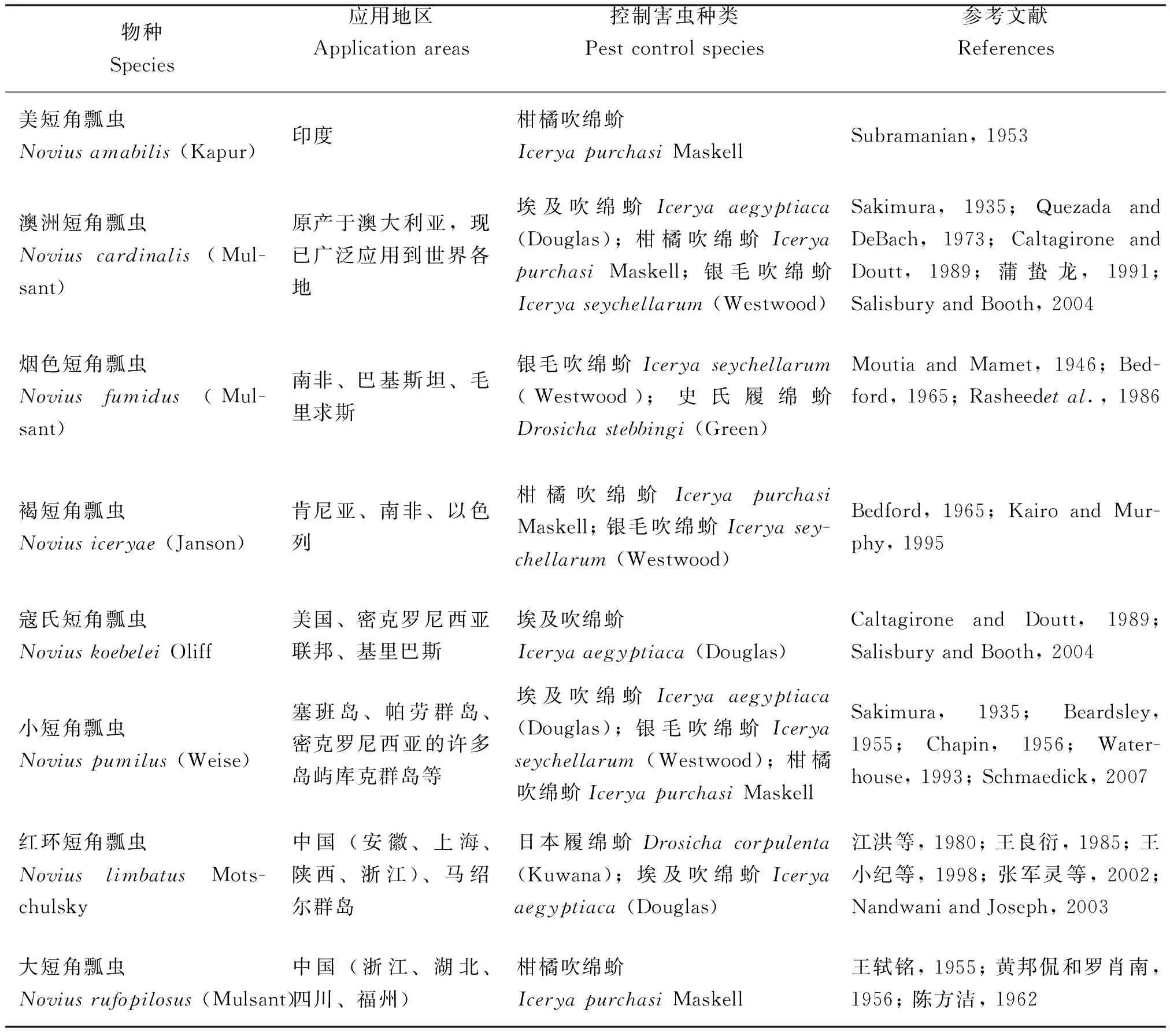
表2 短角瓢虫属应用于生物防治的主要成功案例
5 存在问题与展望
短角瓢虫属是瓢虫科中非常重要的一类捕食性天敌,其物种数量丰富、捕食率高、捕食能力强,在蚧虫防控中起着举足轻重的作用,具有十分广阔的应用前景。从澳洲短角瓢虫成功引种防治至今,研究人员对该属的研究和利用从未停止,也取得了长足的进展,但是仍旧存在一些问题,需要进一步探究和解决:
(1)天敌昆虫物种的准确鉴定是利用其开展有效生防应用的基础与必要前提。短角瓢虫属昆虫形态特征相似且可能存在多谱系,给生物防治的广泛开展带来了分类学上的障碍。此外,短角瓢虫属物种数量丰富,自然界可能仍存在大量物种未被发现,新物种的发现与鉴定对丰富与优化天敌种质资源库具有重要意义。
为进一步推进和开展生物防治工作,该属瓢虫的分类学问题亟待解决,准确高效的物种鉴定系统亟需建立。分子生物学尤其是DNA测序技术的发展给物种的准确鉴定提供了新的途径。将经典分类学与分子数据结合起来,进一步探讨物种的分化和形成机制,厘清短角瓢虫属与瓢虫科内其他类群的亲缘关系、对其系统发育进行重建,是准确鉴定、保护及开发利用短角瓢虫属天敌资源的先决条件,也是进一步开展遗传和应用研究的必要基础,更将是我们今后研究和努力的方向。
(2)天敌昆虫的食性是评价其生防应用价值的重要参考指标。短角瓢虫属瓢虫的成虫和幼虫均为捕食性,且捕食相同猎物,在害虫控制方面有着极大的优势。以往一些生防计划的实施是在不完全了解释放天敌对靶标猎物的识别和分类情况下就进行开展,这对其他非靶标昆虫可能存在着极大的风险 (Pangetal., 2020a)。关于澳洲短角瓢虫的食性范围和释放后的风险评估进行的广泛研究证实其高度的寡食性和应用的适宜性。为更好地利用该属瓢虫,对于已应用于生防的其他种类的食性范围及释放后的风险评估也有待开展,从基因组和转录组层面深入阐释其食性机制、控害机理与效能方面的研究也需要提上日程。
(3)天敌昆虫的大量扩繁是高效开展害虫生物防治的有力保障。目前大批量地繁殖该属瓢虫仍然需要大量繁育其自然猎物,成本高,且费工费时。因此,人工代饲料的开发与改进亟需进一步深入研究。结合该属瓢虫的生理生化及不同生长阶段的营养需求,研制、开发适合该属昆虫的人工饲料和代饲料,提高饲养效率、优化繁育及释放技术也是今后研究的重点。
绿水青山就是金山银山。加强生态文明建设,推进生物防治的应用是共谋全球生态文明建设的重要举措。利用生物防治控制作物病虫害,不仅可以除害增产,还可以保障农产品的质量安全、实现农业的可持续发展,同时也节约了能源、降低了成本、减少了污染。短角瓢虫属类群具有众多优质的天敌昆虫资源,应用于生物防治,经济、安全、高效,对于农业害虫生物防治的推广应用具有重要的研究和利用价值。随着不同学科如生态学、遗传学、分子生物学以及基因组学等学科的相互交叉和渗透,几何形态学、分子系统学等多种技术手段的联合应用,关于天敌瓢虫的研究也将进入一个新的发展阶段。

