红火蚁三龄、四龄幼虫肠道菌菌群多样性分析
押玉柯,夏 敏*,李 军,吴少英
(1. 南阳师范学院生命科学与技术学院,河南南阳 473061;2. 广东省科学院动物研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260;3. 海南大学植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
红火蚁SolenopsisinvictaBuren属于膜翅目Hymenoptera蚁科Formicidae切叶蚁亚科Mymicinae火蚁属Solenopsis(Vinson, 1997),是一种原产于南美洲巴拉那河流域的危险性害虫。2003年10月在台湾发现有红火蚁危害,2004年9月在中国大陆广东吴川市首次发现(曾玲等,2005)。作为一种新的入侵害虫,红火蚁蚁巢一旦遭到破坏,会迅速爬出巢穴,叮咬破坏者,严重威胁公共安全(Tschinkel, 1993)。人体被红火蚁叮咬后有如针刺般的疼痛,过敏者会有脓包、瘙痒等症状,严重的可能会出现过敏性休克甚至死亡(Jamesetal., 1976)。同时,红火蚁也会危害当地农作物,破坏本地物种的生物多样性。通过取食作物的种子、果实、幼芽、幼茎及根系,造成农作物大面积减产(Steward and Vinson, 1991)。通过捕食、竞争空间等途径降低入侵地生物尤其本地蚂蚁的物种丰富度和生物多样性(Porter and Savignano, 1990; Pennisi, 2000;杨伟东等,2005;沈鹏等,2007)。
昆虫体内存在着多种内生菌,并且其体内的微生物具有丰富的生物多样性。内生菌分布于昆虫的胸腺、食道、肠道、唾液腺、马氏管等组织部位,但主要分布在肠道和体液中(薛宝燕等,2004;郭军等,2015)。昆虫的种类不同,内生菌的分布也会有差异,内生菌的分布与生活定殖的环境也有很大的关系,但主要受培育的影响(谭周进等,2005)。昆虫消化系统伴随着宿主昆虫的取食、消化、排泄等生理活动,其中共生菌非常丰富,一般认为这些共生菌是宿主正常生长所必需的(彩万志,1990)。肠道微生物主要消化吸收营养物质,甚至有些肠道微生物还能够合成生长所必需的营养物质。张焱等(2016)发现昆虫的内生菌和线粒体一样,由宿主通过垂直传播的方式传递给后代,也可以在物种内和物种间进行水平传播,有研究结果显示,寄主内共生菌可以通过昆虫天敌寄生蜂进行水平传播(郑庆伟,2015)。昆虫的内生菌分为原生内生菌和次生内生菌(谭周进,2005;黄旭,2016)。原生内生菌一般依靠垂直传递(徐红星等,2009),主要分布在特殊细胞内,为宿主昆虫生长繁殖所必需;次生内生菌在宿主内既可垂直传播也可水平传播(Baumann, 2005;Oliveretal., 2010),不是昆虫宿主生长所必需的。在自然界进化过程中,内生菌与宿主昆虫互利共生(Wilkinson, 1998;Oliveretal., 2010)。内生菌在宿主消化、生长繁殖和行为中起着重要的作用(杨义婷等,2014),昆虫体内的某些共生菌能够为宿主提供食物中所缺乏的主要营养物质,消化食物以调节营养平衡(王荫长,1994;吕仲贤等,2001)。
以昆虫为宿主的内生菌能够在宿主体内生长、繁殖,从而昆虫共生菌也会因昆虫定殖环境的改变发生改变。将昆虫体内内生菌分离出来的方法有传统分离法和分子生物学的方法。传统分离法主要是通过划线的方法分离可培养的微生物,而环境中有大部分微生物是不可培养的(Hanetal., 2015),因此可通过分子生物学的方法获得昆虫体内内生菌的一些数据。以分子生物学作为手段,昆虫共生菌的基因组DNA做模板,将PCR扩增序列在NCBI数据库中比对,得到其微生物数量、种属、区系组成及群落组成以及微生物与周围自然条件相互影响的关系体系(Amannetal., 1995)。16S rRNA分为可变区和保守区,每一种细菌的保守区都相同,可以反映物种之间的亲缘关系;而可变区因细菌的种类而有差异,可通过可变区了解物种之间的差异。有研究表明通过构建白蚁肠道16S rDNA文库,研究结果发现其肠道共生菌物种具有丰富性、多样性,其中有厚壁菌门、拟杆菌门、变形菌门、螺旋体门等细菌(Zengetal., 2015)。因此,通过16S rDNA Miseq高通量测序技术(high throughput sequencing)(Koboldtetal., 2013)的方法分析研究昆虫体内微生物的多样性,为进一步明确昆虫内生菌生理功能和生态学意义具有重要的参考价值。
红火蚁1龄、2龄、3龄幼虫咽部能过滤掉直径大于0.88 μm的食物,只能消化育幼蚁反刍的液体食物。而4龄幼虫能够取食直径为45.8 μm,甚至较大的固体颗粒(Michael Glanceyetal., 1981)。固体食物必须经过4龄幼虫消化后,再通过育幼蚁交哺饲喂给蚁后及低龄幼虫,从而为整个蚁群提供蛋白质、油脂类及碳水化合物等营养物质,进而维持整个蚁群的正常发育(Tschinkel, 1995;Vinson, 1997)。因此在整个蚁巢中,4龄幼虫对红火蚁群落的生存尤为重要。
目前国内对红火蚁幼虫肠道菌菌群的研究较少,而国外早有研究发现红火蚁4龄幼虫的中肠是封闭的,在蛹期之前会排尽肠道内容物(Petralia and Vinson, 1980),但是对红火蚁中肠可培养细菌知之甚少,前人的研究主要集中在尚未培养的专性共生体上(Peloquinetal., 2001),直到2003年有研究者才证实了红火蚁4龄幼虫中肠道确实有细菌(Peloquin and Greenberg, 2003)。Medina等尝试使用SEM和TEM发现红火蚁的肠道共生菌(Medinaetal., 2007)。Lee等分别取不同的3个地点的红火蚁的4龄幼虫测其16S rRNA基因,发现3个地点的红火蚁4龄幼虫内共生菌并没有紧密的关系,证实红火蚁幼虫内生菌菌群由所吃的食物决定(Leeetal., 2008)。
因为昆虫肠道内共生菌通常处于平衡状态,并受其昆虫宿主的控制,但如果被人为干扰,就会破坏这一平衡从而对宿主有机体致病。该研究的最初目的就是找到4龄幼虫的某一肠道可培养共生菌,人为干扰其表达从而达到生物防治的目的。
1 材料与方法
1.1 样品采集
实验所用红火蚁来自广州番禺,在野外挖取整个蚁巢装入塑料桶(35.5 cm×34.8 cm)中带回实验室在控制条件下(25±1℃, RH 70%±5%,L ∶D=8 ∶16)饲养,塑料桶内壁涂抹福隆(AGC Chemicals Europe, Ltd., Thornton-Cleveleys, Lancashire, UK)以防蚂蚁逃逸。所有的蚁巢都为由大量工蚁、有翅蚁、各阶段的幼虫及蛹组成,饲喂方法参考Li等方法(Lietal., 2016),待蚁群稳定后将红火蚁利用滴水法(吕利华等,2006)从土壤中分离供试验所需幼虫。分离出来的红火蚁放入底部铺有1 cm后石膏的塑料盒(28 cm×17 cm×18 cm)中备用,塑料盒的周围涂有福隆。
1.2 样品总DNA提取
在体视显微镜下分别挑选出3龄幼虫和4龄幼虫各20头,用液氮速冻,放于-80℃冰箱备用。经体表消毒后,按照OMEGA Insect DNA Isolation Kit (OMEGA,USA)的说明书提取样品中的总DNA。
1.3 高通量测序
采用细菌通用引物338 F和806 R对16S rRNA基因的V3-V4区进行PCR扩增,扩增的反应条件为:94℃,5 min;30×(94℃,30 s;60℃,30 s;72℃,1 min);72℃,10 min。扩增体系(20 μL)为:2×Taq Master Mix(Dye Plus)10 μL、Forward Primer 1 μL、Reverse Primer 1 μL、DNA模板10 ng(Longetal., 2010)。采用上海美吉生物医药科技有限公司的MiSeq PE300测序仪进行序列测定。
1.4 数据分析
Illumina MiSeq得到的数据是双端序列,首先根据PE读长之间的部分重叠关系,将成对的读长拼接成一条序列,同时对读长的质量和拼接的效果进行质控过滤,根据序列首尾两端的barcode和primer序列区分样品得到的有序序列,并校正序列方向。采用软件Trimmomatic和FLASH对数据进行去杂(Chenetal., 2016)。通过Usearch软件平台(version 7.1 http://drive5.com/uparse)对OTU(Yeetal., 2017)进行聚类,获得OTU的代表序列。将所有优化序列至OTU的代表序列,选出与OTU代表序列相似性大于等于97%的序列,生成OTU表格。为了得到每一个OTU对应的物种分类信息,通过贝叶斯算法对相似水平的OTU高于97%的代表序列进行分类学分析,并在各个分类学水平上分别统计各样本的群落组成。比对分类采用Silva(Release 128 http://www.arb-silva. de)数据库(Yunetal., 2014)。通过Alpha多样性指数统计分析研究微生物群落的差异。基于各分类学水平样本序列数统计表,利用R语言工具作图分析不同样本在各分类水平(如域、界、门、纲、目、科、属、种、OTU等)上的群落结构组成差异。
2 结果与分析
2.1 生物信息学分析
3龄幼虫和4龄幼虫的样品序列经拼接、质控和过滤后分别得到44 390和51 559条序列,将序列相似性为97%的归为1个OTU,2个样品中总OTU数目为183,3龄幼虫的OTU数目为51,4龄幼虫的OTU数目为170。
2.2 稀释曲线分析
稀释曲线(Rarefaction curve)可以反应不同样品的测序深度。它也可以用来比较不同样本中物种的丰富度、均一性。随着随机抽取测序数据量的增加,稀释曲线逐渐趋于平缓,说明测序结果比较合理,更多的数据量只会产生极少新的OTU。两样品的稀释曲线随着测序深度的增加逐渐趋于平缓,表明测序覆盖率较高(图1)。
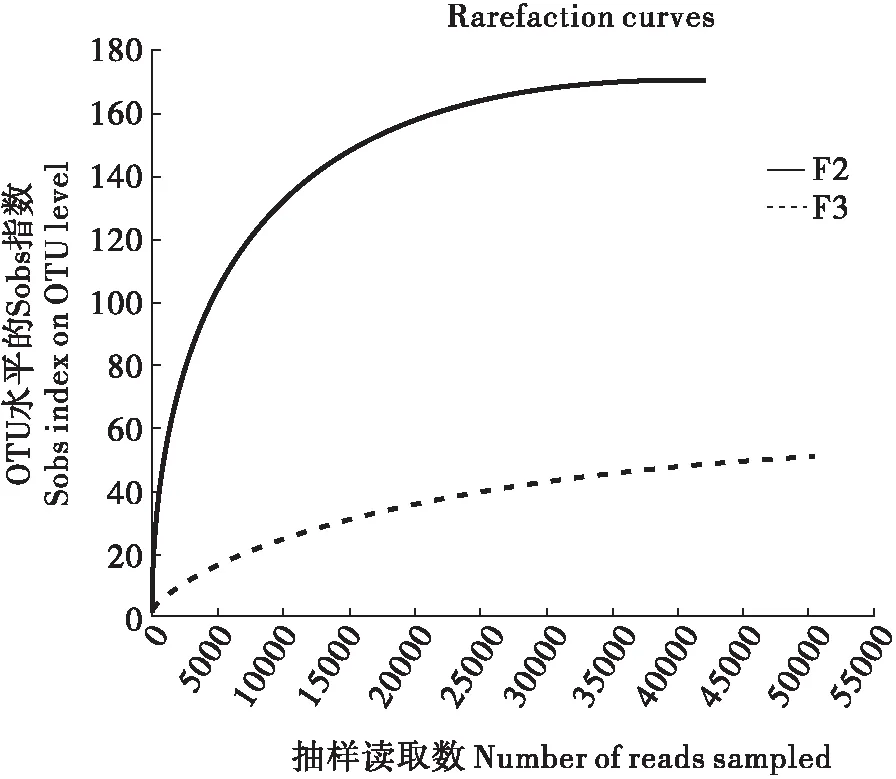
图1 样品稀释曲线Fig.1 Rarefaction curve of all samples注:F2为4龄幼虫,F3为3龄幼虫。下同。Note: F2 was fourth instar larvae, F3 was third instar larvae. Same below.
2.3 3龄幼虫和4龄幼虫的Venn图分析
3龄幼虫和4龄幼虫样品共有的OTU数目为38,而3龄幼虫样品独有的OTU数目为13,4龄幼虫样品独有的OTU为132。两样品中的细菌只有少部分相似,4龄幼虫样品中的细菌种类比3龄幼虫样品中的细菌种类更丰富;其中3龄幼虫和4龄幼虫样品的细菌种类分别占两样本所有细菌种类的27.87%、92.90%(图2)。
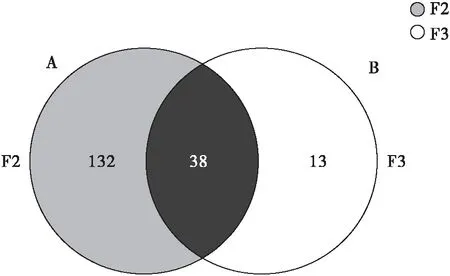
图2 细菌物种组成的Venn图Fig.2 Venn diagram of bacterial species composition注:A, 4龄幼虫样品F2; B, 3龄幼虫样品F3。Note: A, Fourth instar larvae sample F2; B, Third instar larvae sample F3.
2.4 3龄幼虫和4龄幼虫门水平的Alpha多样性分析
本次各样本测序结果覆盖率均大于99.95%。4龄幼虫的物种丰度和物种多样性显著高于3龄幼虫(表1)。
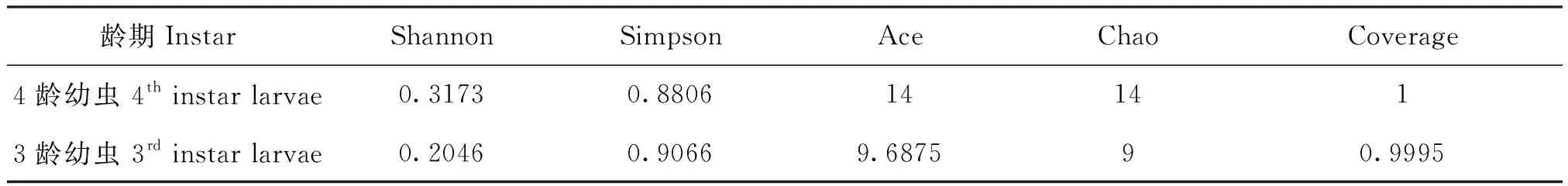
表1 样品多样性指数表
2.5 3龄幼虫和4龄幼虫的物种组成分析
高通量测序结果表明,在门、纲、目、科、属5个细菌分类学水平上,3龄幼虫比4龄幼虫物种丰富度低(表2)。
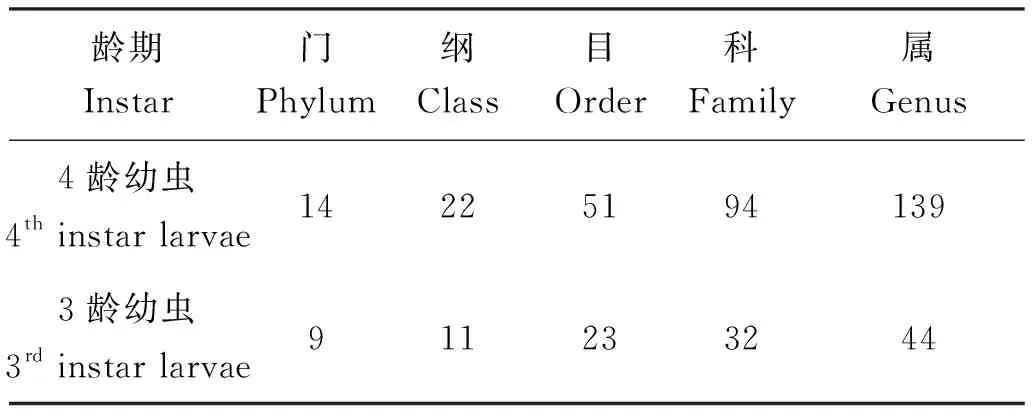
表2 样品在各分类水平的物种分布
2.5.1门水平样品物种分布
3龄幼虫主要由9个门组成,包括软壁菌门Tenericutes(95.11%)、变形菌门Proteobacteria(4.75%)等,其优势种群为软壁菌门(图3)。4龄幼虫主要由14个门组成,包括变形菌门Proteobacteria(93.78%)、放线菌门Actinobacteria(2.08%)、拟杆菌门Bacteroidetes(1.93%)、厚壁菌门Firmicutes(1.85%)等。其优势种群为变形菌门、放线菌门和拟杆菌门(图3)。而2个龄期共有的是硝化螺旋菌门Nitrospirae,由于占有的比例很低,被归为others。

图3 不同龄期门水平物种分布Fig.3 Species distribution at phylum level in different instar
2.5.2纲水平样品物种分布
3龄幼虫主要由11个纲组成,包括柔膜菌纲Mollicutes(95.11%)、γ-变形菌纲Gamma Proteobacteria(0.27%)、α-变形菌纲Alpha Proteobacteria等。其优势菌群为柔膜菌纲(图4)。4龄幼虫主要由22个纲组成,包括γ-变形菌纲Gamma Proteobacteria(92.58%)、α-变形菌纲Alpha Proteobacteria(1.16%)、放线菌纲Actinobacteria(2.08%)、拟杆菌纲Bacteroidia(1.93%)等。其优势菌群为γ-变形菌纲、α-变形菌纲和放线菌纲(图4)。

图4 不同龄期纲水平物种分布Fig.4 Species distribution at class level in different instar
2.5.3目水平样品物种分布
3龄幼虫主要由23个目组成,包括虫原体目Entomoplasmatales(95.11%)、根瘤菌目Rhizobiales(4.46%)等。其优势菌群为虫原体目(图5)。4龄幼虫主要由51个目组成,包括肠杆菌目Enterobacteriales(77.88%)、假单胞目Pseudomonadales(7.27%)、黄单胞菌目Xanthomonadales(6.09%)、根瘤菌目Rhizobiales(0.71%)、Flavobacteriales(1.54%)、β-变形杆菌目(1.08%)等。其优势菌群为肠杆菌目、假单胞目和黄单胞菌目(图5)。
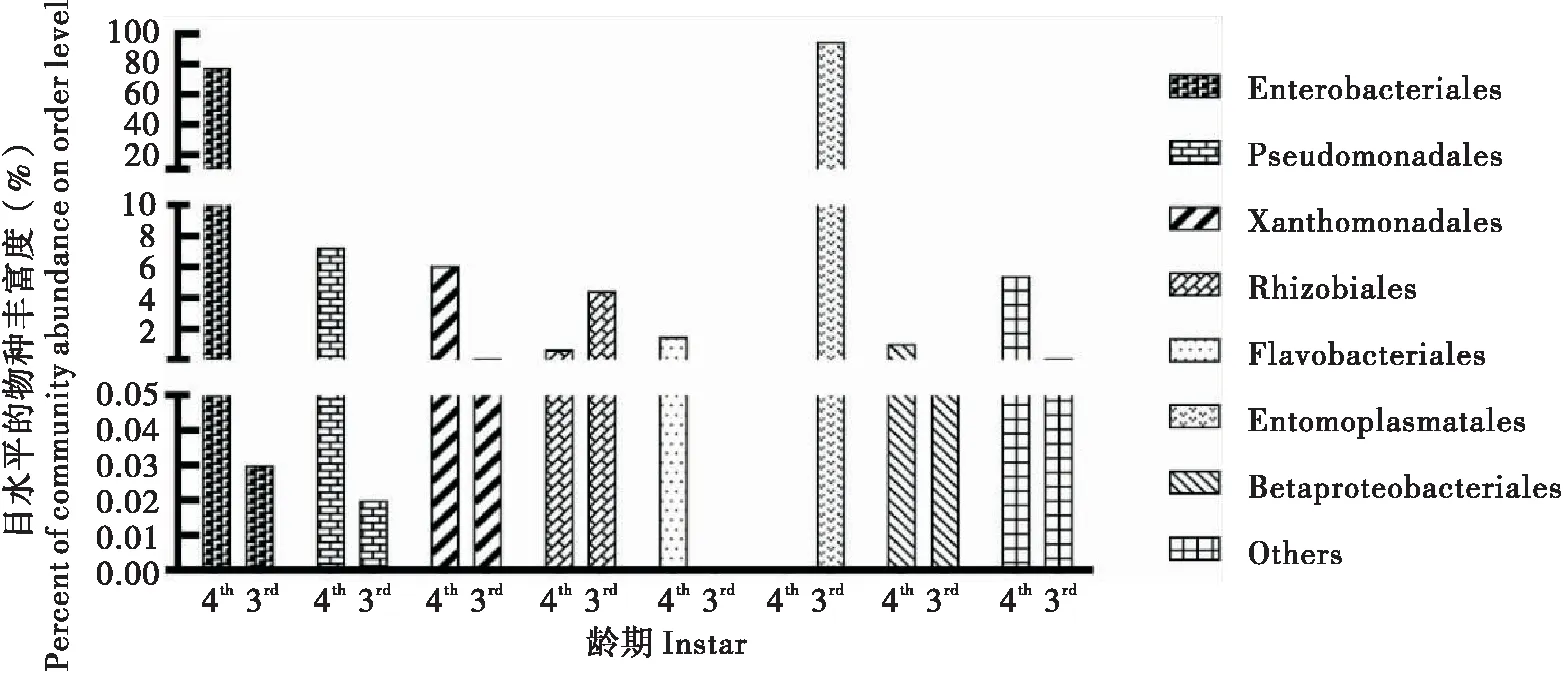
图5 不同龄期目水平物种分布Fig.5 Species distribution at order level in different instar
2.5.4科水平样品物种分布
3龄幼虫主要由32个科组成,包括虫原体科Entomoplasmataceae(95.11%)、根瘤菌科Rhizobiaceae(4.46%)等。其优势菌群为虫原体科(图6)。4龄幼虫主要由94个科组成,包括肠杆菌科Enterobacteriaceae(77.88%)、莫拉菌科Moraxellaceae(6.62%)、黄单胞菌科Xanthomonadaceae(6.09%)、Weeksellaceae(1.53%)、伯克氏菌科Burkholderiacea(1.07%)。其优势菌群为肠杆菌科、莫拉菌科和黄单胞菌科(图6)。
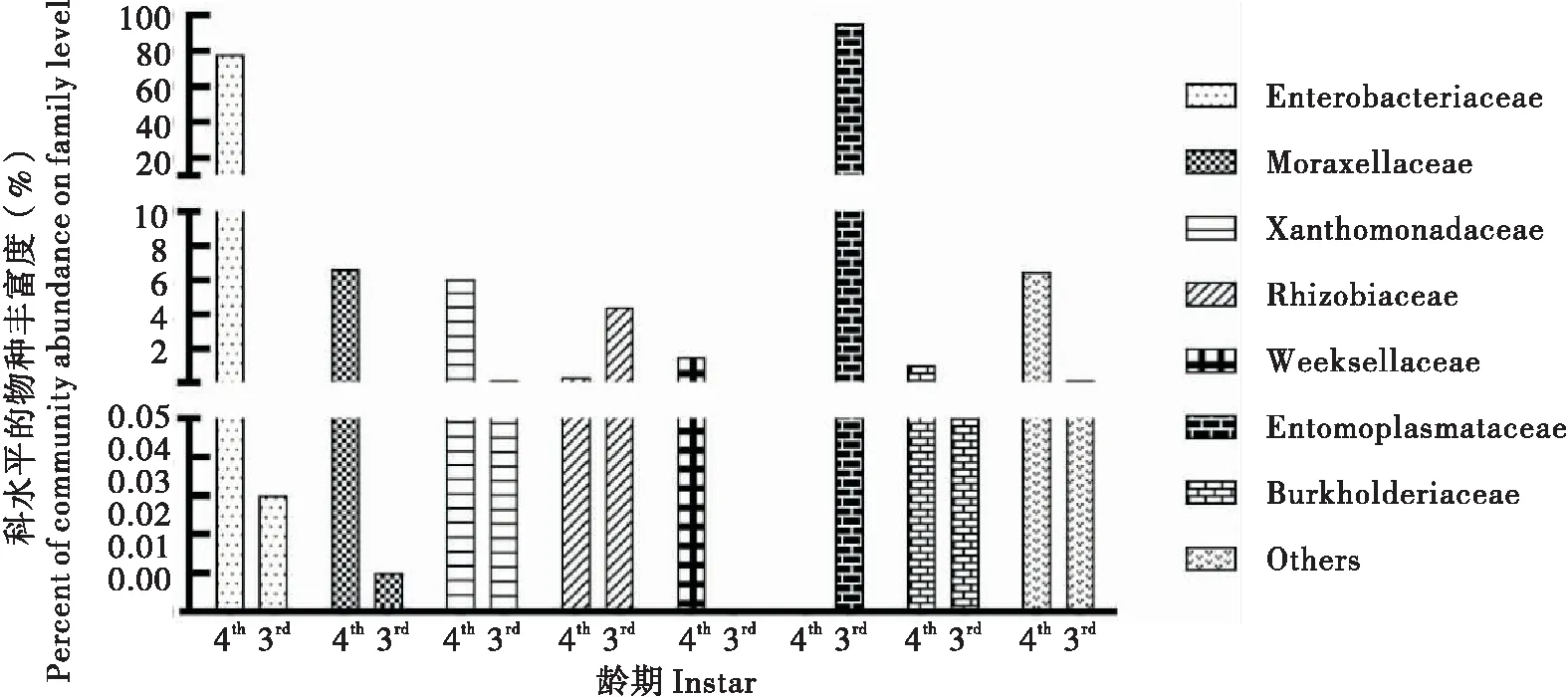
图6 不同龄期科水平物种分布Fig.6 Species distribution at family level in different instar
2.5.5属水平样品物种分布
3龄幼虫主要由44个属组成,包括支原菌属Mycoplasma(95.11%)、中慢生根瘤菌属Mesorhizobium(4.45%)等。其优势菌群为支原菌属(图7)。4龄幼虫主要由139个属组成,包括肠杆菌属Enterobacter(37.10%)、预研菌属Yokenella(26.79%)、不动杆菌属Acinetobacter(6.62%)、沙雷氏菌属Serratia(6.36%)、泛菌属Pantoea(6.35%)、Vulcaniibacterium(5.48%)等。其优势菌群为肠杆菌属、预研菌属、不动杆菌属和沙雷氏菌属(图7)。
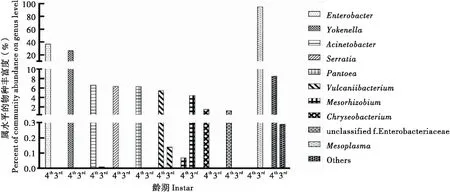
图7 不同龄期属水平物种分布Fig.7 Species distribution at genus level in different instar
3 结论与讨论
本研究采用16S rDNA V3+V4高变区的Illumina Miseq高通量测序法对红火蚁3龄幼虫和4龄幼虫肠道内微生物多样性进行系统分析,初步揭示了红火蚁3龄幼虫与4龄幼虫肠道内微生物群落结构组成的差异性。
但是,Illumina Miseq高通量测序只能将红火蚁3龄和4龄幼虫的肠道菌注释到属水平上,主要是由于高通量测序可同时在数百万个点上读长,不可能对16S rRNA的所有可变区进行测序,通常只选择在450~550 bp之间作为一个测序区域,因此导致后续统计数据分析时,对物种注释的分辨度降低。
通过Venn图分析、Alpha多样性分析及细菌多样性分析等分析方法,对红火蚁的3龄幼虫和4龄幼虫2个阶段的肠道细菌群落差异性分析,结果表明红火蚁幼虫2个不同发育阶段肠道菌群的分布存在较大的差异性。红火蚁3龄、4龄幼虫肠道菌群包括183个OTU,归属于15个门、24个纲、56个目、101个科、151个属,其中3龄幼虫肠道内微生物的OUT数目只有51个,而4龄幼虫肠道内微生物的OUT数目有170个,该结果表明4龄幼虫肠道内微生物的物种多样性及物种丰富度高于 3龄幼虫,引起该差异的主要原因可能是4龄幼虫是整个蚁巢蛋白质及能量的主要供给者,4龄幼虫消化固体食物后反刍给保育蚁,保育蚁再饲喂蚁后及其它蚁型(Whitworthetal., 1998; Yunetal., 2014)。红火蚁幼虫共有4个龄期,因3龄幼虫和1龄、2龄幼虫的取食习性相同,为了比较不同取食习性幼虫间肠道内细菌的差异,本研究只选取4龄和3龄两个龄期的幼虫做为实验材料。而红火蚁幼虫的其它龄期及其各个发育阶段肠道微生物的差异本实验室下一步会继续研究分析。
通过16S rDNA高通量测序的方法研究发现,3龄幼虫肠道内的优势菌群为软壁菌门的支原菌属,比例达到95.11%,而红火蚁4龄幼虫肠道内的优势菌群为变形菌门的7个属,比例达到93.78%,其中优势菌属为肠杆菌属,比例达到37.10%,有研究表明,肠杆菌属与昆虫营养消化有密切关系。表明2个样本内细菌群落的差异较大。昆虫肠道菌结构组成的主要优势菌集中在变形菌门和厚壁菌门,并且杂食性昆虫比单一食性昆虫肠道菌群丰富度更高(Yunetal., 2014)。这一结论与本文的研究结果相符,因为红火蚁4龄幼虫获得的食物种类远远丰富于其它虫龄,因此肠道内应具有更加丰富的菌群,从而为红火蚁的营养供给提供保证,具体每种菌的功能值得下一步研究。
许多因素可能影响肠道共生菌的存在和数量,包括饮食、年龄、疾病状态和行为(Dillon and Dillon, 2004)。在昆虫的不同发育阶段,体内菌群的物种丰富度会有一定的差异,不同发育龄期的内生菌多样性也有所差异。在社会性昆虫中,成虫羽化后的营养和微生物演替速率可能是影响种群健康的重要变量(Andersonetal., 2011)。本研究结果表明,红火蚁4龄幼虫肠道菌菌群物种丰富度及多样性均大于3龄幼虫,其原因可能是由于红火蚁不同龄期的幼虫其在蚁巢中的分工不同而引起肠道菌菌群物种丰富度的差异;也可能是是由于受宿主生存环境的影响。昆虫肠道结构影响菌群群落组成,肠道的微环境有所差异,因此不同的肠道位置具有不同的微生物。在脊椎动物中,某些微生物的定殖可以显著改变群落的组成,而群落对抑制病原体定殖的能力被认为是本地昆虫肠道微生物群最重要的功能(Leeetal., 2008)。
昆虫体内存在大量可培养与不可培养的微生物,在自然界的进化过程中微生物与寄主形成了密切的互利共生关系,在昆虫的整个生活周期中起重要的作用。Lee等人研究发现,红火蚁肠道细菌来自于其所生存的环境,4龄幼虫的肠道细菌存在是因为它们取食了带有细菌的食物(Lee and Hooper-Bùi, 2012)。然而,本研究发现具有相同食物来源的4龄幼虫与3龄幼虫的微生物种类明显不同,4龄幼虫肠道内的优势菌群为变形菌门的7个属,其中优势菌属为肠杆菌属,而肠杆菌属与昆虫营养消化密切相关,因此红火蚁在吸收营养时是否对自身消化有关的细菌具有一定的选择性有待于进一步验证。Whitworth等人从4龄幼虫中纯化和鉴定了4种蛋白酶,发现卵、预蛹、蛹和成虫没有这些蛋白酶,而1龄、2龄和3龄幼虫的酶活性明显低于4龄幼虫(Whitworthetal., 1998)。4龄幼虫对红火蚁群落的生存最为重要,因为它不仅是用于消化固体食物酶的单一来源,而且是与群落其余虫态共享消化物质的独特来源(Vinson and Sorensen, 1986)。因此这些酶很可能参与了红火蚁群落对食物的消化,这些酶与肠杆菌的关系也值得进一步研究。有研究表明,白蚁肠道共生菌的消除,可使白蚁在短期内死亡,反映了肠道共生菌对白蚁的生命必然有着某种重要作用(Xiang and Zhou, 2009)。也有研究表明,使用美洲大蠊喂食抗生素后,其肠道菌群被消除,导致宿主的代谢速率减慢且体重降低,说明肠道微生物能为宿主提供必要的营养物质(Ondrejech, 2016)。本研究通过Illumina Miseq测序手段对红火蚁4龄幼虫与3龄幼虫2个阶段肠道菌菌群的群落结构组成差异进行初步分析,可为下一步研究各个龄期及蚁型的肠道内生菌菌群的差异奠定基础,最终为红火蚁的生物防治提供新的思路及方法。

