一株条斑紫菜丝状体黄斑病致病菌病原学研究
尚晓金,荣小军,王印庚,汪文俊,刘福利,廖梅杰,张 正,李 彬,于永翔
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院黄海水产研究所,农业农村部海水养殖病害防治重点实验室,山东青岛 266071;3.青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266237)
条斑紫菜(Pyropiayezoensis),属红藻门(Rhodophyta),原红藻纲(Protofllorideae),红毛菜科(Bangiaceae),紫菜属,是大型海藻的代表性物种之一,其外观呈鲜紫红色或浅紫色,形状呈卵形、长卵形或裂片[1]。条斑紫菜主要分布于亚洲温带海区,是我国长江以北主要养殖藻类[2]。2017年我国紫菜产量达到17.33万t,养殖面积约8万hm2,养殖产量、规模居世界第一[3]。条斑紫菜富含蛋白质、钙、磷等,除了具有极高的食用和营养价值之外,在医药卫生领域也有广泛的应用,可制成中药食用,具有清热化痰、补肾养心等功效;紫菜中含有的甘露醇是治疗水肿的优质辅助成份,因此,条斑紫菜被誉为“长寿菜”、“神仙菜”[4]。
近年来,随着大型藻类养殖规模的迅速扩大、近海养殖环境的恶化,藻类病害的发生日益频繁[5]。条斑紫菜养殖周期中常见疾病有绿斑病、赤腐病、壶状菌病、拟油壶菌病、丝状细菌病、癌肿病、缩曲症、黄斑病和色圈病等,其病原多为细菌或真菌。其中,条斑紫菜丝状体育苗期黄斑病的传染力强、传播速度快,是危害条斑紫菜育苗的重要疾病之一[5]。本课题组开展的流行病学调查显示,条斑紫菜黄斑病的发病时间集中在每年8~10月份,黄斑病发病初期丝状体附着物表面出现针头大小的青黄色斑点,随着感染加重,斑点逐渐扩大并形成不规则的黄色斑块,感染严重的丝状体颜色由黄变白直至死亡。
2018年9月,山东省日照市岚山区藻类养殖合作社某紫菜育苗场的条斑紫菜丝状体暴发了典型的黄斑病,发病率高达90%。本研究分离、鉴定了导致该病的一株致病菌,以期为条斑紫菜丝状体黄斑病的病原菌鉴定及其防治提供参考。
1 材料与方法
1.1 病样采集
患病条斑紫菜丝状体采自山东省日照市岚山区藻类养殖合作社某紫菜育苗场,发病时水温24~26℃,选取黄色病斑明显的丝状体附着物牡蛎壳和些许海水一起放置在无菌自封袋中,常温保存后运回实验室,于24 h之内进行处理分析。
1.2 样品培养
用于感染实验的健康条斑紫菜丝状体样本采自同一育苗场,暂养于70 cm×60 cm×40 cm水族箱内7 d。暂养条件:培养温度20℃,光照1 000~1 500 lx,光暗周期L∶D=12∶12,营养溶液中N、P浓度为NO3--N浓度15 mg·kg-1和PO43--P浓度4 mg·kg-1,每隔3 d更换1次过滤海水,实验用海水经黑暗沉淀紫外消毒杀菌后使用[6]。
1.3 试剂与仪器
柏兰尼液:(10%硝酸;85%~95%酒精;0.5%铬酸)、实验用培养基TSB、TCBS、2216E购自青岛生物科技有限公司;生化反应微量鉴定管购自青岛海博生物技术有限公司;革兰氏染色液试剂盒购自北京索莱宝科技有限公司;药敏纸片购自杭州生物试剂有限公司;PCR试剂、引物均购自青岛生物工程技术服务有限公司;LAC-450HPY-2型豪华人工气候箱(上海龙跃);JEM-1200EX型透射电子显微镜。
1.4 病原菌的分离纯化
取无菌海水冲洗患病条斑紫菜丝状体附着物贝壳样本表面以去除表面杂质,随后在无菌操作条件下用解剖工具在有患病明显的附着贝壳表面刮取病灶部位藻体,刮取面积约为3 cm×3 cm。将刮取物一部分用来制作水浸片,观察藻体结构变化;另外一部分放置在1.0 mL无菌海水中吹打均匀后进行10倍梯度稀释,从每个稀释度藻悬浮液(106CFU·mL-1、107CFU·mL-1、108CFU·mL-1)中吸取100μL,分别接种于TSB、TCBS和2216E培养基上,在恒温培养箱(28℃)中培养36 h。观察菌落生长情况,平板计数,确定优势菌,将其编号为PZ201809121102。挑取形态一致的优势菌株在新鲜培养基上进行分离纯化,观察菌落形态。将分离纯化后的菌株重悬于20%甘油内,-80℃冰箱保存。
1.5 革兰氏染色与电镜负染
将菌株PZ201809121102平板划线后,挑取纯化完成的优势菌单菌落,对其进行革兰氏染色,具体操作方法参照索莱宝革兰氏染色试剂盒产品说明书,染色完成后在光学显微镜下观察其细菌属性。用2.5%戊二醛固定液固定后,送至青岛大学医学院附属医院电镜检测中心进行细菌形态检测,通过透射电镜观察分析细菌形态特征。
1.6 回归感染实验
挑取优势菌PZ201809121102在2216E培养基上进行活化培养24 h,刮取纯化后的优势菌菌落,重悬于2216E液体培养基中,根据浅黄假单胞菌(Pseudomonasluteola)的培养条件,在37℃摇床过夜培养,培养液12 000 r·min-1离心3 min,收集菌体。采用吸光度检测(OD≈2)和平板计数法,用灭菌海水将菌株配制成最终浓度为108CFU·mL-1的菌悬液,10倍浓度梯度稀释法稀释后为人工回归感染实验备用。实验设置6个浓度组(103CFU·mL-1、104CFU·mL-1、105CFU·mL-1、106CFU·mL-1、107CFU·mL-1、108CFU·mL-1),每个浓度设3个平行组,采用浸浴方式对暂养的健康条斑紫菜丝状体进行感染实验,步骤如下:取每个浓度梯度的500 mL菌悬液分装至1 000 mL锥形瓶中,挑选健康的紫菜附着物贝壳样本2~3片(每片长3~4 cm、宽2~3 cm)放入锥形瓶中,设置不加菌液的灭菌海水健康条斑紫菜为空白对照组。放置于人工光照培养箱中实验{温度:[20±(1~2)]℃;光强:1 000~1 500 lx;光周期:L/D=12 h/12 h;营养盐:NO3--N浓度15mg·kg-1和PO43--P浓度4mg·kg-1}。实验期间每2 d更换一次海水,每次更换原海水体积的1/2(更换海水的同时补充营养盐和菌悬液,保持培养环境的相对稳定)。每日观察,并记录生长情况。发现试验组样本表面出现典型的黄色斑点症状时,刮取病斑部位进行细菌再分离鉴定,同时,将出现黄色病斑的试验组与对照组同步取样,在无菌条件下常规制片,放在显微镜下观察病变情况。
1.7 16S rDNA鉴定
1.7.1 基因组DNA的制备
用移液枪吸取50μL无菌去离子水,挑取平板划线后的病原菌单菌落,随后在100℃水浴仪器中水浴10 min,12 000 r·min-1条件下离心3 min,静置30 s,取上清液做为PCR反应的模板DNA[7]。
1.7.2 PCR扩增与测序
16S rDNA扩增引物:正向引物,27F(5′-AGAGTTTGATCCTGGCCTGGCTCAG-3′);反向引物1492R(5′-TACGGCTACCTTGTTACGACTT-3′)。模板是分离菌株的基因组DNA,按PCR反应体系(50μL)进行特异性扩增。PCR扩增条件为:94℃预变性5 min,94℃变性30 s,60℃复性40 s,72℃延伸40 s,30个循环;最后72℃延伸20 min,4℃保存。
凝胶检测成功的PCR产物送至青岛生物工程技术服务有限公司进行测序,序列片段在GenBank中用BLAST(http://www.ncbi.nlm.nih.gov/blast)进行序列同源性比对,并收集下载与该菌株同属且相似度较高的菌株序列信息作为参照,使用MEGA 6软件构建系统发育树。
1.8 菌株的生理生化特性鉴定
取优势菌PZ201809121102平板划线,挑取形态一致的优势单一优势菌落,制成108CFU·mL-1菌悬液,根据《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》(第九版)[8]用常规生理生化试剂盒(青岛海博生物技术有限公司)对病原菌进行生理生化特性鉴定。
1.9 药物敏感实验
在2216E新鲜固体培养基上培养优势菌PZ201809121102。24 h后,挑取单菌落置于1.5%无菌生理盐水内将其制成浓度为108CFU·mL-1的菌悬液。取100μL菌悬液均匀涂布于2216E固体培养基上,放入药敏纸片,常规培养18 h后,测定抑菌圈直径。参照药敏纸片说明书根据其直径大小进行敏感性分析。抑菌圈直径小于给定最小值的表示为具有耐药性(resistance,R),抑菌圈直径大于给定最大值的表示为高度敏感(sensitivity,S),基于两者之间的则表示为中度敏感(intermediate,I)。
2 结果与分析
2.1 患病藻体临床症状
2.1.1 自然患病藻体临床症状
如图1所示,实验采集的健康紫菜丝状体附着基贝壳体表完好无损,丝状体生长良好(图1-a);患病的紫菜丝状体附着基贝壳体表具有大量黄色斑点(图1-b)。取病灶处解剖可见黄色斑点成片扩散,附着基边缘质脆易碎,病灶严重处出现泛白现象(图1-c)。

图1 健康与患病紫菜的丝状体外观对比Fig.1 Com parison of healthy and pathologicalmaps of P.yezoensis
2.1.2 回归感染患病藻体临床症状
用PZ201809121102菌悬液感染健康条斑紫菜丝状体样本。在13 d时,108CFU·mL-1感染试验组贝壳表面迅速出现明显青黄色斑点(图2-a);继续感染后,贝壳表面出现黄色斑点扩散(图2-b),扩散速度快,斑点颜色加深,附着基样本壳表面出现被腐蚀现象(图2-c)。实验期间,对照组贝壳附着基表面没有出现病变现象(图2-d),浓度低于108CFU·mL-1的试验组贝壳附着基表面无明显黄色斑点。
刮取黄色病斑部位进行细菌再分离和鉴定菌株(编号为PZ201810121030)。通过16S rDNA比对分析结合生化检测分析表明,感染前后优势菌株的生理生化和遗传特性均未发生改变,表明菌株PZ201809121102是此次引起条斑紫菜丝状体黄斑病的病原菌。
2.1.3 感染藻体显微观察
在无菌条件下取感染后患病明显的条斑紫菜丝状体附着基贝壳样本,将贝壳表面多次清洗,并对健康藻体同步取样。分别将患病与健康样本制成的水浸片放置在显微镜下观察发现:对照组条斑紫菜丝状体有大量孢子囊枝,孢子囊由单列椭圆形细胞组成,孢子囊具细胞壁,细胞生长发育成熟(图3-a)。患病条斑紫菜丝状体的孢子囊细胞形态由椭圆形逐渐溶解,细胞壁融化、消失,胞内色素变浅,细胞结构被破坏,整个藻枝融化形成不定形的放散状(图3-b)。
2.2 病原分离与形态观察
菌株PZ201809121102恒温条件下培养24 h后,观察到在2216E培养基上生长的菌落形态最明显。其表面光滑,呈细小圆形,亮黄色,中间突起,匍匐镶嵌于平板培养基之上(图4-a)。革兰氏染色结果表明,该菌为革兰氏阴性杆菌(图4-b)。透射电镜下观察到该菌株有细胞膜(图4-c,见箭头处)、尾部有一根极细长的单端生鞭毛(图4-c),两端钝圆,呈直、短杆状,细胞大小为(0.5~1.0)μm×(1.5~5.0)μm。

图2 人工回归感染条斑紫菜丝状体病变过程Fig.2 Lesion process of P.yezoensis by artificial regression infection
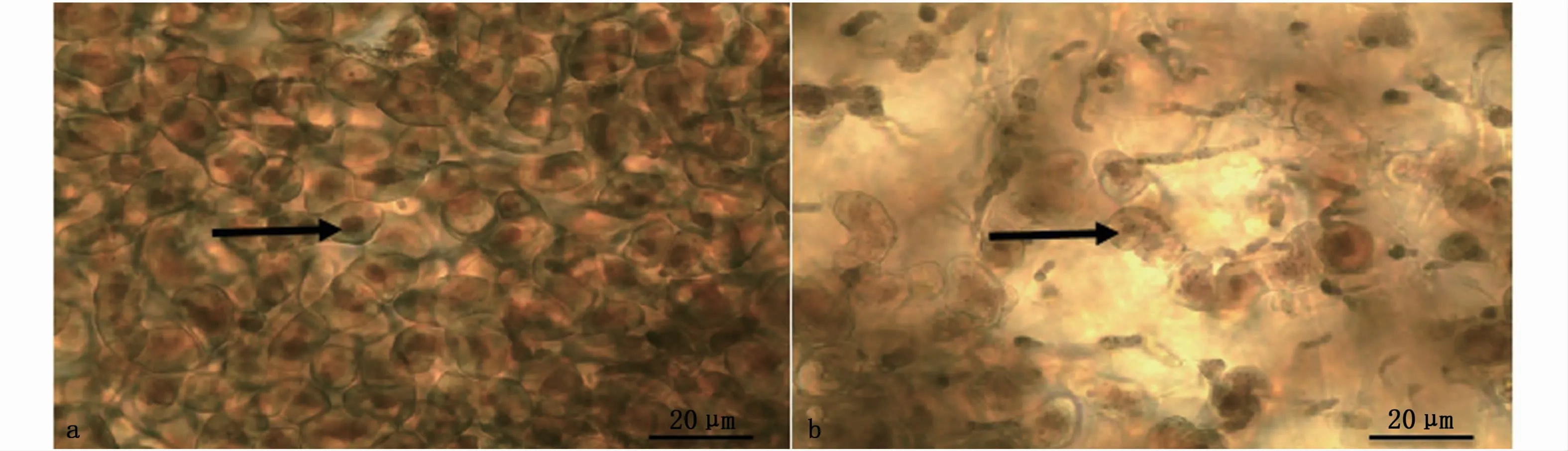
图3 健康与患病紫菜丝状体病变对比Fig.3 Comparison of healthy and pathological filaments of P.yezoensis
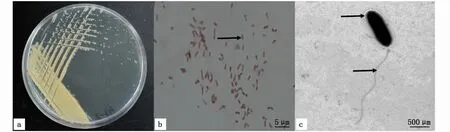
图4 分离菌落PZ201809121102形态Fig.4 M orphological features of strain PZ201809121102
2.3 分子生物学鉴定结果
通过菌株的PCR扩增获得菌株PZ201809121102的16S rDNA序列片段,经电泳检测表明片段大小约1 400 bp。构建系统发育树显示PZ201809121102与浅黄假单胞菌的同源性相似性最高,为100%:在所建系统发育树中也与浅黄假单胞菌聚为一支(图5)。
2.4 菌株生理生化鉴定
生 理生化检测结果表明,菌株PZ201809121102可在无盐胰胨水、6%NaCl胰胨水、10%NaCl胰胨水中生长。氧化酶反应呈阳性,3%NaCl ONPG反应呈阳性,鸟氨酸脱羧酶、赖氨酸脱羧酶、精氨酸双水解酶反应均呈阳性。能代谢利用单糖葡萄糖,不能利用鼠李糖、蜜二糖、蔗糖、乳糖、山梨醇等二糖或多糖。对菌株PZ201809121102进行分类鉴定,初步确定筛选菌株PZ201809121102生理生化特征与浅黄假单胞菌标准菌株LMG21995T相符。具体生理生化鉴定结果见表1。

图5 菌株PZ201809121102的16S rDNA基因序列聚类分析Fig.5 Clustering analysis of bacterial strain PZ201809121102 based on gene sequence of 16S rDNA

表1 分离菌株PZ201809121102生理生化鉴定结果Tab.1 Physiological and biochem ical characteristics of the isolated strain PZ201809121102
2.5 菌株药物敏感性实验
菌株PZ201809121102药物敏感实验结果如表2所示。本研究所选用的36种抗生素中,该菌株对:罗美沙星、氟罗沙星、氯霉素、青霉素、庆大霉素、阿奇霉素、卡那霉素、氟哌酸、头孢他啶等10种药物呈现高度敏感;对利福平、红霉素、吡哌酸、萘啶酸、四环素、头孢唑啉、头孢氨苄、头孢拉定、恩诺沙星、氟苯尼考、阿奇霉素、新生霉素、多粘菌素、氨苄青霉素、苯唑青霉素、二甲胺四环16种药物呈现耐药性。
3 讨论
近年来,随着紫菜养殖规模的迅速扩大和近海养殖环境的恶化,紫菜育苗期病害发生日益频繁。关于海养条斑紫菜育苗期丝状体黄斑病病害发生的致病原研究,国内外还没有统一的结论,有据可查的其病害研究报道最早始于20世纪70年代的癌肿病,国外学者对该病的外观症状、光镜观察等结果作了初步描述,并同时也将其命名为“鲨皮病”[10]。国内学者王洪斌等[11]曾报道,河豚毒素交替假单胞菌(Pseudoalteromonas tetraodonis)是引发条斑紫菜育苗期丝状黄斑病中爆发的一种病原菌。本实验从条斑紫菜丝状体育苗期苗种大规模出现黄斑病的病症现象入手,着手展开了病原学分析。
实验从患病藻体上分离得到一株致病菌PZ201809121102,该菌株鉴定为假单胞菌属的浅黄假单胞菌,它又被称为浅黄金色单胞菌。浅黄假单胞菌菌落呈浅黄色,专性需氧,无芽孢、荚膜,细胞呈杆状略弯,有端鞭毛,能运动,革兰氏阴性杆菌,属于假单胞菌科假单胞菌属,该菌株广泛分布于土壤、潮湿环境中[12-14]。国外关于浅黄假单胞菌研究,报道过该菌可感染人体引发败血症、腹膜炎、脑膜炎等[15]。国内关于浅黄假单胞菌的报道有张海琳等[16]从患病大鲵(Andrias davidianus)病灶处分离鉴定浅黄假单胞菌可使健康鱼体体表肿胀、出血、溃疡和死亡;曹旭等[17]研究报道了浅黄假单胞菌在薄皮甜菜瓜(CucumismeloL.)的病后防治效果及抑菌能力方面是一株潜力生防菌;明德松等[18]分离的浅黄假单胞菌对头孢菌素类、四环素类、酰胺醇类等抗菌药物敏感。
本次实验将浅黄假单胞菌株的菌悬液接种浸染健康条斑紫菜丝状体,笔者发现它对紫菜丝状体具有明显的致病性。该菌悬液浸染藻体时,6个浓度组(103CFU·mL-1、104CFU·mL-1、105CFU·mL-1、106CFU·mL-1、107CFU·mL-1、108CFU·mL-1)进行感染实验,其中以108CFU·mL-1试验组贝壳表面发现丝状体附着物贝壳表面病灶处出现大小不一的黄色斑点最明显,随着感染时间推移,黄色褐斑逐渐向四周扩散,最终出现由藻体死亡导致的溃烂症状;笔者再结合水浸片丝状体镜检观察,分析认为病原菌浸染藻体时,藻体细胞壁作为细胞结构的第一道保护屏障其结构受到损伤,损伤部位随浸染时间的推移,聚集大量病原菌,病原菌在此吸取营养,迅速生长繁殖,导致藻体细胞色素被侵蚀,色素体解体,细胞间质松弛,细胞核逐渐消融,细胞形态由椭圆形逐渐溶解、消失,藻枝融化形成不定形的放散状,藻枝整个细胞结构被破坏,最终导致丝状体细胞消亡,发生黄斑病害。同时,本实验分离得到的浅黄假单胞菌对罗美沙星、氟罗沙星、青霉素、庆大霉素、阿奇霉素、卡那霉素、氟哌酸、头孢他啶种药物呈现高度敏感,而氯霉素是国家禁用渔药,只适合实验研究使用。根据以上实验结果分析讨论,笔者建议条斑紫菜养殖育苗期间黄斑病病害的防控基础重点可从控制养殖区病原菌浓度入手,控制浅黄假单胞菌病原的数量在108CFU·mL-1以下,此外,实验前期流行病学调查过程中发现,暴发疾病的紫菜养殖海区温度快速升高,海水盐度变化时黄斑症病害发生尤为严重,针对养殖区外在环境这一特点的变化,后续研究可以进一步应用感染微生态学原理,建立丝状体黄斑病疾病发生的预警模型和相关防御措施,从而及时预防减轻病害带来的危害。
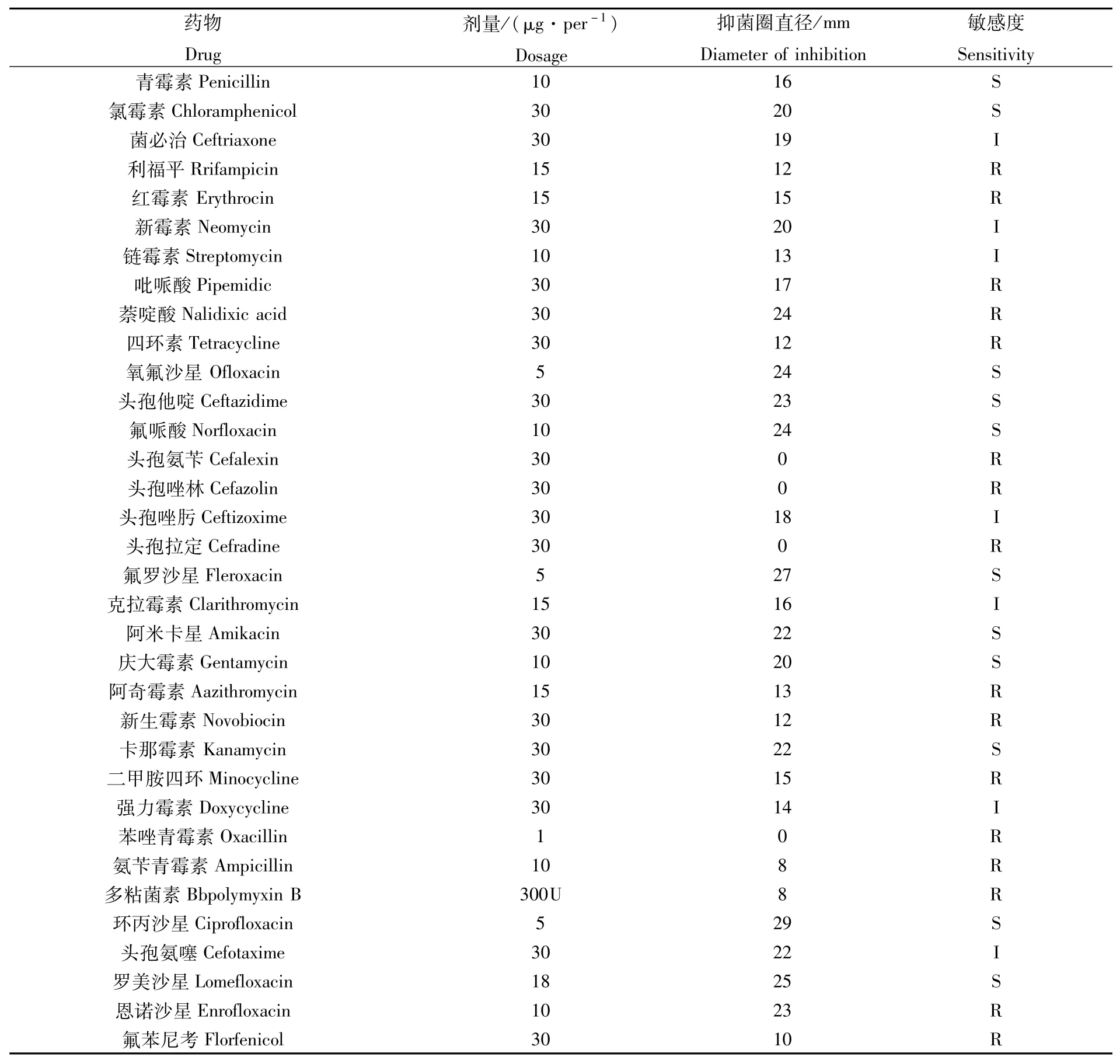
表2 菌株PZ201809121102对抗菌药物的敏感性Tab.2 Sensitivity of the strain PZ201809121102 to some antibacterial drugs
4 小结
本研究于山东省日照市岚山区藻类养殖合作社某紫菜育苗场暴发黄斑病的育苗期条斑紫菜的病灶部位分离出一株优势菌PZ201809121102。通过分子生物学鉴定确定了其属于浅黄假单胞菌,是引发条斑紫菜丝状体黄斑病的一种致病菌。研究结果为条斑紫菜丝状体黄斑病的病原菌种类鉴定及其防治提供了有益参考,为今后深入研究条斑紫菜丝状体黄斑病病害发生的致病因素与浅黄假单胞菌的关系打下基础。

