鼠尾藻活性氧清除系统对UV-B辐射增强的性别差异响应特征❋
鲁佩瑶, 臧 宇, 薛 颂, 孙 燕, 朱美玲, 梁 硕, 唐学玺❋❋
(1. 中国海洋大学海洋生命学院, 山东 青岛 266003; 2. 自然资源部第一海洋研究所, 山东 青岛 266061)
自20世纪80年代以来,人类活动释放的大量消耗臭氧层物质(ODS),如氯氟烃(CFC)、氯烃(CC)、有机溴化物(OB)和一氧化二氮(N2O)等[1]。由于臭氧层被破坏,到达地表的紫外线辐射强度增加了[2]。特别是UV-B(280~315 nm)辐射的增加会影响水生或陆地生态系统中所有受阳光照射生物的生理和生化过程[3-4]。预计未来60年内,到达地表的UV-B辐射强度将会增加2%~40%[5]。UV-B辐射很容易被核酸、脂类和蛋白质吸收,导致光氧化反应的发生[6],进而在分子、细胞和整个生物体水平上产生多种响应[7]。
雌雄异株植物是生态系统中重要的组成部分。有关高等植物的雌株和雄株对环境胁迫的性别差异响应研究已有大量报导[18]。环境胁迫下,雌雄异株高等植物的生长形态、生理生化、生殖分配和空间分布存在着性别差异响应[19]。例如:在盐胁迫下,青杨雄株有更高的渗透调节能力、水分利用效率和抗氧化酶活性[20];银杏(Ginkgobiloba)[21]、葎草(Humulusscandens)[22]、苋麻(Amaranthuscannabinus)[23]等物种雌株有更高的光合速率、水分利用效率和抗氧化酶活性,并具有更强的抗盐能力。而目前,针对于具有雌雄异株特性的低等大型海藻展开的研究较少。
鼠尾藻(Sargassumthunbergii)是北太平洋西部特有的暖温带海藻,在中国潮间带地区均有广泛分布。鼠尾藻为雌雄异株大型海藻,在某些生物学和生态学特性方面也已经表现出一定的性别差异,例如雌、雄生殖托在形态上差异较大,通常雄生殖托较为细长,雌生殖托较为粗短[24-25]。同高等植物类似,雌雄异株的大型海藻对外界环境变化的反应也可能存在不相同的响应特征。由于潮间带大型海藻随潮汐变化,周期性地暴露于空气中,因此与其他海藻相比,潮间带大型海藻更易受到UV-B辐射增强的影响。因此,本研究分别探索了鼠尾藻雌性和雄性藻体在UV-B辐射增强条件下氧化应激指标的变化,初步揭示了雌雄异株大型海藻在生理水平上对UV-B辐射增强的性别差异响应特征,研究结果可为准确评估全球变化对雌雄异株大型海藻的影响提供科学数据,也进一步丰富了雌雄异株植物的生理生态学研究内容。
1 材料与方法
1.1 实验材料的采集及培养
2019年7月在青岛太平角(36°14′58.3″N,120°21′34.2″E)岩质潮间带的岩质上采集实验所用鼠尾藻雌性和雄性藻体,清除藻体表面附加的沙粒、沉积物、小型食草动物和附生杂藻后用灭菌海水多次洗涤备用。实验前在大型藻类培养缸((15±0.5) ℃,光合有效辐射(PAR)强度为150 μmol·m-2·s-1,光周期为12L∶12D)中培养14 d。实验所用的海水与藻类的采集地点相同,过滤后灭菌待用,每2天换1次海水。
1.2 UV-B辐射处理
本实验采用模拟潮间带UV-B辐射增强的大型藻类培养辐照体系[26]进行实验室条件下人工胁迫处理。光源由日光灯管(Philips TL-D,36 W)和UV-B宽频波段灯管提供(Philips TL 40 W/12 RS),使用醋酸纤维素薄膜外包,每周更换滤膜一次,以防止滤膜的老化。通过调整灯管数量、灯管和藻体间距来调节各辐射处理组之间的光照强度。实验前需连续照射15 min以上,从而使UV-B辐射体系达到稳定状态。
市南沿海地区夏季晴天中午,平均UV-B辐射强度为2.29 W·m-2。为简化实验梯度设计,本实验将设置1个对照组和2个处理组,每组分别包含3株雌性藻体和3株雄性藻体,实验周期为5 d,实验分组详见表1。

表1 UV-B辐射处理实验分组体系设置
1.3 活性氧含量测定

1.3.2 H2O2含量测定 准确称取各组藻体组织0.1 g,使用全自动样品研磨仪进行液氮研磨,加入0.9 mL的PBS缓冲液摇匀, 制备出组织匀浆。放入高速冷冻离心机(GL-20G-Ⅱ)中4 ℃下8 000g离心10 min,使用过氧化氢检测试剂盒(S0038,碧云天)测定,使用酶标仪在波长560 nm处测定吸光度。
1.4 膜脂过氧化程度测定
脂质过氧化以TBA反应物质含量为检测指标,根据Heath和Packer的方法进行改进[27]。准确称取各组藻体组织0.1 g,使用全自动样品研磨仪进行液氮研磨,然后加入1 mL的5% (w/v) TCA。摇匀后,于4 ℃下,12 000g离心10 min,收集上清液,用于检测TBA和蛋白质含量。取100 μL上清液,利用Lowry法测定蛋白质含量[28]。取0.5 mL上清液和2 mL硫代巴比妥酸(5%溶解于20%TCA中),95 ℃水浴加热30 min,取出后室温放置20 min。用分光光度计(U-8000)分别在532和600 nm处测定吸光度,消光系数为155 mmol-1·L·cm-1。
1.5 主要抗氧化酶活性测定
采用南京建成生物工程研究所研制的试剂盒测定超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,操作步骤按使用说明书进行,利用Lowry法测定蛋白质含量[28]。
1.6 AsA-GSH循环相关的酶活性测定
采用南京建成生物工程研究所研制的试剂盒测定抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR)活性,采用索莱宝科技有限公司研制的试剂盒测定单脱氢抗坏血酸还原酶(MDHA)和脱氢抗坏血酸还原酶(DHA)活性,操作步骤按使用说明书进行,利用Lowry法测定蛋白质含量[28]。
1.7 AsA-GSH循环相关的物质含量测定
采用南京建成生物工程研究所研制的试剂盒测定抗坏血酸(AsA)、谷胱甘肽(GSH)、氧化性谷胱甘肽(GSSG)含量,采用索莱宝科技有限公司研制的试剂盒测定脱氢抗坏血酸(DHA)含量,操作步骤按使用说明书进行。
1.8 数据处理与统计
所有实验结果均由3个生物学重复实验得到,各组指标的变化均以平均值±标准差(mean±SD)表示。采用IBM SPSS 22.0软件的单因素方差分析(One-way ANOVA)中的多重比较(LSD-t检验)对实验数据进行统计分析,显著性差异水平设置为0.05(P<0.05),使用Sigmaplot 14.0绘图软件进行作图。
2 结果与分析
2.1 鼠尾藻雌、雄藻体活性氧含量的变化

图1 UV-B辐射处理5 d后鼠尾藻雌、雄藻体内活性氧含量的变化
2.2 鼠尾藻雌、雄藻体膜脂过氧化程度的变化
UV-B辐射强度的增加可以导致鼠尾藻雌、雄藻体内细胞膜脂过氧化程度加剧,产生大量丙二醛(MDA)(见图2),低强度处理组中的雌性藻体MDA含量显著高于雄性藻体(P<0.05),高强度处理组中鼠尾藻雌性藻体MDA含量极显著高于雄性藻体(P<0.01)。以上结果表明,UV-B辐射增强条件下,鼠尾藻雌性藻体的膜脂过氧化程度显著高于雄性藻体(P<0.05)。

图2 UV-B辐射处理5 d后鼠尾藻雌、雄藻体内MDA含量的变化
2.3 鼠尾藻雌、雄藻体主要抗氧化酶活性的变化
鼠尾藻雌、雄藻体内的SOD活性随UV-B辐射增强呈现先上升后下降的趋势(见图3),鼠尾藻雄性藻体内的SOD活性显著高于雌性藻体(P<0.05)。鼠尾藻雌、雄藻体内的CAT活性随UV-B辐射增强呈现显著上升的趋势(P<0.05)。2.5 W·m-2UV-B辐射组中鼠尾藻雌性藻体的CAT活性显著高于雄性藻体(P<0.05)。以上结果表明,UV-B辐射增强条件下,鼠尾藻雄性藻体和雌性藻体的SOD和CAT酶活性具有明显的性别差异性。
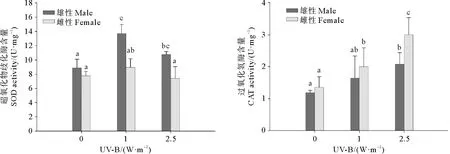
图3 UV-B辐射处理5 d后鼠尾藻雌、雄藻体内主要抗氧化酶活性的变化Fig.3 Changes of major antioxidant enzyme activities in the female and male of S. thunbergii after UV-B radiation treatment for 5 days
2.4 鼠尾藻雌、雄藻体AsA-GSH循环相关酶活性的变化
UV-B辐射处理使鼠尾藻雌、雄藻体内的AsA-GSH循环相关酶的活性上调(见图4)。UV-B辐射增强,鼠尾藻雌、雄藻体内的APX和GPX活性均显著上升(P<0.05),2.5 W·m-2辐射组中鼠尾藻雌性藻体的APX和GPX活性均显著高于雄性藻体(P<0.05)。与对照组比较,随UV-B辐射增强,鼠尾藻雌、雄藻体内的GR活性呈现上升趋势,鼠尾藻雌、雄藻体之间的GR活性差异并不显著(P>0.05)。鼠尾藻雌、雄藻体内的DHAR活性随UV-B辐射增强呈现显著上升的趋势(P<0.05),且雄性藻体的DHAR活性均显著高于雌性藻体(P<0.05)。UV-B辐射增强,鼠尾藻雌、雄藻体内的MDHAR活性显著上升(P<0.05),雌性藻体的MDHAR活性均显著高于雄性藻体(P<0.05)。
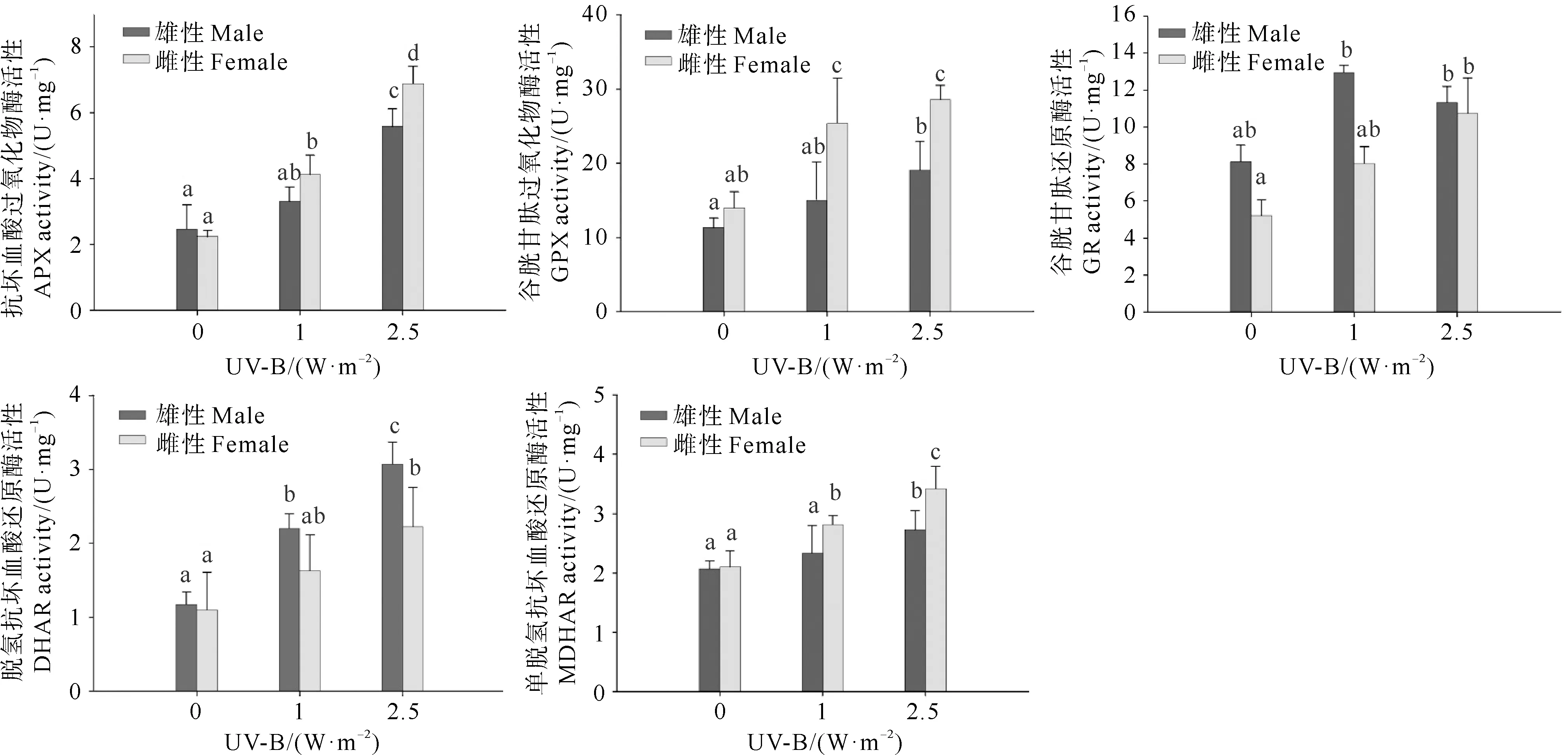
图4 UV-B辐射处理5 d后鼠尾藻雌、雄藻体内AsA-GSH循环相关酶活性的变化Fig.4 Changes of AsA-GSH cycle related enzyme activities in the female and male of S. thunbergii after UV-B radiation treatment for 5 days
2.5 鼠尾藻雌、雄藻体AsA-GSH循环相关物质含量的变化
UV-B辐射处理下,鼠尾藻雌、雄藻体内大多数AsA-GSH循环相关抗氧化剂的含量上升(见图5)。UV-B辐射增强,鼠尾藻雌、雄藻体内的AsA含量先显著上升(P<0.05),后下降,各处理组均高于对照组。2.5 W·m-2辐射组中鼠尾藻雌性藻体的AsA含量显著高于雄性藻体(P<0.05)。与对照组比较,随UV-B辐射增强,鼠尾藻雌、雄藻体内的DHA含量呈现下降趋势,2.5 W·m-2辐射组中鼠尾藻雌性藻体的DHA含量显著高于雄性藻体(P<0.05),鼠尾藻雌、雄藻体内的AsA/DHA比率呈现显著上升的趋势(P<0.05),所有辐射处理组中鼠尾藻雌、雄藻体的AsA/DHA比率均不存在显著性别差异(P>0.05)。鼠尾藻雌、雄藻体内的GSH含量随UV-B辐射增强也呈现显著先上升(P<0.05)后下降的趋势,但均高于对照组。2.5 W·m-2UV-B辐射组中鼠尾藻雌性藻体的GSH含量显著高于雄性藻体(P<0.05)。UV-B辐射增强可以导致鼠尾藻雌、雄藻体内的GSSG含量上升且雌性藻体的GSSG含量高于雄性藻体(P>0.05)。UV-B辐射增强,鼠尾藻雌、雄藻体内的GSH/GSSG比率呈现显著上升的趋势(P<0.05),鼠尾藻雌、雄藻体的GSH/GSSG比率不存在显著性别差异(P>0.05)。以上结果表明,UV-B胁迫处理下,鼠尾藻雌、雄藻体内的AsA、DHA和GSH的含量变化皆存在性别差异性响应,雌性藻体中AsA、DHA和GSH的含量显著高于雄性(P<0.05),GSSG含量和AsA/DHA、GSH/GSSG比率变化虽存在差异但不显著(P>0.05)。

图5 UV-B辐射处理5 d后鼠尾藻雌、雄藻体内AsA-GSH循环相关物质含量和比率的变化Fig.5 Changes of contents and ratio of substances related to AsA-GSH cycle in the female and male of S. thunbergii after UV-B radiation treatment for 5 days
3 讨论
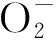

在植物的活性氧清除系统中,AsA-GSH循环对清除环境胁迫下产生的ROS有重要作用[38]。其主要存在于藻类的叶绿体中,GSH通过促进AsA的合成来清除光反应中产生过量的H2O2[39],是光合器官中重要的H2O2代谢途径[40]。APX氧化AsA清除H2O2形成DHA,通过DHAR从GSH中获取电子,再还原为AsA,这些反应的产物GSSG被GR的活性和NADPH的消耗所还原[41]。已有研究证明,在UV-B胁迫下,AsA-GSH循环的关键酶APX和GR的转录水平升高,从而起到活性氧清除作用[42-43]。拟南芥(Arabidopsisthaliana)中也发现了UV-B可提高APX、MDHAR和GR的活性,APX活性并不随DHAR活性的增加而增加,DHAR活性也不随APX活性的增加而增加,UV-B辐射胁迫下拟南芥(A.thaliana)倾向于诱导APX活性而不是DHAR活性[44]。
大型海藻裂片石莼(Ulvafasciata)在低UV-B辐射强度下,AsA-GSH循环水平提高,DHAR、MDHAR和GR活性增加促进AsA和GSH的再生能力提高,起到了维持细胞H2O2平衡的作用,中、高强度UV-B辐射下,AsA-GSH循环受到抑制[45]。
本研究也发现了类似的结果,UV-B辐射增强条件下,鼠尾藻雌、雄藻体通过提高AsA-GSH循环内的APX、GR、DHAR和MDHAR活性,促进体内AsA、DHA、GSH和GSSG之间的相互转化,增加了AsA/DHA和GSH/GSSG比例,提高了AsA和GSH的再生能力,对积累的H2O2进行清除,从而减轻UV-B辐射对藻体的氧化损伤。此循环中雌藻的大多数抗氧化酶活性和抗氧化剂含量高于雄藻,雌性藻体内的H2O2含量低于雄性藻体,说明鼠尾藻雌性藻体和雄性藻体间的活性氧清除能力存在差异。对高等植物青杨(Populuscathayana)雌、雄株在UV-B辐射胁迫下性别的差异变化研究与本研究结果一致,因而认为雄性比雌性具有更有效的抗氧化系统来缓解UV-B胁迫压力[46],表明雄性可能比雌性具有更强的UV-B抗性。与低强度处理组比较,高强度处理组下鼠尾藻雌、雄藻体AsA和GSH含量下降,说明了AsA-GSH循环受到一定抑制,活性氧的清除效率受到限制,因此活性氧含量持续增加。鼠尾藻雌、雄藻体内GSH和AsA含量呈现同样变化,GSH促进了AsA的合成。AsA/DHA和GSH/GSSG的高比值表明,鼠尾藻雌、雄藻体均有DHA向AsA、GSSG向GSH快速再生的能力,雌藻与雄藻之间的AsA和GSH再生能力没有性别差异性。
4 结语
本文对鼠尾藻雌、雄藻体分别进行了实验室条件下的UV-B辐射处理,研究了鼠尾藻在UV-B辐射增强条件下,活性氧清除系统的性别差异响应特征。UV-B辐射增强条件下,鼠尾藻雌、雄藻体的活性氧清除系统都发挥了保护作用,雌性藻体的H2O2含量低于雄性藻体,所测得的多数抗氧化酶活性和抗氧化剂含量高于雄性藻体,表明在UV-B辐射增强条件下,雌性藻体的活性氧清除能力高于雄性藻体。

