海洋源性胶原蛋白用做组织工程材料的研究进展❋
樊廷俊, 李 琨, 赵 君
(中国海洋大学海洋生命学院, 山东 青岛 266003)
胶原蛋白是动物界中最丰富的细胞外基质蛋白,属于纤维蛋白家族,在进化中高度保守,广泛存在于韧带、肌腱、附睾等结缔组织以及胃肠道和泌尿生殖道在内的大多数中空器官中,并且在皮肤的真皮、角膜、巩膜、软骨和骨骼中含量也很丰富[1]。目前为止,根据其结构差异已经鉴定出至少29种胶原,其中人体超过90%的胶原蛋白是Ⅰ型,而其他常见的胶原蛋白类型包括Ⅱ、Ⅲ和Ⅳ型等。胶原蛋白不但为组织和器官提供了关键的结构支撑,更为细胞提供了高度生物相容性的环境。鉴于上述优点,胶原蛋白现已广泛用于3D细胞培养及药物递送等各个领域,同时高生物相容性、可生物降解性,易得性及低免疫原性等特性,使得胶原蛋白成为组织工程用生物材料的理想来源[2]。
传统上,商业胶原蛋白主要从陆生哺乳动物(例如牛和猪)中提取,然而,近年来牛海绵状脑病、可传播性海绵状脑病和口蹄疫的爆发,日益增加了人们对使用陆生动物胶原蛋白和胶原衍生产品的担忧。同时,陆生哺乳动物胶原存在纯化困难且造价昂贵等问题。此外,由于宗教信仰,印度教禁用牛胶原蛋白,伊斯兰和犹太文化禁用猪胶原蛋白。因此,迫切需要开发一种新的胶原蛋白来源,以替代陆生哺乳动物的胶原蛋白[3-4]。
地球超过70%的面积被海洋所覆盖,海洋生物是生物活性化合物的丰富来源。迄今为止,已经从海洋资源中分离出多种生物成分。其中,海洋源性的胶原蛋白不但在氨基酸组成和生物相容性方面与传统的陆生哺乳动物胶原蛋白相似,且比哺乳动物胶原蛋白有着更高的优势,表现在来源广泛、易于提取、不存在病原微生物污染且具有稳定的化学和物理特性等,特别是在鱼类加工业和渔业活动中,鱼和海胆的废料、尺寸过小的鱼以及副渔获物(例如水母、海星、海绵等)含有丰富的胶原蛋白,可能会成为重要但未被充分利用的胶原蛋白来源[3]。鉴于胶原蛋白在进化中具有高度保守性,广大的科研工作者便将目光投向了海洋生物胶原,这掀起了研究海洋生物胶原的热潮,其作为组织工程领域中重要的生物材料的可能性日益增加。因此,本文对海洋源性胶原蛋白的来源、特性及提取工艺进行了概述,并对其目前作为生物材料在组织工程中的应用进展进行了重点阐述,同时展望了海洋源性胶原蛋白作为理想组织和器官再生材料来源的可能性。
1 海洋胶原蛋白的主要来源
海洋环境是胶原蛋白和生物活性物质的重要来源,按照动物类型不同,目前海洋胶原蛋白基本可以来源于两类:一类为海洋无脊椎动物,包括海蜇、海胆和水母等[5-16];另一类为海洋脊椎动物,包括鱼和各种海洋哺乳动物[17-25]。目前,从海洋生物中提取的胶原蛋白用于组织工程生物材料的研究主要集中在海洋鱼类、水母及海绵等,这些海洋生物的皮肤、肌肉、软骨组织及中胶层等部位含有丰富的胶原蛋白[4]。
海洋鱼类中,胶原蛋白通常是从肉、皮肤、骨头、鳍、鳞片和鱼渣中提取得到,以Ⅰ型胶原蛋白为主。提取的鱼胶原蛋白通过纯化,其小分子片段可以用于化妆品的制备及营养等领域,其大分子则经过进一步加工形成功能性生物材料,用于组织工程的支架,包括胶原海绵、凝胶、复合材料和膜等。来源于海洋鱼类的胶原蛋白目前大部分来自加工业产生的鱼类废物,研究表明从这些丢弃物中提取的胶原蛋白的干质量可达50%以上。因此,这种废料具有被开发为生态友好且低成本的胶原蛋白来源的巨大潜力[17-24]。
水母是一类胶质状的浮游生物,属刺胞动物门,在中国近海海域分布广泛。来源于水母的胶原蛋白主要是从水母中胶层中提取得到的,包括Ⅰ、Ⅱ、Ⅴ及Ⅺ型胶原蛋白,目前作为组织工程用生物材料已被用于伤口敷料及鼻软骨的修复等[9-10]。
海洋海绵是最原始的多细胞动物,其主要成分是碳酸钙或碳酸硅以及大量的胶原蛋白,已知其含有Ⅳ型胶原蛋白。研究发现海绵胶原蛋白可以提高皮肤成纤维细胞的增殖速度并保护其免受紫外线诱导的细胞死亡,有望用于皮肤的光老化修复[13-16]。
海洋胶原蛋白还可以从鲸鱼、海豹、海獭和北极熊等海洋哺乳动物中提取。例如小须鲸腹沟中可以提取到Ⅰ型胶原蛋白,提示其可以作为陆生哺乳动物胶原蛋白的替代物[25]。然而,直到现在,海洋哺乳动物仍很少被用于胶原蛋白的开发。本文作者对过去十年中从海洋来源获得的不同类型的胶原蛋白及其潜在用途进行了总结(见表1)。

表1 海洋源性胶原蛋白的主要来源、类型及应用领域
2 海洋胶原蛋白的特性
众多数据证明,海洋源性的胶原蛋白具有与陆生动物胶原蛋白相似的理化性质。与陆生动物来源的Ⅰ型胶原蛋白相比,源自海洋硬骨鱼的Ⅰ型胶原蛋白被发现其胶原α1和α2链与陆生动物表现出高度的结构相似性[26]。然而海洋源性胶原蛋白在稀酸溶液中表现出的极高溶解度说明,其与陆生动物胶原蛋白一定具有不同的特性[27]。
2.1 氨基酸组成
海洋源性胶原蛋白的生化组成被发现与哺乳动物胶原蛋白不同。之前的研究已经证明,海洋源性胶原蛋白的氨基酸组成与哺乳动物胶原蛋白类似,其中甘氨酸是最丰富的氨基酸,占所有氨基酸的30%以上。然而在海洋源性胶原蛋白中,特别是在冷水鱼胶原蛋白中,亚氨基酸(包括脯氨酸和羟脯氨酸)的含量低于哺乳动物胶原蛋白的含量,但其含有更多的丝氨酸和苏氨酸残基[27]。这些氨基酸组成的差异,特别是羟基脯氨酸含量的差异,会导致胶原蛋白性质的变化,表现在刚度、热稳定性和变性温度的变化中,而更高含量的亚氨基酸会使胶原蛋白的稳定性增加[28]。
2.2 热稳定性
胶原中,羟脯氨酸和羟赖氨酸的羟基通过链间氢键结合到羰基基团上,从而增加了胶原三螺旋的热稳定性。因此,脯氨酸和赖氨酸的含量直接影响胶原蛋白的热稳定性。海洋源性胶原蛋白的亚氨基酸含量较低,因而其变性温度低于哺乳动物胶原蛋白的变性温度。同时,生活在寒冷环境中的鱼类(例如鲑鱼)所产生的胶原蛋白的羟脯氨酸含量较低(35%~37%),与生活在温暖环境中的鱼类(例如罗非鱼胶原蛋白的羟脯氨酸含量约为43%)相比,其胶原蛋白的热稳定性也较低[29]。因此,鱼胶原蛋白的亚氨基酸含量与其热稳定性相关,并与它们正常栖息地的水温相关。
另外,由于海洋源性胶原蛋白的变性温度低于哺乳动物的体温,因此放置在高于37 ℃下海洋源性胶原蛋白会发生融化现象。源自温水鱼类(包括罗非鱼)的胶原蛋白可以表现出与哺乳动物胶原蛋白相似的氨基酸组成、流变特性和热稳定性[30],这提示温水鱼类胶原蛋白有望作为哺乳动物胶原蛋白的替代品而用于生物医学中。
与陆地脊椎动物胶原蛋白相比,较低的变性温度和黏度也阻碍了海洋源性胶原蛋白作为生物材料应用于组织工程中,尤其是鱼类来源胶原蛋白的支架的制备。目前这一问题已经通过体外化学交联稳定胶原蛋白,实现了对胶原原纤维形成的改善。用于稳定胶原蛋白的交联方法可分为物理处理(例如使用UV辐照、γ辐照或脱氢热处理)和化学处理(例如使用戊二醛、碳二亚胺或1-乙基-3-(3-二甲基-氨基丙基)-碳二亚胺(EDC))[31]。尽管化学处理可导致其存在潜在的细胞毒性或较差的生物相容性,但化学处理可显著提高胶原蛋白支架的强度和稳定性,而物理处理仅可提供足够的稳定性,因此在组织工程中,化学处理被广泛的应用于海洋源性胶原蛋白生物材料的制备中。
3 海洋胶原蛋白的提取与制备技术
按照不同的来源,对海洋源性胶原蛋白的提取有不同的方法,但从鱼副产品和其他海洋资源中分离胶原蛋白的通用步骤一般包括准备、提取和回收。
3.1 胶原蛋白的分离准备
准备工作包括清洁、分离动物部位以及通过切割或切碎样品来减小尺寸,为接下来的化学预处理做准备。对于鳕鱼、鲑鱼和大马哈鱼等鱼类来说,因为各部分胶原蛋白组成不同,一般会对其皮肤、鱼鳞、鱼鳍和骨头分别进行提取[19, 22, 24]。对于鱿鱼等软体动物来说,一般采用机械方法将其皮肤与鱿鱼体分开[11]。对于水母来说,一般将其口腕与伞分开,然后再将伞分成中胚层、上伞和下伞后进行提取[9-10]。
准备工作还包括化学预处理,通常使用氢氧化钠去除非胶原蛋白、色素或脂肪成分,该预处理方法不会对胶原链造成结构改变。但是,去除鳕鱼皮肤上的非胶原蛋白时,使用氯化钠替代氢氧化钠[19]。另外,为了从骨、软骨和鳞中脱矿质,可以使用乙二胺四乙酸(EDTA)或稀盐酸进行预处理[32]。
3.2 胶原蛋白的提取
对于提取阶段,由于胶原蛋白的三重螺旋结构存在强交联,因此它在冷水中的溶解度很差。目前有2种常规的提取方法:酸增溶的胶原蛋白的提取和胃蛋白酶增溶的胶原蛋白的提取。使用这2种方法提取的胶原蛋白的产量、化学组成和特性互不相同。
当仅使用酸进行胶原蛋白提取时,该产品称为酸溶性胶原蛋白。为了从海洋动物组织中提取胶原蛋白,最常使用的是终浓度0.5 mol/L的乙酸,但也使用柠檬酸和乳酸。大约95%的海洋无脊椎动物(例如水母)由水组成,这会影响胶原蛋白在乙酸中的溶解度[9-10]。因此,为了改善胶原蛋白在稀酸中的溶解度增加提取产量,必须将水母进行匀浆或冷冻干燥。另外利用酸处理联合调节pH值以及超声等物理处理的方式时,与常规提取工艺相比,提取产量可以显著提高[33]。
在提取过程中添加胃蛋白酶提取的胶原蛋白称为胃蛋白酶可溶性胶原蛋白。这种处理非常有效,因为蛋白酶可在不破坏三螺旋结构完整性的情况下切割端肽交联的区域,从而水解某些非胶原蛋白并增加胶原蛋白的纯度[34]。但是,长时间使用大量胃蛋白酶可能会导致胶原蛋白裂解,损害三螺旋结构的完整性,从而导致胶原蛋白产量的降低。
3.3 胶原蛋白的回收
在回收步骤中,通常通过添加终浓度2.3~2.6 mol/L的氯化钠溶液沉淀胶原蛋白。通过离心收集所得沉淀物,将其溶于0.5 mol/L乙酸溶液中,透析并冷冻干燥即可得到胶原蛋白。其中水母胶原蛋白的回收可以通过在0.5 mol/L的乙酸溶液中增溶3 d,然后利用Na2HPO4溶液进行透析。沉淀的胶原通过离心再添加固体氯化钠进行分离,最后溶解于乙酸并通过再沉淀得到。也可以用胃蛋白酶消化以获得胶原[33]。鱼鳞的处理方法也可以参照上述步骤[23]。
海胆的胶原蛋白不同于其他胶原,不能通过传统的水解胶状物的酸增溶方法来提取。因此,在海胆胶原蛋白的提取中,需先将天然组织切碎,继而依次利用低渗溶液和SDS-脱细胞溶液处理以除去细胞碎片、骨骼和色素,然后将其加到β-巯基乙醇溶液中放置3~4 d后,通过过滤并在0.5 mol/L EDTA-Na溶液中透析获得胶原蛋白。使用相同的方案可以从海星腕臂中提取到胶原蛋白,但是在脱细胞后,样品需要增加额外的步骤以去除新鲜组织中存在的碳酸钙小骨[35]。
4 海洋胶原蛋白在组织工程生物材料中的应用
组织工程学是生命科学领域中一个新兴且迅速发展的跨学科领域,它利用工程学和生物学原理将细胞与支架有机结合,从而促进受损或患病组织或器官的再生。其中,支架是由多种生物材料制成的3D结构,是细胞附着和维持生长的重要支撑载体。生物材料大分子的化学组成、结构和排列方式决定了支架的机械性能和生物学特性,并进而影响附着细胞的形态、行为和功能。
在选择适合于组织工程应用的生物材料时,应考虑多种关键因素,包括:(1)生物材料的来源;(2)适合细胞生存的机械特性;(3)最佳的生物相容性,以促进细胞贴附、增殖和分化;(4)适合于各种形状和尺寸的制造方法。
应该选择合适的生物材料来制造支架。在可用的生物材料类型中,合成聚合物因其良好的加工特性而被广泛用于支架的制备,缺点在于其具有疏水性因而缺少细胞结合位点进而无法很好的为细胞提供附着。天然聚合物,包括多糖(透明质酸、藻酸盐、壳聚糖和纤维素等)和蛋白质(胶原蛋白、明胶、纤维蛋白、丝素蛋白和角蛋白等),由于其高生物相容性,可以出色的促进细胞黏附和生长,因而可以作为理想的生物材料用于支架的制备。然而,天然聚合物通常不具有良好的机械性能,并且热稳定性较合成聚合物低,因而需要化学改性或复合制备才能满足支架的制备要求。海洋源性胶原蛋白通过化学改性或复合制备后表现出较陆生动物胶原蛋白更好的热稳定性及机械性能,提示其可能成为组织工程最有前途的生物材料[36](见图1)。
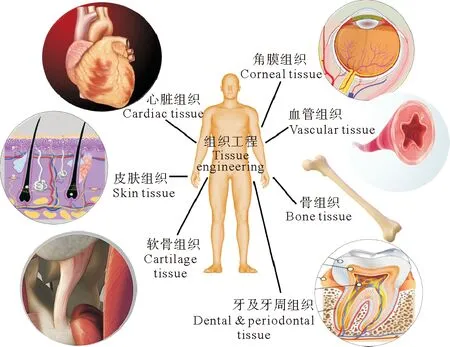
图1 海洋源性胶原蛋白作为支架在组织工程领域的应用[36]
4.1 海洋胶原蛋白在骨和软骨组织工程及再生中的应用
骨再生是一个复杂的骨形成过程,不但可以在正常的骨折愈合过程中观察到,且在整个成年生活中都有持续的骨再生。但是,在个别复杂的临床情况下,需要大量的骨再生,例如由于创伤、感染、肿瘤切除或骨骼异常引起的缺损和损伤而导致的大骨骼重建、再生过程中骨受损,包括无血管性骨坏死、萎缩性骨不连和骨质疏松等。目前,有很多不同的策略可以修复受损的骨或帮助骨再生,包括“金标准”自体骨移植、游离腓骨血管化移植、同种异体移植、骨传导性支架及骨祖细胞移植等。以生产具有生物力学特性的组织工程骨移植替代物正成为最有效的治疗方式,其中大量海洋源性胶原蛋白已经用于组织工程中,如骨组织和软骨组织的体外构建。
从罗非鱼鳞片中提取的水解鱼胶原蛋白可以诱导大鼠骨髓间充质干细胞的多向分化,其中水解鱼胶原蛋白不仅可以提高细胞活力,还可以显著上调成骨标志物和内皮标志物的表达,这表明水解鱼胶原蛋白具有促进细胞向成骨和内皮细胞分化的作用[37];从鳕鱼的骨骼和皮肤中提取的鱼胶原蛋白可以促进人成骨细胞的增殖及成骨标记物的表达,提高骨特异性碱性磷酸酶活性和矿化速度[38];用鳕鱼和鲽鱼胶原蛋白处理的成骨细胞MC3T3-E1中胶原蛋白修饰酶的基因表达显著上调,并且在培养物中产生更多的胶原蛋白沉积。与对照组相比,胶原蛋白表现出更大程度的赖氨酸羟化、更高水平的羟赖氨酸-醛衍生的交联和更快速度的基质矿化[39]。这些结果暗示鱼胶原蛋白具有显著促成骨细胞分化的活性,有望作为组织工程骨的生物材料。
已有研究报道了来自鲑鱼皮肤的胶原蛋白对成年大鼠股骨发育的影响[40]。来自这项研究的数据进一步说明海洋源性胶原蛋白不仅增加了血清骨钙素和碱性磷酸酶的含量,而且还增加了实验动物生长中股骨的大小、矿物质密度以及股骨的刚度和韧性,这表明这种胶原蛋白可以促进成年雄性大鼠长骨的发育。
因而基于上述胶原蛋白的特性,目前已有大量研究提出了通过模仿天然骨组织微环境,体外构建基于胶原蛋白的组织工程支架,从而加速骨组织的再生。如通过优化的冷冻干燥方法,使用来源于鲨鱼皮的胶原蛋白和鲨鱼牙齿的磷灰石,制备了胶原蛋白/磷灰石复合支架,用于硬组织的体外构建[41]。这种胶原蛋白/磷灰石复合支架有效地提高了人类骨肉瘤细胞的活力,表明其有望用于骨再生治疗。
以相同的方式,使用蓝鲨的Ⅱ型胶原蛋白通过冻干开发了胶原蛋白/羟磷灰石/壳聚糖复合海绵,可以用于组织工程软骨的体外构建,结果发现这种用羟磷灰石矿化的基于胶原蛋白/羟磷灰石的复合海绵有效地促进了成骨细胞的增殖活性并显著提高了成骨细胞碱性磷酸酶的活性,表明其可以作为替代哺乳动物胶原蛋白的组织工程软骨应用的合适生物材料[42]。矿化的鲑鱼胶原蛋白、藻酸盐和原纤维化的水母胶原蛋白经冷冻干燥和交联制备,从而开发出新型的基于胶原蛋白纤维的坚韧双网络复合水凝胶。这种支架能够促进骨髓源性人的间充质基质细胞的软骨形成和成骨分化,同时,植入兔缺损软骨模型4周后,该支架在体内表现出出色的生物力学性能,暗示了其应用于体外软骨构建的潜能[43]。另外从水母中提取的胶原蛋白用冷冻干燥法制成的胶原支架,可以使人和大鼠鼻中隔软骨细胞在其上正常生长,并促进细胞分泌软骨基质蛋白。在这项研究中,基于水母胶原蛋白的支架能够预防大鼠模型中的间隔穿孔,表明该胶原蛋白支架可以用于鼻软骨修复[44]。再者,由原纤维化水母胶原蛋白和藻酸盐构建的水凝胶混合支架可以增加人的间充质干细胞向软骨细胞分化[45]。临床研究也证明,海洋源性胶原蛋白有效促进骨关节炎患者的软骨基质合成并减轻其疼痛,上述结果提示,海洋源性胶原蛋白有望治疗人骨关节炎和骨质疏松症,并帮助骨再生,因此,被用作组织工程的潜力候选生物材料[46]。
如今海洋源性胶原蛋白在骨及软骨再生中展现出了巨大的潜力,且利用交联及复合高强度物质联合制备的方式有效改善了这类材料无法应用于硬组织重建的不足,然而目前尚未有标准的可用来参考的交联方法可以稳定制备出力学性能方面与天然骨相匹配的胶原蛋白支架。此外,身体组织通常是具有弹性的,这种弹性会直接影响或调控细胞的行为,包括成骨分化和矿化基质沉积等。因而如何在增强支架的硬度的同时兼顾支架的弹性,可能是未来需要研究的重点和难点。
4.2 海洋胶原蛋白在皮肤组织工程和皮肤修复中的应用
几个世纪以来,由烧伤、创伤、感染、移植排斥、疤痕、遗传缺陷和其他疾病的广泛存在,人们对皮肤缺陷替代品的需求日益旺盛。通常情况下,正常的伤口愈合过程可分为3个阶段,分别是:(1)止血和炎症反应阶段;(2)细胞增殖分化阶段;(3)组织重建或瘢痕形成阶段。理想的皮肤替代品要求其组织相容性好、植入或覆盖创面不与机体发生不良反应且能治疗或代替机体中的缺损组织,促进创伤愈合和修复。其中,利用胶原蛋白制备的组织工程皮肤修复物已取得显著的研究进展,同时也已有大量团队开展了对利用海洋源性胶原蛋白制备组织工程皮肤的研究[5, 17, 22]。
通过氨解将罗非鱼的鱼鳞胶原蛋白掺入P(3HB-co-4HB)共聚物中,能让L929小鼠成纤维细胞更好地在复合支架上附着、生长和增殖。体内研究表明,P(3HB-co-4HB)中加入1.5%的鱼鳞胶原蛋白还可对伤口收缩有显著影响, 7 d内达到最高的伤口闭合率(61%),表明该鱼胶原蛋白支架可以用于皮肤伤口愈合[47]。
从印度鲮鱼鳞片中分离的Ⅰ型胶原蛋白可作为蛋白支架支持人类原代成纤维细胞和角质形成细胞的有效生长和增殖,在该支架上将成纤维细胞和角质形成细胞进行三维共培养后,可加快伤口愈合速度并在体外形成分层的表皮层结构,证明其可作为皮肤替代品进行使用[48]。
利用电纺丝技术制备的鱼胶原蛋白/生物活性玻璃(Col/BG)纳米纤维,除拉伸强度得到有效改善外,并具有对金黄色葡萄球菌的抗菌活性,用作皮肤伤口敷料可有效防止病菌感染。另外Col/BG纳米纤维不仅可以促进人类角质形成细胞的黏附、增殖和迁移,还可以促进细胞中Ⅰ型胶原和血管内皮生长因子的分泌,从而进一步刺激了人血管内皮细胞的增殖。大鼠伤口模型结果表明,Col/BG纳米纤维可以有效地诱导伤口区域的皮肤再生,说明其具有被用作伤口敷料的巨大潜力[49]。
从海洋海绵中分离出的胶原蛋白能刺激小鼠巨噬细胞、小鼠成纤维细胞和人角质形成细胞的细胞存活和增殖,证明其具有显著的抗氧化活性并保护细胞免受紫外线诱导凋亡,表明该种海洋源性胶原蛋白具有促伤口愈合和光保护特性,可用于修复受损或光老化的皮肤[50]。
4.3 海洋胶原蛋白在血管组织工程中的应用
由于各种疾病(包括心血管疾病、外周血管疾病和局部缺血)而需要替代血管的患者数量不断增加,因此不仅迫切需要理解和掌握脉管系统发育和分化的机制,而且还需要能够体外制备血管移植物或人造血管和淋巴管的能力。在过去的10年中,血管组织工程领域取得了长足的进步。这其中,海洋源性胶原蛋白已被接受并证明是血管组织工程的有效替代支架材料,广泛应用于多种生物医学领域。如有研究使用甲基化修饰和1,4-丁二醇二缩水甘油醚(BDE)交联来改善鱼鳞来源的胶原蛋白的理化特性,在无生长因子的条件下,在鼠模型中观察到了胶原蛋白支架良好地整合到周围组织中,并具有良好的细胞、血管和淋巴管浸润,验证了鱼鳞来源的胶原蛋白作为血管支架材料的潜在应用价值[51]。
通过冷冻干燥和静电纺丝制成了来自水母胶原蛋白和聚乳酸-羟基乙酸共聚物(PLGA)的管状支架,在脉冲灌注系统下使用胶原蛋白/ PLGA混合支架对兔原代平滑肌细胞和血管内皮细胞进行共培养后,可以有效促进血管内皮细胞的增殖,并且还能诱导类似于体内的天然血管样的细胞的定向排列,提示胶原蛋白/PLGA支架在组织工程血管移植中具有良好的应用前景[52]。然而不可忽视的是,虽然海洋源性胶原蛋白的免疫原性较陆生哺乳动物低,但血管系统仍有可能对利用其构建的血管移植物引起机体炎症反应,因此在当前阶段仍需不断探索和改进海洋源性胶原蛋白在血管组织工程中的应用模式。
4.4 海洋胶原蛋白在牙组织工程中的应用
牙齿的结构是独特的,软组织和硬组织同时存在,包括3种硬组织(牙釉质、牙本质、牙骨质)和1种软组织(牙髓)。在过去的10年中,牙组织工程领域朝着修复式的新概念发展,取得了巨大进步。
从罗非鱼鳞片分离出的Ⅰ型胶原蛋白可促进细胞的活力,增加细胞的附着力,提高碱性磷酸酶的活性,并在大鼠成牙本质细胞样细胞(MDPC-23)中上调骨唾液蛋白的基因表达,并加速基质矿化,这表明鱼胶原蛋白可以用于牙再生[53]。且鱼胶原蛋白还能提高了人牙周膜细胞的活力,并通过激活ERK信号通路上调成骨标志物和成骨相关蛋白的表达,表明鱼胶原蛋白是一种有前途的可供生物活性牙槽骨再生中使用的生物材料的成分[54]。
电纺丝技术制备的罗非鱼鱼胶原蛋白/生物活性玻璃/壳聚糖纳米纤维膜对变形葡萄球菌具有一定程度的抗菌活性,并可增强人牙周膜细胞的细胞黏附性、细胞活力和成骨基因的表达。在犬中该支架还促进了牙周缺损犬模型的骨再生,证明了其在临床上作为诱导牙周组织再生具有巨大的潜力[55]。
4.5 海洋胶原蛋白在角膜组织工程中的应用
角膜损伤是患者失明的主要原因之一,当无法使用其他治疗方法矫正视力时,角膜移植是最佳的治疗方法。然而,供体的老龄化及短缺严重制约了角膜移植手术的开展。尽管目前已将包括羊膜及脱细胞角膜基质在内的不同生物材料用作角膜修复材料,并发现它们具有出色的生物相容性,但基于胶原蛋白的组织工程角膜也已取得了重大突破,并表现出了卓越的特性。
如用脱细胞和脱钙的鱼鳞胶原蛋白作为人类供体角膜组织的替代物,在大鼠眼部植入后,显示出良好的生物相容性、足够的透光率、合理的光散射值以及可用于角膜移植的能力,表明鱼胶原蛋白可用于角膜移植以应对供体角膜的短缺[56]。
通过冷冻干燥从鱼鳞中合成的鱼胶原支架显示出良好的机械强度、更好的溶胀率和更强的微生物抵抗力,且能使角膜上皮细胞更好地生长、增殖和迁移,提示鱼胶原可以作为角膜再生和移植的生物材料[57]。
最近的研究中,樊廷俊等[58]利用来自太平洋鳕鱼的纯化鱼皮胶原体外构建出了三维鱼类胶原支架,为其作为载体支架用于组织工程角膜的体外构建研究提供了可能。同时鉴于胶原蛋白对疤痕的修复作用,利用胶原蛋白作为支架可能对移植后的角膜基质的伤口有促进愈合作用。基于胶原蛋白的生物材料构建的组织工程角膜不但可以用于供体的替代物,还可以用于角膜修复和疤痕的抑制,值得进一步深入研究。
4.6 海洋胶原蛋白在神经组织工程中的应用
神经系统是人体的重要组成部分,无论是受伤还是疾病造成的损害,都可能导致严重或潜在的致命后果。由于复杂的生理系统和有限的再生能力,恢复受损的神经系统是一个巨大的挑战,因此迫切需要针对患有神经系统疾病的患者的治疗策略进行创新,用组织工程化的神经移植物替代周围神经自体移植物从一定程度上解决了缺乏神经组织的问题。
有研究报道,利用EDC/NHS对来源于罗非鱼的胶原蛋白进行化学交联后,可以制备出与脑组织硬度相似的凝胶支架,且在神经诱导的早期阶段,刚度约为1 500 Pa的凝胶可促进人诱导多能干细胞向背皮质神经元细胞的分化[59]。这些发现表明,模仿大脑僵硬的鱼胶原蛋白凝胶具有确定终末神经亚型的潜力,有望用于神经再生。
甲基丙烯酸酯化是另外一种改善鱼类胶原蛋白强度的有效手段。有研究表明,通过将甲基丙烯酸酯化和UV交联可以显著提高来源于红鲷鱼的胶原蛋白的机械性能,将体外负载NSC-34运动神经元细胞的胶原蛋白生物墨水和骨骼成肌细胞的甲基丙烯酸化水凝胶生物墨水进行共轴3D打印后可以形成结构化的神经肌肉接头模型[31]。
虽然已有开展基于海洋胶原蛋白在组织工程神经再生中应用的研究,然而后续依然存在大量需要深入解决的问题,包括如何将海洋胶原蛋白用于复合神经细胞物的培养。另外与其他组织相比,大脑的细胞外基质含有较高比例的糖胺聚糖以及较小比例的胶原蛋白和其他纤维蛋白,鉴于此,海洋胶原蛋白必须与其他多糖类材料进行复合制备,才有望成为理想的神经元建模支架。
5 展望
在过去的几十年中,海洋源性胶原蛋白因其天然来源丰富且与陆生动物胶原蛋白具有相似的结构,已成为一种有前途的生物医学应用材料。此外,它具有生物相容性、生物降解性、抗微生物活性、功能性、水溶性、易提取性、安全性和低生产成本的优点,使其成为了可广泛应用于各种组织工程(包括骨、软骨、皮肤、血管、牙齿和角膜组织再生)的生物材料。而且,海洋源性胶原蛋白的加工条件灵活,取自鱼类加工业和渔业活动的周边成分,大大加强了这些“废料”的高值化应用。同时,其通过化学改性或复合制备后表现出的高热稳定性及优异的机械性能,更是弥补了陆生动物胶原蛋白的诸多不足。尽管海洋源性胶原蛋白所制备支架影响机体结构和生物力学特性,以及其对细胞生长和分化的信号调控途径仍然没有完全查清楚,但毋庸置疑的是,海洋源性胶原蛋白作为一种可用于开发组织工程产品的生物材料必将具有广阔的应用前景。

