缝隙连接蛋白26在肺腺癌相关成纤维细胞中的表达及临床意义
宋锦静 韦彤彤 梁凯 黄志广 陈罡 茅乃权 阳洁
肺癌是全球癌症相关死亡的主要原因之一,每年新诊断180万例,死亡160万例[1],肺腺癌是肺癌最常见的组织病理学亚型,约占肺癌的40%,且患病率和死亡率逐年上升[2]。因此,探讨肺腺癌发生发展机制有重要意义。缝隙连接蛋白(connexin,Cx)是一个多基因编码的跨膜蛋白家族。研究表明肿瘤发生发展过程中,常伴随Cx表达异常和(或)Cx形成的半通道、缝隙连接功能异常[3],在胃癌、乳腺癌等癌组织及转移部位均表达且与预后相关[4]。Cx26是Cx家族β亚型成员,结构包括4个可跨膜结构域、2个胞外环结构域、2个细胞质N端、2个细胞质环和2个高度可变的细胞质C端结构域[3],既往研究发现其在肺腺癌、乳腺癌、胰腺癌等肿瘤增殖、迁移、侵袭以及化疗敏感性方面发挥重要的调控作用[5⁃9]。肿瘤微环境中最主要的细胞成分肿瘤相关成纤维细胞(cancer⁃associated fibroblasts,CAFs)可通过细胞间通讯、释放细胞因子或趋化因子、调节信号通路和抗肿瘤免疫反应等调控肿瘤细胞的生物学特性[10⁃12]。但肺腺癌微环境中CAFs是否表达Cx26及Cx26是否参与肺腺癌的发生发展尚不清楚。本研究通过分离手术切除肺腺癌组织及正常肺组织中的CAFs和正常肺成纤维细胞(nor⁃mal lung fibroblasts,NLFs)进行原代培养,并采用qRT⁃PCR和组织免疫荧光染色法分别检测CAFs及肺腺癌组织中Cx26的表达及分布情况,探讨CAFs中Cx26的表达变化及其与肺腺癌发生发展的关系。
1 材料与方法
1.1 细胞株及主要试剂
人肺腺癌细胞株A549购自中科院上海研究所细胞库,用含10%胎牛血清和1%青霉素⁃链霉素的RPMI⁃1640培养基置于37℃、5% CO2的培养箱中培养。RPMI⁃1640、DMEM、青霉素⁃链霉素和胎牛血清购自Thermo Fisher Scientific公司。RIPA裂解液和BCA蛋白定量试剂盒购自Solarbio公司。PMSF购自Sigma公司,磷酸酶抑制剂购自AbMole Bioscience公司。总RNA提取试剂RNAiso Plus、逆转录试剂盒Prime⁃Script™ RT reagent Kit with gDNA Eraser、qRT⁃PCR扩增染料TB Green®Premix Ex Taq™Ⅱ购自TAKARA公司。一抗和荧光二抗:GAPDH购自Proteintech公司,α⁃SMA、E⁃cadherin、Vimentin购自CST公司,Cx26购自Thermo Fisher Scientific公司,Anti⁃rabbit lgG(H+L)购自CST公司,Alex488⁃驴抗兔和Alex⁃488⁃羊抗鼠购自Abcam公司。
1.2 临床标本收集
收集2018年11月至2019年5月广西医科大学附属肿瘤医院胸瘤外科手术切除的肺腺癌组织及癌旁新鲜组织(定义为距离肿瘤边缘>5 cm)标本,用于原代成纤维细胞提取分离。另收集2013年1月至2018年12月手术切除的肺腺癌组织及癌旁组织石蜡切片,用于Cx26免疫荧光染色分析。纳入标准:⑴年龄>18周岁;⑵符合卫生部医政司发布的《原发性肺癌诊疗规范》(2011年版)中原发性肺腺癌的诊断标准;⑶术前未行任何放化疗治疗;⑷临床病理及随访资料完整。排除标准:⑴其他部位肿瘤肺部转移者;⑵有传染性疾病,如结核、乙肝、艾滋病等。本研究经广西医科大学医学伦理委员会审核通过(2018年第029号),所有患者均签署知情同意书。
1.3 原代成纤维细胞的提取分离
在超净台下将癌组织和癌旁组织用PBS清洗后剪碎为约1 mm3大小的组织块,放入装有含10%胎牛血清和1%青霉素⁃链霉素的1 mL DMEM完全培养基的T25组织培养瓶中,于37℃、5% CO2培养箱中培养。原代成纤维细胞从组织中生长出来后,更换新鲜培养基。当细胞融合度达到50%时,在显微镜下刮去瓶中的上皮细胞,取出组织块。然后进行传代培养,本研究用到的原代成纤维细胞均为2~6代。
1.4 Western blot检测 CAFs标志物 α⁃SMA、E⁃cad⁃herin和Vimentin蛋白的表达
细胞融合度达90%~100%时,按照试剂说明书加入裂解液提取细胞蛋白,采用BCA定量法测定各组细胞蛋白浓度。蛋白样品按每孔30 μg用10% SDS⁃PAGE分离胶和5% SDS⁃PAGE浓缩胶电泳分离。将蛋白转移到PVDF膜上后,用5%脱脂牛奶室温封闭1 h,加入一抗4℃孵育过夜。次日室温下用PBST洗膜3次,加入相应二抗孵育1 h,PBST洗涤后,用双色红外成像系统扫膜,Image J软件对蛋白条带进行灰度值分析。以肺腺癌上皮细胞A549作为阳性对照细胞。
1.5 免疫荧光染色检测CAFs标志物α⁃SMA、E⁃cad⁃herin和Vimentin的表达
将细胞爬片放入6孔板,细胞消化后均匀接种至培养板中。待细胞生长状态良好、融合度适宜,用预冷PBS轻缓洗涤细胞爬片2次,4%多聚甲醛4℃固定1 h,1% Triton100通透30 min,一抗4℃孵育过夜。次日,用PBS洗涤3次,Alex488⁃驴抗兔37℃孵育1 h。PBS洗3次,加入DAPI染核5 min,洗涤3次,用甘油封片。在激光共聚焦显微镜下观察并拍照。
1.6 qRT⁃PCR检测CAFs和NLFs中Cx mRNA表达水平
提取细胞总RNA并反转录成cDNA,ABI 7500实时荧光定量PCR仪检测CAFs和NLFs中Cx的mRNA表达水平。反应体系:TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)(2')10 μL,正向引物(10 μmol/L)0.8 μL,反向引物(10 μmol/L)0.8 μL,ROX Reference Dye Ⅱ(50')0.4 μL,cDNA 2 μL,灭菌水6 μL。反应条件:95 ℃ 5 min;95 ℃ 5 s,60 ℃ 34 s,40个循环;95℃ 10 min,60℃ 15 s,95℃ 5 s。用GAPDH作为内参,2−ΔΔCt法计算mRNA相对表达量。引物序列:Cx25正向 5'⁃CCTTCACTTCTGGTGGTTTTAC⁃3',反向5'⁃CCTGGGCTGACATAGAGTTTC⁃3';Cx26正向5'⁃CTCACCGTCCTCTTCATTTTTC⁃3',反 向 5'⁃GAT⁃GGGGAAGTAGTGATCGTAG⁃3';Cx30.3正 向 5'⁃ACAACCTGAGCAAGAAGCG⁃3',反向5'⁃TAATCCTT⁃GTAGAGGCGGTG⁃3';Cx31正向 5'⁃ACAACGCAG⁃GCAAGAAGCA⁃3',反向5'⁃AGGTCGGGCAATGTAG⁃CAGT⁃3';Cx31.1正向 5'⁃AGGAGAAGAGGCACC⁃GAGAA⁃3',反向5'⁃TTGGGGTAGAATGAGTGGAAC⁃3';Cx37正向5'⁃CCTACCTCGTGGACTGCTTT⁃3',反向5'⁃GATGAGTCCAACCACCAACA⁃3';Cx40正向5'⁃GAGGAAGGGAATGGAAGGA⁃3',反向5'⁃GGGATAC⁃GTAACAGTTGACCG⁃3';Cx45正向 5'⁃TGGGAGAT⁃GCTTCATTTAGG⁃3',反向5'⁃AGCATTGGACAGTTC⁃GGTG⁃3';Cx46正向5'⁃CGCGGACTTCAAACTGCTA⁃3',反向5'⁃GCCCAGTTCTGCTCAGTCAT⁃3';Cx47正向 5'⁃CGCCCTACTGAAAAGACGGT⁃3',反向 5'⁃CCATCTCACAGAGGTTGAGCA⁃3'。
1.7 免疫荧光染色检测肺腺癌及癌旁组织中Cx26的分布与表达
组织病理切片70℃烤片5 h,二甲苯⁃梯度乙醇⁃双蒸水梯度脱蜡、水化,柠檬酸/柠檬酸钠缓冲液(pH=6)进行高压抗原修复,高压上汽5 min后停止,降至室温取出切片。修复后的切片用PBS洗涤2次,然后用5%BSA室温封闭1 h。按说明书比例配置Cx26一抗,切片置于湿盒中4℃孵育过夜;次日37℃复温1 h,PBS洗涤3次,荧光二抗Alex488⁃羊抗鼠37℃孵育1 h。PBS洗涤后,DAPI染核,PBS洗涤3次,用甘油封片。在激光共聚焦显微镜下观察并拍照记录Cx26染色情况,用Image J软件进行半定量分析。
1.8 统计学方法
采用SPSS 19.0软件进行统计分析。计量资料以均数±标准差(±s)表示,配对样本的均数比较采用配对t检验,多组间均数比较采用单因素方差分析,若组间差异有统计学意义,等方差条件下多重比较采用LSD检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
共28例患者符合标准纳入分析,6例用于原代成纤维细胞提取分离,根据AJCC第八版TNM分期标准ⅡB期、ⅢA期和ⅢB期各2例;22例用于组织免疫荧光染色:Ⅰ期9例,Ⅱ期7例和Ⅲ期6例。28例患者中男性13例,女性15例,男性平均年龄(57.85±8.83)岁,女性平均年龄(59.40±8.11)岁,入组患者均未发生转移。
2.2 原代CAFs和NLFs分离及鉴定
6例肺腺癌组织及其配对肺正常组织中均成功分离得到原代NLFs和CAFs,见图1A~B。在光学显微镜下观察可见原代NLFs和CAFs细胞均呈纺锤形,两者细胞形态无明显差异,见图1C~D。
图1 原代CAFs和NLFs分离及鉴定Fig.1 Isolation and identification of primary CAFs and NLFs
Western blot检测结果显示,A549细胞、NLFs和CAFs中 α ⁃SMA(F=533.879,P<0.001)、Vimentin(F=718.935,P<0.001)和 E⁃cadherin(F=1113.790,P<0.001)表达量差异有统计学意义。多重比较显示,与NLFs和CAFs相比,A549细胞表达E⁃cadherin,仅少量表达Vimentin、α⁃SMA(均P<0.001),见图2A。免疫荧光结果显示,与A549细胞相比,CAFs和NLFs均表达间质细胞标志物Vimentin、α⁃SMA,但仅微量表达上皮细胞标志物E⁃cadherin,见图2B~D。
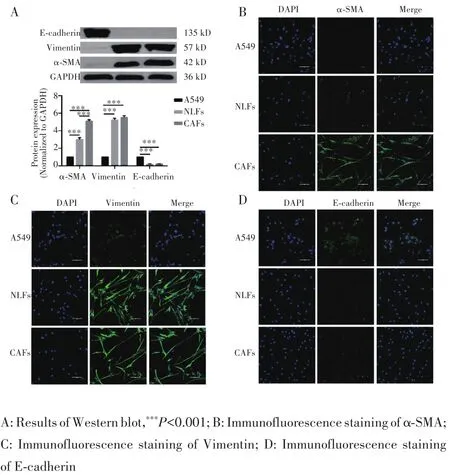
图2 Western blot和免疫荧光染色检测α‐SMA、Vimentin和E‐cad‐herin的表达情况(×200)Fig.2 Expression of α‐SMA,Vimentin and E‐cadherin detected by Western blot and immunofluorescence staining(×200)
2.3 qRT⁃PCR检测Cx在CAFs和NLFs中的表达
采用qRT⁃PCR对原代培养的CAFs和NLFs中10种Cx表达情况进行检测。结果显示,与NLFs相比,Cx26和Cx31在CAFs中表达下调,而Cx30.3在CAFs表达上调,见图3A。其中Cx26在Ⅱ期患者组织样本中略微下调,在Ⅲ期患者组织中表现为明显下调(t=5.684,P=0.011),见图3B。表明Cx26低表达与肺腺癌更高临床分期及恶性进展有关。

图3 qRT‐PCR检测Connexin在6对NLFs和CAFs的表达情况Fig.3 Expression of connexin in six pairs of NLFs and CAFs detected by qRT‐PCR
2.4 Cx26在肺腺癌组织中的表达
免疫荧光染色检测结果显示,C x 26主要表达于细胞质,基质中也有分布,见图4A~B。免疫荧光半定量分析显示,肺腺癌组织中的免疫荧光强度低于癌旁正常肺组织(t=3.114,P=0.005),见图4C;肺腺癌组织中Cx26的表达量低于其配对的癌旁正常肺组织(t=2.609,P=0.016),见图4D。
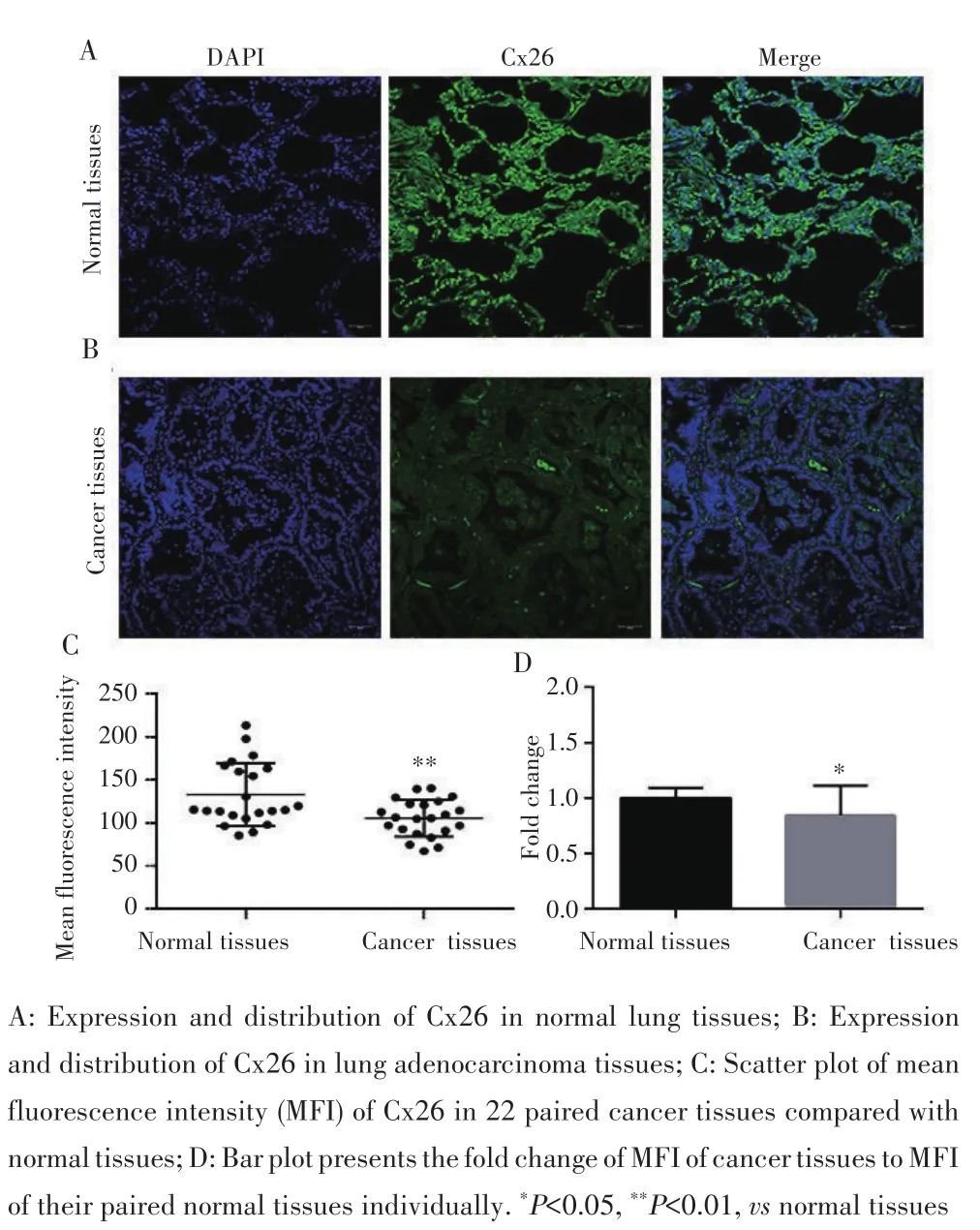
图4 免疫荧光染色检测Cx26在肺腺癌组织和癌旁正常肺组织的表达(×200)Fig.4 Expression of Cx26 protein in lung adenocarcinoma tissues and normal tissues detected by immunofluorescence staining(×200)
3 讨论
CAFs是肿瘤微环境中的主要细胞成分,主要来源有静息态成纤维细胞被激活,上皮细胞向间充质细胞转化和内皮细胞向间充质细胞转化[13]。因此,原代CAFs鉴定除了通过其纺锤形的细胞形态学特征,还可以通过分子标志物进行鉴定。目前常用的鉴定CAFs分子标志物包括间充质细胞标志物Vimentin[14]、肌成纤维细胞和活化成纤维细胞标志物α⁃SMA(ACTA2)[15]、成纤维细胞活化蛋白 α(FAP⁃α)[16]、血小板衍化生长因子受体 α(PDGFRα)[17]和成纤维细胞特异蛋白1(FSP1)[18]等。通常采用间充质细胞标志物阳性、肌成纤维细胞标志物阳性、活化成纤维细胞标志物阳性、上皮细胞标志物阴性、内皮细胞标志物阴性和免疫细胞标志物阴性等纳入和排除标准相结合的方法。排除上皮细胞污染常用上皮细胞标志物E⁃cadherin、上皮特异性抗原、上皮细胞黏附分子和细胞角蛋白[14,16,19⁃20]。排除内皮细胞或免疫细胞污染则常用内皮细胞标志物CD31和免疫细胞标志物CD45等[19⁃20]。原代成纤维细胞的提取分离通常采用组织块贴壁培养法[14⁃15]和胶原酶消化法[19⁃20]。本研究采用组织块贴壁培养的方式分离成人肺腺癌组织中原代CAFs和配对正常肺组织中的原代NLFs,观察到CAFs与NLFs都具有纺锤形细胞形态学特征,并且利用肺腺癌上皮细胞A549作为上皮细胞阳性对照,结合成纤维细胞标志物α⁃SMA(+)、间质细胞标志物Vimentin(+)和上皮细胞标记物E⁃cadherin(−)作为鉴定标准,说明成功分离了肺腺癌相关CAFs和NLFs。
不同Cx亚型具有不同功能,可依赖于通道功能发挥作用也可独立于通道功能。既往研究支持Cx为肿瘤抑制因子,但最近证据表明,在某些类型肿瘤中Cx可促进特定阶段肿瘤进展,具有组织和阶段特异性[3,21]。本研究通过qRT⁃PCR检测肺腺癌相关CAFs的Cx表达情况,发现仅Cx26在Ⅱ期样本呈略微下调或无显著变化,而Ⅲ期样本表现为明显下调,且免疫荧光染色结果发现Cx26在肺腺癌组织中的表达量明显低于正常肺组织,提示Cx26与肺腺癌发生发展有关。
综上所述,本研究发现肿瘤微环境中CAFs的Cx26在肺腺癌组织低表达,且分期越高其表达量降低越明显。提示Cx26在肺腺癌发生发展中可能发挥抑癌因子作用,但本研究用于分离原代成纤维细胞临床样本数量较少,纳入的临床分期尚未全面,因此其确切的作用有待扩大样本量及后续的功能实验进一步探索。

