齐墩果酸通过调控IL-6/STAT3信号通路影响结肠癌细胞的增殖和凋亡
桂孟玹,黄彬,王瑞国,林久茂*(1.福建中医药大学中西医结合研究院,福州 3501;.福建中医药大学药学院,福州 3501;3.福建省中西医结合老年性疾病重点实验室,福州 3501;4.中西医结合基础福建省高等学校重点实验室(福建中医药大学),福州 3501)
结直肠癌(CRC)是人类最常见的恶性肿瘤之一,其发病率越来越高,目前已成为世界第三大高发癌症[1]。CRC 的发生和炎症密切相关,促炎细胞因子的过度分泌可以促进肿瘤的发展和转移[2-3]。近年来研究表明,白介素 6 (interlenkin-6,IL-6)及其受体的信号通路参与了CRC 的发生、发 展[4-5]。IL-6 与IL-6 受 体(IL-6R)的 结合会启动细胞内信号传导级联反应,从而激活转录激活因子3(signal transducer and activator of transcription 3,STAT3)增强局部炎症环境,STAT3 持续的激活会引起肿瘤细胞的增殖、凋亡失衡,进一步促进肿瘤进展[6]。
当前CRC 的治疗主要通过手术切除并配合化疗药物以提高生存率,并降低术后的肿瘤复发和转移,但由于化疗药物对正常细胞亦具有杀伤作用,容易引起严重的毒副反应,导致患者的生存质量下降[7-8]。目前,已有研究报道使用中草药辅助抗肿瘤,并取得了不错的效果[9-10]。白花蛇舌草是目前已有应用于辅助治疗CRC 的中草药,其主要药效成分齐墩果酸(oleanolic acid,OA)是一种五环三萜类化合物,具有显著的抗炎、抗肿瘤、护肾、保肝等作用[11-14]。近年来,基于具有明确药效的中草药,从其中发掘中草药药效活性成分并开发成单体药物是当前中西医结合临床治疗重大疾病的热点。有研究表明,OA 对多种恶性肿瘤细胞具有抑制增殖的作用,但其药效功能研究尚未完全阐明,药效作用机制有待进一步明确[15]。因此,本研究以人结肠癌HT-29 细胞为对象,评价OA 对HT-29 细胞的增殖和凋亡的影响,并通过研究OA 对IL-6/STAT3 信号通路的调控作用,为该化合物防治结肠癌提供理论研究基础。
1 材料
1.1 试药
齐墩果酸(OA,批号:O5504)、白介素 6(IL-6,批号:I1395)(美国Sigma 公司);人结肠癌HT-29 细胞(中国科学院细胞库)。DMEM 培养基(批号:SH30022.01)、胎牛血清(FBS,批号:10099-141)、青霉素-链霉素(批号:15070063)、胰蛋白酶-EDTA(批号:25200-056)、TRIzol 试剂(批号:12183555)、Caspase-3 活力试剂盒(批号:037-100)(美国Invitgen 公司);抗Bcl-2、Bax、CyclinD1、CDK4、p15、p-STAT3、STAT3、β-actin 单克隆抗体及辣根过氧化物酶(HRP)偶联的二抗(Cell Signal Technology 公司,批号分别为:15071、89477、55506、12790、36303、9145、9139、3700、7074)。BCA 蛋白检测试剂盒(批号:kgabca)、DAPI 染色试剂盒(批号:kga215)(南京凯基生物科技有限公司)。
1.2 仪器
酶标仪(Infinite M200, TECAN,瑞士), 倒置显微镜(Leica DMIL LED,Solms,德国),荧光显微镜(Leica DMI4000B,Solms, 德国), 凝胶分析系统(Model Gel Doc 2000,Bio-Rad Laboratory,美国)。
2 方法
2.1 细胞培养
细胞在含有10%FBS、100 U·mL-1青霉素和100 μg·mL-1链霉素的DMEM 培养基中,37°C,5%CO2环境下培养,以贴壁单层形式生长。
2.2 实验分组设置
实验设置空白对照组、IL-6(10 ng·mL-1)处理组和不同浓度OA(40、80、120 μmol·L-1)+IL-6(10 ng·mL-1)组。
2.3 MTT 法检测细胞增殖情况
当细胞密度达到70%~80%后,使用胰酶消化细胞,在3000 r·min—1,离心5 min 后,弃去上清,用DMEM 完全培养基重新悬浮,并稀释成1×105个·mL-1。以100 μL 每孔接种到96孔板中,在37°C 孵育24 h 后,按照分组加入OA和/或IL-6 处理24 h,然后每孔加入100 μL MTT(0.5 mg·mL-1),继续孵育4 h,加入100 μL 二甲基亚砜溶解紫色甲瓒晶体。用酶标仪于570 nm处检测吸光度(A)值,计算细胞活力。细胞活力(%)=实验组A值/对照组A值×100%。
2.4 倒置显微镜观察细胞密度变化
HT-29 细胞以2.5×105个·mL-1的密度,每孔2 mL 的体积接种于6 孔板中。按照分组加入OA 和/或IL-6 处理细胞24 h,用倒置显微镜观察细胞形态,观察细胞密度变化。
2.5 DAPI 染色和Annexin V/PI 流式细胞仪检测细胞凋亡
将HT-29 细胞以1×105个·mL-1的密度接种于12 孔培养板中,每孔1 mL 细胞悬液,按照分组加入OA 和/或IL-6 处理细胞24 h 后,用无菌PBS 洗涤细胞,4%多聚甲醛固定10 min,室温下用DAPI(4 μg·mL-1)染色10 min,再用无菌PBS 清洗,在荧光显微镜下观察。
为了验证OA 是否可以诱导HT-29 细胞凋亡,将2.5×105个·mL-1的HT-29 细胞 以2 mL 的 细胞悬液体积接种于6 孔板中,按上述方法同样处理HT-29细胞后,根据厂家说明书,采用FACSCalibur细胞分析仪(BD Biosciences)和Annexin V-/PI 试剂盒进行流式细胞仪检测细胞凋亡率。
2.6 Caspase-3 活力测定
根据Caspase-3 活力测定试剂盒说明书,通过比色分析来测定Caspase-3 的活性。按照分组加入OA 和/或IL-6 处理HT-29 细胞24 h 后,用试剂盒提供的裂解缓冲液在冰上裂解HT-29 细胞30 min。裂解细胞在16 000×g 下离心10 min,用BCA 法测定上清液中的蛋白质浓度。随后,将100 μg 蛋白与50 μL Caspase-3 的特定底物在37°C 的避光条件下孵育2 h,使用酶标仪在405 nm 波长处测定吸光度,计算Caspase-3 活力。
2.7 细胞周期分析
将2 mL 的2.5×105个·mL-1HT-29 细 胞接种于6 孔板中,按照分组加入OA 和/或IL-6处理HT-29 细胞24 h 后,收集细胞,并调整细胞浓度至2×105个·mL-1,碘化丙啶(PI)细胞周期分析试剂盒染色后,用荧光激活细胞分选法检测细胞周期进程。将细胞置于70%乙醇中,于4℃条件下固定过夜,然后用预冷的PBS 洗涤两次,再用核糖核酸酶(8 μg·mL-1)和磷脂酰肌醇(10 μg·mL-1)孵育30 min。通过流式细胞仪的FL1 通道检测荧光信号,并使用ModFit LT 软 件(版 本3.0;Verity Software House,Inc.,Topsham,ME,USA)分析细胞周期各时相中DNA 的比例。
2.8 集落形成实验
将处于指数生长期培养的HT-29 细胞以1×105个·mL-1的密度接种到12 孔培养板中,按照分组加入OA 和/或IL-6 处理HT-29 细胞24 h,随后收集细胞以1×103个·mL-1,每孔2 mL的细胞悬液接种到6 孔板中。在37°C、5%CO2的细胞培养箱中孵育8 d 后,将形成的细胞集落固定在4%多聚甲醛中10 min,结晶紫染色计数。
2.9 Western blot 分析
将2×105个·mL-1的HT-29 细胞接种于25 cm2培养瓶中,按照分组加入OA 和/或IL-6 处理HT-29 细胞24 h 后,收集细胞样本,用含有不同蛋白抑制剂的RIPA 裂解缓冲液裂解细胞,用BCA 法测定总蛋白浓度,从每个细胞裂解液中提取等量的蛋白质,经SDS-PAGE 电泳后转移到PVDF 膜上,用5%脱脂奶粉封闭2 h,并与相应的抗STAT3、p-stat3、CyclinD1、CDK4、Bcl2、BAX 或β-actin(稀释倍数,1∶1000)一抗在4°C 下孵育过夜,用适当的辣根过氧化物酶偶联二抗结合ECL 化学发光试剂,对不同指标进行检测,并做图像分析。
2.10 反转录-聚合酶链反应(RT-PCR)分析
将2×105个HT-29 细胞接种于含有2 mL 完全DMEM 培养基的6 孔板中,按照分组加入OA和/或IL-6 处理HT-29 细胞24 h 后,用TRIzol 试剂提取总RNA,用SuperScript 反转录酶(Promega Corporation)反转录1 μg 的RNA。PCR 法检测Bcl-2、Bax、CyclinD1、CDK4、p15 mRNA 的表达,以GAPDH 作为内参。通过凝胶电泳(1.5%琼脂糖凝胶)分析样品,并使用凝胶分析系统分析DNA条带。
2.11 统计学分析
数据采用SPSS 24.0 统计软件进行处理。结果用±s表示;先进行正态性检验和方差齐性检验,满足条件者,两组比较采用t检验;未满足条件者,两组比较用 Wilcoxon 秩和检验。
3 结果
3.1 OA 对HT-29 细胞生长有抑制作用
MTT 比色法检测OA 对IL-6 刺激下HT-29 细胞活力的影响。如图1 所示,与对照组相比,IL-6刺激使HT-29 细胞的存活率明显提高,其活力值为145.49% (P<0.05)。40、80、120 μmol·L-1的OA 干预24 h 后,IL-6 刺激的细胞存活率下降,具有明显的浓度依赖性。为了进一步验证这些结果,通过倒置显微镜观察OA 对HT-29 细胞密度的影响。如图2 所示,OA 处理可剂量依赖性地降低HT-29 细胞的密度。综上所述,OA 可抑制IL-6刺激后HT-29 细胞的生长。

图1 OA 对HT-29 细胞增殖能力的影响Fig 1 Effect of OA on the proliferation of HT-29 cells

图2 OA 对HT-29 细胞密度的影响(200×)Fig 2 Effect of OA on HT-29 cell density (200×)
3.2 OA 诱导HT-29 细胞凋亡
图3 结果表明,与空白对照组相比,10 ng·mL-1IL-6 刺激后凋亡细胞比例无明显改变(P>0.05)。相反,OA 以剂量依赖的方式显著增加早期和晚期凋亡细胞的百分比,与单独用IL-6刺激的细胞相比,差异有统计学意义(P<0.05)。此外,DAPI 染色检测了凋亡的HT-29 细胞的细胞形态、细胞质凝聚和细胞核碎裂的程度。图4 结果显示,经OA 处理的HT-29 细胞的细胞核染色较未经OA 处理的HT-29 细胞染色强度更强,表明OA可促进HT-29 细胞凋亡。

图3 Annexin V/PI 流式细胞仪检测OA 对HT-29 细胞凋亡的影响Fig 3 Annexin V/PI flow cytometry of OA on HT-29 cell apoptosis

图4 DAPI 染色观察OA 对HT-29 细胞凋亡的影响(200×)Fig 4 DAPI staining of OA on the apoptosis of HT-29 cells (200×)
3.3 OA 可诱导HT-29 细胞中Caspase-3 的活化
Caspase-3 的激活通过比色法进行检测。Caspases 是胞质内天冬氨酸特异性半胱氨酸蛋白酶,是细胞凋亡反应中的关键蛋白。Caspases的激活对执行凋亡功能非常重要。如图5 所示,IL-6 可抑制Caspase-3 的活化。而OA 可显著诱导HT-29 细胞Caspase-3 的活化,且呈剂量依赖性。与IL-6 刺激的HT-29 细胞相比,差异有统计学意义(P<0.05)。
3.4 OA 阻断HT-29 细胞G1/S 期进程

图5 OA 对HT-29 细胞Caspase-3 活力的影响Fig 5 Effect of OA on the Caspase-3 activity of HT-29 cells
在细胞周期中,G1期向S 期的转换是细胞调节细胞周期进程从而调节细胞增殖的两个主要检查点之一。因此,通过PI 染色和荧光激活细胞分选分析,研究了OA 对HT-29 细胞G1向S 期进程的影响。如图6 所示,未经处理的对照组、IL-6刺激的HT-29 细胞和IL-6 刺激的HT-29 细胞经不同浓度的OA(分别为40、80、120 μmol·L-1)处理后,S 期细胞比例分别为33.67%、34.81%、29.19%、26.31%和21.30%。此外,采用集落形成实验检测了OA 对HT-29 细胞周期的影响。如图7 所 示,40、80、120 μmol·L-1的OA 作 用24 h,可使IL-6 刺激的细胞集落形成率分别降低至79.68%、35.44%和23.00%(P<0.05)。这些结果表明,OA 通过阻断细胞周期从G1期到S 期的进程来抑制HT-29 细胞的增殖。

图6 OA 对HT-29 细胞周期的影响Fig 6 Effect of OA on the cell cycle of HT-29
3.5 OA 抑制IL-6 介导的HT-29 细胞STAT3 活化
许多人类癌细胞株,包括HT-29,在体外并不组成性地表达p-STAT3,本研究通过给予HT-29 细胞外源性IL-6 刺激来诱导STAT3 的激活,并对细胞裂解产物进行Western blot 分析以确定STAT3 在Tyr705 处的磷酸化水平。如图8 所示,IL-6(10 ng·mL-1)刺激HT-29 细胞后,p-STAT3蛋白表达水平显著升高,而OA 显著抑制其磷酸化,且呈剂量依赖性。
3.6 OA 下调HT-29 细胞中Bcl-2、Bax、CyclinD1、CDK4、p15 的表达
为探讨OA 对IL-6 刺激HT-29 细胞后的作用机制,采用RT-PCR 和Western blot 方法检测OA 对IL-6/STAT3 信号通路的重要靶基因表达水平的影响。这些基因包括抗凋亡的Bcl-2,促凋亡的Bax、p15以及促增殖的CyclinD1和CDK4。如 图9 所示,IL-6 刺激后这些基因的mRNA 表达水平均无明显变化,而在蛋白水平上,IL-6 刺激可明显引起CyclinD1 和CDK4 的表达升高,对Bcl-2、Bax、p15 的表达无明显变化。而经过OA 处理后,OA 可显 著 降低IL-6 介导 的Bcl-2、CyclinD1、CDK4三个基因的表达;可上调Bax和p15的基因和蛋白的表达水平,但在不同浓度的OA 处理的HT-29 细胞中,促凋亡Bax 的表达水平显著升高。
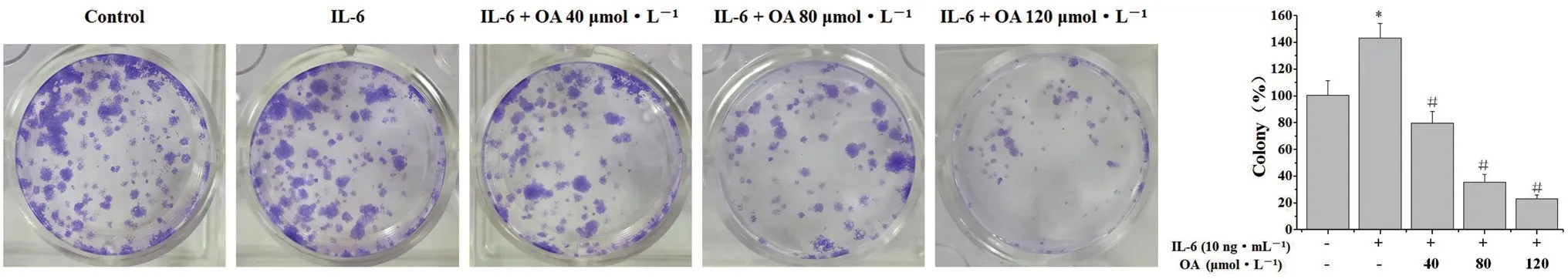
图7 OA 对HT-29 细胞集落形成能力的影响Fig 7 Effect of OA on the colony forming ability of HT-29 cells

图8 OA 对HT-29 细胞STAT3 活化的影响Fig 8 Effect of OA on the activation of STAT3 in HT-29 cells
4 讨论

图9 OA 对HT-29 细胞IL-6/STAT3 信号通路的影响Fig 9 Effect of OA on IL-6/STAT3 signaling pathway in HT-29 cells
近年研究表明,IL-6 介导的STAT3 信号通路的失调与人类各种实体瘤(包括CRC)的发展密切相关,异常激活的STAT3 可通过促进肿瘤细胞增殖、血管生成、侵袭、转移和抑制凋亡来促进肿瘤的发生和发展[16-17]。因此,本文研究IL-6/STAT3 信号通路的调节,以开发新的CRC 治疗药物。IL-6 是促进细胞增殖和抑制细胞凋亡的关键,通过结合IL-6R 和共受体糖蛋白130(gp130)起作用,从而激活相关的Janus 激酶(JAK)。随后,活化的JAKs 使gp130 磷酸化,从而导致STAT3的募集和激活,STAT3 是细胞存活和增殖所必需的重要转录因子,其异常激活可介导各种细胞周期蛋白D1(CyclinD1),CDK4、Bcl-1基因的过表达导致细胞过度增殖和凋亡抗性增加,这可能导致肿瘤的发生和发展[18-21]。
本研究结果显示,OA 能显著抑制IL-6 导致的人结肠癌HT-29 细胞过度增殖,DAPI 染色和AnnexinV 检测均发现OA 有明显的促凋亡作用,Caspase-3 显著激活,均呈现明显的剂量依赖性。流式细胞仪结果表明,OA 将HT-29 细胞周期阻滞在G1期。此外,OA 可显著抑制IL-6 介导的STAT3 激活并呈剂量依赖性,且抑制STAT3 下游基 因Bcl-2、CyclinD1和CDK4的mRNA 和 蛋白表达,同时可增加Bax、p15的表达。因实验目的在于评价OA 的药效作用及其潜在机制,本实验未设置阳性药物组。本实验结果表明,OA 可以通过调节IL-6/STAT3 信号通路及其靶基因来有效抑制人结肠癌细胞的增殖并促进其凋亡。因此,OA 有可能作为未来防治结肠癌的潜在药物。

