苦豆碱对活化的LX-2细胞增殖及凋亡的影响
范月莹,张洪,冯豆,宋玲,谭佳杰(武汉大学人民医院药学部,武汉 430060)
肝纤维化是肝脏对由多种因素如炎症、病毒及免疫引发的肝损伤的一种反应[1-2],若肝脏持续受损,肝细胞则释放相关因子,从而激活肝星状细胞(hepatic stellate cells,HSCs),产生大量细胞外基质(extracellular matrix,ECM),而ECM 的积累会导致肝纤维化[3]。虽然有相关临床药物应用,但还未能产生理想的疗效。研究人员正致力于寻找疗效佳、不良反应少的药物,希望能够延缓、抑制甚至逆转肝纤维化的进程。众多临床实践及实验发现,中药的药理作用具有多成分、多途径、多层次及多靶点等特征,能够缓解肝纤维化和肝硬化进程[4]。
苦豆子SophoraalopecuroidesL.是一种传统中草药,临床上用于治疗肠炎及急性细菌性痢疾[5-6]。苦豆碱(aloperine,ALO)属于喹诺里西啶类生物碱[7],来源于苦豆子。研究发现苦豆碱具有抗炎、抗病毒及抗肿瘤等药理作用,且作用明显[8-10],但苦豆碱对肝纤维化的作用尚未有相关报道。本研究主要探究苦豆碱对在肝纤维化发生发展过程中发挥重要作用的LX-2 细胞的影响。
1 材料
1.1 仪器与试药
HERAcell 160i 细胞CO2培养箱(美国 Thermo Fisher);SWCJ1F 细胞操作超净台(苏州安泰公司);TC20 细胞计数仪(美国 BIO-RID);EnSight酶标仪(美国 Perkin Elmer);FASC Calibur 流式细胞分析仪(美国 Becton Dickinson 公司);C1000普通PCR 仪、CFX 荧光定量PCR 仪(美国BIORAD);DYY-7C 电泳仪(北京六一);Odyssey 双色红外激光成像系统(美国 LI-COR)。
ALO(批号:19101122,北京科展生物科技有限公司,纯度>97.5%);DMEM 高糖培养基(批号:201020101)、胎牛血清(批号:19110505)、 含0.25% EDTA 胰蛋白酶(批 号:1912290101)(美国Gibco 公司);磷酸盐缓冲液(批号:20190725,武汉谷歌生物有限公司);转化生长因子-β(TGF-β1,批号:BGK01137,美国PeproTech 公司);CCK-8 检测试剂盒(批号:C0039,上海碧云天生物技术有限公司);碘化丙啶(PI,批号:20191205,武汉安特捷生物技术有限公司);RNase A(批号:9001-99-4,德国Biofroxx 公司);PE-Annexin V/7AAD 凋亡试剂盒(批号:559763,美国 BD 公司);PrimeScript RT Reagent Kit(批号:RR037Q)、TB Green Premix Ex Taq 试剂盒(批号:RR420Q)(TaKaRa 公司);β-actin 引物(批号:2019-12-20)、Collagen-Ⅰ引物(批号:2019-12-25)、Collagen-Ⅰ一抗(批号:181304)(武汉赛维尔生物科技有限公司);β-actin一抗(批号:6,美国Cell Signaling Technology公司)。
1.2 细胞
人肝星状细胞 LX-2(批号:BNCC341818,北纳创联生物科技有限公司);人正常肝细胞 L-02(武汉大学人民医院中心实验室惠赠)。
2 方法
2.1 细胞培养
LX-2 细胞和L-02 细胞均于含10%胎牛血清、1%双抗(100 U·mL-1青霉素、100 U·mL-1链霉素)的 DMEM 高糖培养基,37 ℃,5%CO2细胞培养箱中培养,待细胞生长至对数生长期,用胰酶消化,传代培养,取第3 ~8 代细胞进行后续实验。
2.2 CCK-8 法检测ALO 对LX-2 细胞增殖的影响
实验分7 组:阴性对照(negative control,NC)组,TGF-β1诱导组和5 个实验组。收集对数生长期的LX-2 细胞,调整细胞浓度为3×104个·mL-1,每孔滴加100 μL,接种于96 孔板中,37 ℃,5%CO2细胞培养箱中培养过夜。将 NC 组细胞培养液更换为完全培养基,其余组细胞培养液更换为含有5 ng·mL-1TGF-β1的完全培养基,24 h 后将实验组细胞用含20、40、60、80、100 μg·mL-1ALO 的培养液继续培养。给药24 h 和48 h 后,吸弃培养基,每孔加入990 μL DMEM高糖培养基和10 μL CCK-8 试剂,37℃、5%CO2的细胞培养箱内孵育1 h 后,酶标仪测定波长为450 nm 的吸光度(A)值,并计算细胞的生长抑制率。抑制率=(1-A实验组/A对照组)×100%。本实验平行重复5 次。
2.3 ALO 对L-02 细胞的毒性
细胞接种和培养方法同“2.2”项下。设置NC组和ALO 为20、40、60、80、100 μg·mL-1实验组,每组4 个复孔。24 h 后测定吸光度,检测方法同“2.2”项下。
2.4 ALO 对LX-2 细胞周期的影响
实验分为5 组:NC 组,TGF-β1诱导组和20、60、100 μg·mL-1ALO 实验组。收集对数生长期的 LX-2 细胞,调整细胞浓度为3×105个·mL-1,每孔滴加2 mL 接种于6 孔板,培养过夜。用无血清的DMEM 高糖培养基饥饿处理各组细胞 24 h,后续细胞处理同“2.2”项下。收集细胞,取细胞悬液加入预冷的75%乙醇,加入PI 染色,同时加入 RNase A 去除RNA 的干扰,2 h 内用流式细胞术进行细胞周期测定。本实验平行重复3 次。
2.5 ALO 对于LX-2 细胞凋亡的影响
实验分组同“2.4”项下。取对数生长期 LX-2细胞,调整细胞浓度为4×105个·mL-1,每孔加入2 mL 接种于6 孔板,培养过夜后按照分组加入相应的培养液培养24 h。用预冷的PBS 洗2遍,使用不含EDTA 的胰酶对细胞进行消化,收集,每组细胞加入100 μL Binding Buffer 重悬细胞,加入5 μL 的PE 和7-AAD 染色剂混匀,避光孵 育25 min,混 入400 μL Binding Buffer,用流式细胞仪检测细胞凋亡。本实验平行重复3 次。
2.6 Collagen-Ⅰ mRNA 相对表达量
实验分组同“2.4”项下。取对数生长期 LX-2细胞,以5×105个·mL-1,每孔2 mL 细胞悬液接种于6 孔板,培养过夜。实验组给药处理24 h后,加入含有5 ng·mL-1TGF-β1的培养液刺激LX-2 细胞2 h。细胞处理完毕后用胰酶消化并收集细胞,提取细胞 mRNA 并逆转录,之后进行PCR 扩增检测,以β-actin 为内参,按照 2-△△CT算法计算 Collagen-Ⅰ mRNA 相对表达量。引物序列为Forward:ACTGGGAGACCTGCGTGTA,Reverse:AATCCATCGGTCATGCTCTC。本实验平行重复3 次。
2.7 Collagen-Ⅰ蛋白相对表达量
实验分组及处理同“2.6”项下,提取细胞总蛋白,用8%聚丙烯酰胺凝胶电泳分离蛋白,用Odyssey 测定蛋白表达量。本实验平行重复3 次。
2.8 统计学处理
采用SPSS 19.0 软件对所得结果进行统计学分析,数据资料采用±s表示,组间分析采用方差分析和t检验,P<0.05 为差异有统计学意义。
3 结果
3.1 ALO 对 LX-2 细胞增殖的影响
TGF-β1诱导组与 NC 组相比,细胞增殖显著增多(P<0.01)。与TGF-β1诱导组相比,除给药质量浓度为20 μg·mL-1的实验组,其余各实验组细胞在培养24 h、48 h 后,增殖均受到明显抑制(P<0.01,P<0.001),且呈剂量依赖性,结果见图1。
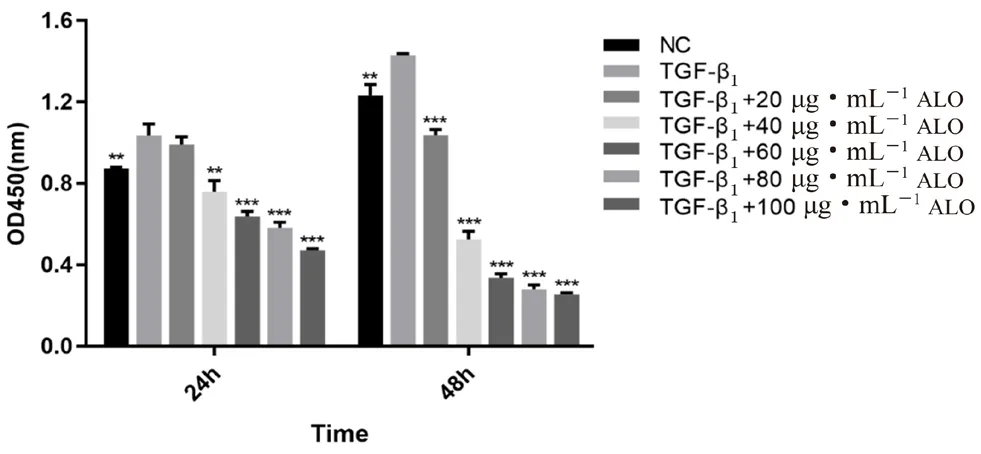
图1 ALO 对 LX-2 细胞增殖的影响(n =5)Fig 1 Effect of ALO on proliferation of LX-2 cells(n =5)
3.2 ALO 对 L-02 细胞的毒性
如图2 所示,与NC 组相比,实验组L-02 细胞生长受到明显抑制,且随着给药浓度增大,生长抑制率提高。ALO 各浓度为实验组对L-02 细胞抑制率均低于20%,其中20、40、60 μg·mL-1组细胞抑制率均低于10%。ALO 对于正常肝细胞L-02 的细胞毒性在可接受范围。
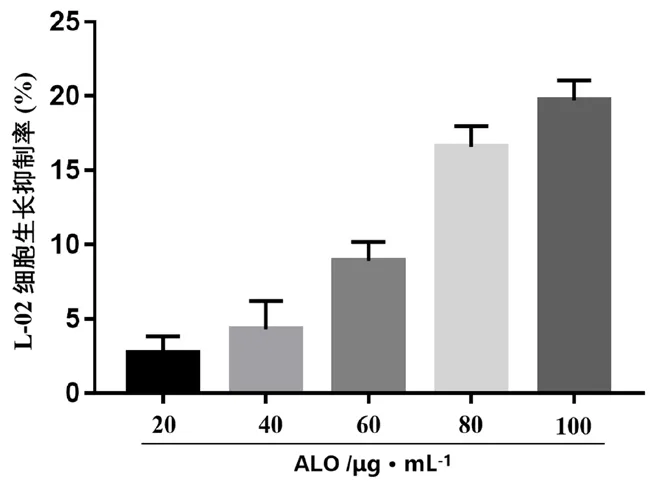
图2 ALO 对 L-02 细胞生长的影响(n =5)Fig 2 Effect of ALO on the growth of L-02 cells(n =5)
3.3 ALO 对 LX-2 细胞周期的影响
如图3 所示,与TGF-β1诱导组相比,各给药组细胞G1期比例明显提升(P<0.001),S 期G2期细胞比例明显降低(P<0.05,P<0.01),表明 ALO 作用于 LX-2 细胞24 h 后,能够显著促进细胞周期阻滞在G1期。
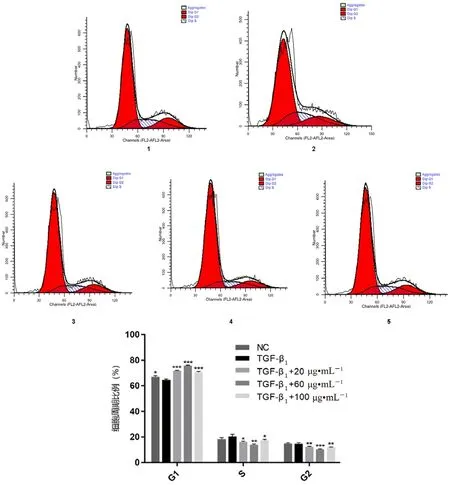
图3 ALO 对 LX-2 细胞周期的影响(n =3)Fig 3 Effect of ALO on cell cycle of LX-2(n =3)
3.4 ALO 对 LX-2 细胞凋亡的影响
如图4和图5所示,NC组,TGF-β1诱导组及20、60、100 μg·mL-1ALO实验组的细胞凋亡率分别为(4.26±0.30)%、(4.03±0.15)%、(4.46±0.29)%、(8.12±0.49)%、(8.98±1.01)%。与TGF-β1诱导组相比,除TGF-β1+20 μg·mL-1ALO 组,其余各给药组细胞凋亡比例明显提高(P<0.001),且呈剂量依赖性。
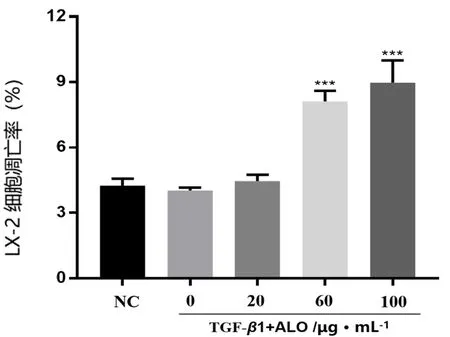
图4 ALO 对 LX-2 细胞凋亡率的影响(n =3)Fig 4 Effect of ALO on apoptosis rate of LX-2 cells(n =3)
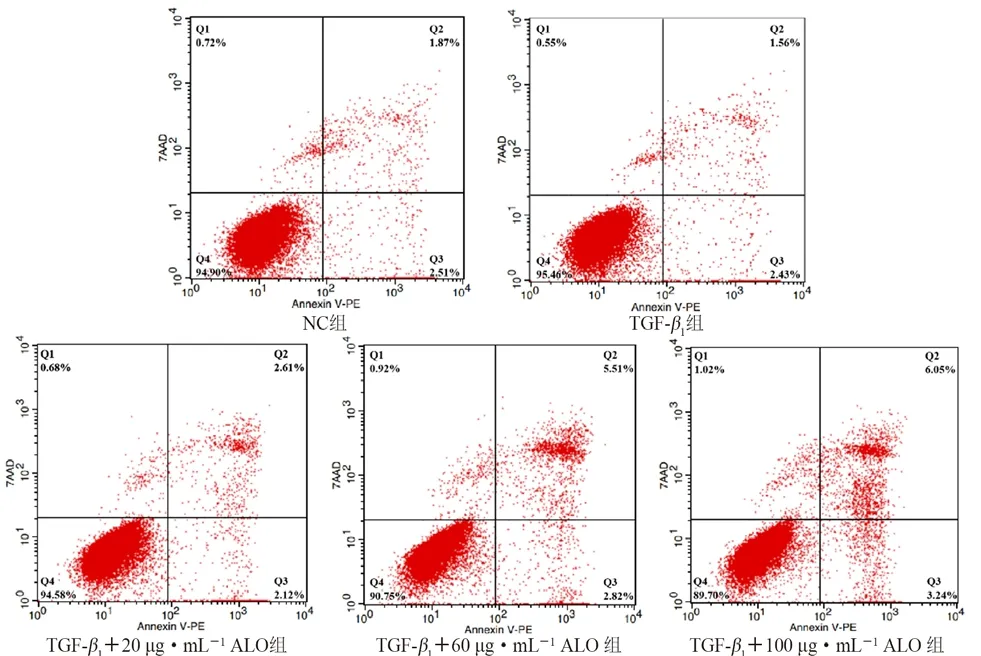
图5 ALO 对 LX-2 细胞凋亡的影响Fig 5 Effect of ALO on apoptosis of LX-2 cells
3.5 ALO 对Collagen-Ⅰ mRNA 相对表达量的影响
TGF-β1诱导组和实验组 LX-2 细胞中Collagen-ⅠmRNA 相对于NC 组的表达量分别为(2.778±0.254)、(2.196±0.155)、(1.475±0.101)、(1.178±0.228)。与 TGF-β1诱导组相比,实验组细胞Collagen-Ⅰ mRNA 相对表达量均显著降低(P<0.001),且呈剂量依赖性,但仍无法降低至正常水平,结果如图6 所示。
3.6 ALO 对Collagen-Ⅰ蛋白相对表达量的影响
NC 组,TGF-β1诱导组及20、60、100 μg·mL-1ALO 实验组 LX-2 细胞中Collagen-Ⅰ 蛋白相对表达量分别为(0.209±0.006)、(0.233±0.005)、(0.200±0.004)、(0.175±0.009)、(0.172±0.007)。与 TGF-β1诱导组相比,实验组细胞Collagen-Ⅰ蛋白相对表达量显著降低(P<0.001),且呈剂量依赖性,表明ALO 显著抑制了Collagen-Ⅰ 蛋白的表达,结果见图7。
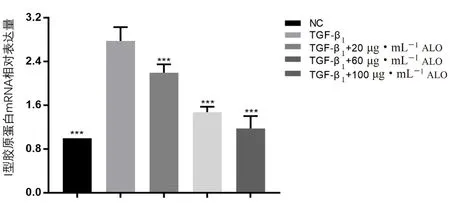
图6 ALO 对Collagen-Ⅰ mRNA 相对表达量的影响(n =3)Fig 6 Effect of ALO on relative expression of Collagen-Ⅰ mRNA(n =3)

图7 ALO 对 Collagen-Ⅰ蛋白表达的影响(n =3)Fig 7 Effect of ALO on the expression of Collagen-Ⅰ protein(n=3)
4 讨论
肝纤维化是以Collagen-Ⅰ 等ECM 的过度积累为特征,由多种因素导致的肝脏慢性损伤所引起的病理过程[3]。肝纤维化的不断进展会使肝功能受损,最终可能会发展成为终末期肝硬化甚至肝细胞癌[11-12]。HSCs 的活化被认为是肝纤维化发生发展过程中的关键步骤[13]。肝脏受到损伤后,静止的HSCs 被激活并分化为成纤维细胞,并迅速增殖,产生大量ECM[14]。因此,治疗肝纤维化的重要手段是抑制HSCs 的活化,阻碍胶原蛋白的表达,抑制活化的HSCs 增殖,促进其凋亡[15]。
LX-2 是永生化的人肝星状细胞系,被广泛应用于体外研究肝纤维化[16]。Xu 等[17]从人正常肝组织中分离HSCs 并进行永生化处理,得到LX-1 和LX-2 细胞系,经过免疫组化、Western blot、qPCR等实验发现,两种细胞系与原代HSCs 相似,均能表达调节肝纤维化的关键受体等蛋白,而LX-2 相比于LX-1,具有更高的可转染性,且能够更好地抵抗无血清培养,因此更适合用于体外实验。
TGF-β是促纤维化因子,同时也是治疗纤维化的重要靶点[18],TGF-β蛋白存在3 种异构体,分别为TGF-β1、TGF-β2、TGF-β3,其 中TGF-β1是在肝纤维化中研究得最深入最广泛的异构体[19]。TGF-β1在纤维化发展中发挥关键作用,它能够刺激ECM的产生和积累并减少基质金属蛋白酶对ECM 的降解[20]。体外实验常利用 TGF-β1刺激LX-2 细胞,如Xiang 等[21]为探究酸浆果红素D 对于LX-2 细胞活化等作用,采用5 ng·mL-1TGF-β1处理LX-2 细胞使其活化。肖琳等[22]设置系列质量浓度(0、0.5、1、5、10 ng·mL-1)TGF-β1刺激LX-2,结果显示5 ng·mL-1TGF-β1为最佳效应浓度。
ALO 具有抗肿瘤和抗炎等作用[23],有研究表明,其能够提高人脐静脉内皮细胞活力,减轻动脉粥样硬化和内皮炎症[24]。另外有研究表明[25],ALO 能通过抑制成纤维细胞的增殖和分化来减轻小鼠肺纤维化。考虑到ALO 对炎症和纤维化过程发挥作用,笔者在本研究中探究了ALO 对于LX-2 的影响。通过CCK-8 实验,本研究验证了ALO 对于活化的LX-2 细胞增殖具有抑制作用,同时确定了后续给药浓度和给药时间。为保证细胞具有较好的活性及状态,笔者设置ALO 对细胞的作用时间为24 h。而给药24 h 时,ALO 对于正常肝细胞L-02 毒性较小,安全性较高。本实验还证明ALO 能够显著诱导活化的LX-2 细胞周期阻滞,进而抑制细胞的生长,并且促进活化的 LX-2 细胞凋亡。此外,通过PCR 和Western blot 实验发现,ALO 能够显著抑制ECM中的重要成分Collagen-Ⅰ 的mRNA 和蛋白表达,减弱TGF-β1对LX-2 细胞的激活作用。
但本实验仍存在较大不足,本研究对于ALO作用于LX-2 细胞增殖、凋亡和活化的机制并未深入探究,且只探究了ALO 在体外对于细胞的作用,未进行动物实验。后续将深入研究ALO对LX-2 细胞周期蛋白、凋亡蛋白及TGF-β/Smad通路的作用并进行体内实验。
综上,本实验证明,ALO 能够抑制活化后的HSCs 的增殖,促进其周期阻滞和凋亡,同时阻碍其进一步活化,减少Collagen-Ⅰ 的产生和积累,为后续研究ALO 对于肝纤维化进程的影响奠定基础。

