解脂耶氏酵母中羽扇豆醇合成途径的构建与调控
万晓宇,刘 振*,毛相朝,2
1.中国海洋大学食品科学与工程学院,青岛 266000;2.青岛海洋科学与技术国家实验室海洋药物与生物制品功能实验室,青岛 266000
羽扇豆醇(lup-20(29)-ene-3β-ol)是一类来源于药用植物的五环三萜类化合物,是羽扇豆烷型三萜的基本前体,羽扇豆醇及其衍生物如桦木酸等具有抗炎、抗癌、抗肿瘤、降血糖等生理活性,在医药领域受到广泛关注[1-3]。已有报道表明,羽扇豆醇有显著抑制肿瘤的生长并致使前列腺癌细胞死亡的能力,是一种潜在的治疗前列腺癌的药物成分[4]。另外,羽扇豆醇在害虫防治领域发挥着重要作用,该化合物可以改变乙酰胆碱酯酶(AChE)、Na+-ATP酶、过氧化氢酶的平衡,破坏螨虫的角质层、肌丝、核膜、线粒体和内质网,最终使螨虫死亡。因此,羽扇豆醇具有一定的杀螨能力,可以作为一种植物性害虫防治剂[5]。
目前羽扇豆醇的获得主要通过植物萃取法、化学法和生物合成法三种途径[6]。羽扇豆醇主要存在于水果蔬菜中,但含量极低,例如,在橄榄果中含量约为3 μg/g,芒果皮含量约为0.67 μg/g,日本梨含量约为175 μg/g,芒果含量约为180 μg/g,芦荟干叶含量约为280 μg/g,榆树皮含量约为880 μg/g[7]。较低的天然含量和复杂的萃取条件使得植物萃取法得到的羽扇豆醇产量较低,例如以海葡萄为原料可提取得到5.6067 mg/g的羽扇豆醇,难以满足羽扇豆醇工业应用的需求[8]。而化学合成法普遍使用桦木醇为前体,经过复杂的化学反应得到羽扇豆醇,目前已知的最高转化率为50%[9]。化学法也因大量的有机溶剂和底物消耗、不可避免的污染和副产物的生成而限制了羽扇豆醇产量的提高[6]。合成生物学作为一门新兴学科,为萜类的合成提供了新的思路,目前已有许多三萜通过生物合成法达到1 g/L以上的产量[10]。同样,也有研究表明利用酿酒酵母作宿主可合成200.1 mg/L的羽扇豆醇[11]。
羽扇豆醇的生物合成主要存在两种合成途径,甲羟戊酸(MVA)途径和甲基赤藓糖-4-磷酸(MEP)途径[12]。其中,MVA途径主要存在于真核生物、古细菌和高等植物的细胞液中,MEP途径主要存在于植物、细菌和藻类等[13,14]。在真核生物中,乙酰辅酶A分子在HMG-CoA合成酶催化下偶联生成3-羟基-3-甲基戊二酰辅酶A (HMG-CoA)[15]。MVA经由HMG-CoA还原酶(HMGR)催化生成,之后转化为异戊烯基焦磷酸盐(IPP)和二甲基烯丙基焦磷酸盐(DMAPP),这个过程被称为MVA通路[16]。IPP和DMAPP这两个重要的中间体通过头尾缩合转化为法尼酰基焦磷酸(FPP)[15]。FPP经角鲨烯合成酶(SQS)生成角鲨烯,再经角鲨烯环氧化酶(SQE)氧化生成2,3-氧化角鲨烯。最后,氧化角鲨烯环化生成2,3-氧化角鲨烯作为阳离子中间体,阳离子中间体经羽扇豆醇合酶(LUS)环化形成羽扇豆醇[17]。图1所示为酵母中羽扇豆醇的合成途径。

图1 酵母中羽扇豆醇的合成途径
本研究通过分别利用木榄和蓖麻来源的LUS在解脂耶氏酵母中构建羽扇豆醇的合成途径,对比这两种不同来源的LUS的表达效果。另外,进一步过表达了解脂耶氏酵母来源的tHMGR和IDI两个关键限速酶调控MVA途径,实现了羽扇豆醇在该宿主中的合成。最后,为了强化2,3-环氧角鲨烯的合成以促进羽扇豆醇的合成,过表达了解脂耶氏酵母中的SQS和SQE,使得羽扇豆醇达到本研究中的最高产量。
1 材料与方法
1.1 试剂材料
1.1.1菌株及质粒
本研究所用质粒、菌株及引物信息见表1和表2。

表1 本研究所用质粒及菌株
1.1.2生化试剂及药品
P505-d1聚合酶PhantaTMMax Super-Fidelity DNA polymerase和Taq聚合酶混合体系2×Taq Master Mix购于诺唯赞生物公司(Vazyme)。快速质粒小提试剂盒TIANprep Rapid Mini Plasmid Kit购于TIANGEN公司。PCR回收试剂盒Gel Extraction Kit(200)购于OMEGA公司。其他试剂及药品未作特殊说明均为国产分析纯。PCR引物合成及测序由青岛擎科公司提供。

表2 本研究所用引物
1.1.3试剂及培养基配方
LB培养基(g/L):蛋白胨10, NaCl 10,酵母提取物5,121 ℃灭菌20 min后备用。
YPD培养基(%):蛋白胨2,酵母提取物2,葡萄糖2,115 ℃灭菌30 min后备用。
SM[Ura]筛选培养基: 0.8% 酵母选择培养基(一缺,Ura),2%葡萄糖,115 ℃灭菌30 min后备用。
SM[Leu]筛选培养基: 0.8% 酵母选择培养基(一缺,Leu),2%葡萄糖,115 ℃灭菌30 min后备用。
SM[Ura-Leu]筛选培养基:0.8%酵母选择培养基(二缺,Ura-Leu),2%葡萄糖,115 ℃灭菌30 min后备用。
上述液体培养基加2%的琼脂可配成相应的固体培养基。
1.2 方法
1.2.1解脂耶氏酵母中羽扇豆醇合成途径的构建
首先构建含目的片段BgLUS、RcLUS的质粒PMT1、PMT2,利用P505-d1高保真聚合酶扩增和PCR回收得到用于酵母转化的线性片段。用YPD培养基活化基础菌株po1g后分别将目的片段用醋酸锂法转入感受态中,并用SM-Ura固体培养基筛选转化子。转化子用引物进行PCR验证和测序验证后,得到GLU-1、GLU-2工程菌。
1.2.2MVA调控菌株的构建
构建MVA调控工程菌株所用的方法与1.2.1相同,首先从解脂耶氏酵母po1g全基因组中扩增IDI和tHMGR片段,将目的片段利用P505-d1高保真聚合酶扩增和PCR回收,之后转入用SM-Ura培养基活化后的GLU-1、GLU-2菌株的感受态中,用含HYG抗性的SM-Ura固体培养基筛选转化子。转化子用引物进行PCR验证和测序验证后,得到GLU-1M、GLU-2M工程菌。
1.2.3强化2,3-环氧角鲨烯合成菌株的构建
方法与1.2.1相同。将来源于解脂耶氏酵母po1g全基因组的SQS和SQE片段利用P505-d1高保真聚合酶扩增和PCR回收后,转入用含HYG抗性的SM-Ura培养基活化后的GLU-1、GLU-2菌株的感受态中,用含HYG抗性的SM-Ura-Leu固体培养基筛选转化子。转化子用引物进行PCR验证和测序验证后,得到GLU-1MS、GLU-2MS、GLU-1MSS工程菌。
1.2.4摇瓶培养
挑取固体培养基上的单克隆于相应的液体培养基中,30 ℃,220 r/min培养2 d作为种子液。将种子液以2%的接种量接种于含15 mL YPD培养基的100 mL三角瓶中培养,30 ℃,220 r/min培养5 d。
1.2.5产物提取及检测
1.2.5.1 产物提取
取1 mL发酵液于EP管中,1.0×103r/min离心5 min,去除培养基,1 mL无菌水清洗后,加入1 mL HCl(3 mol/L)于95 ℃水浴15 min,之后转移至冰浴10 min,1.0×103r/min离心5 min,去除上清,之后加入双蒸水洗涤,1.0×103r/min离心5 min去除上清。加入0.5 mL丙酮于55 ℃水浴15 min。1.0×103r/min离心5 min,取上清并过0.22 μm有机尼龙滤膜后备用。
1.2.5.2 产物检测
羽扇豆醇和角鲨烯的定性及定量分析使用液相色谱法检测。色谱条件:色谱柱:毛细管柱C18;柱温:35 ℃;流动相:甲醇;总流速:1 mL/min;检测波长:201 nm;等度洗脱;进样体积:20 μL。角鲨烯和羽扇豆醇标准品用于定性和定量分析。
2 结果与讨论
2.1 利用两种不同来源LUS在解脂耶氏酵母中构建羽扇豆醇合成途径
解脂耶氏酵母是一种产油酵母,其自身可以合成大量乙酰辅酶A供萜类合成,另外该宿主体内的油脂也有利于萜类的储存,因此解脂耶氏酵母可视为一种利于萜类合成的优秀宿主。解脂耶氏酵母具有内源的2,3-环氧角鲨烯的合成通路,引入羽扇豆醇合酶即可催化2,3-环氧角鲨烯环化形成羽扇豆醇。本研究选取木榄和蓖麻来源的两种LUS(BgLUS和RcLUS)分别整合到解脂耶氏酵母po1g菌株中。首先将华大基因合成和密码子优化后的BgLUS和RcLUS进行PCR克隆,分别与强启动子TEF和终止子连接后,利用同源重组整合到po1g基因组上(URA为筛选标记)。转化子经过缺陷培养基筛选后,利用引物验证和测序验证,获得正确的工程菌。


a:GLU-1和GLU-2工程菌株示意图;b:泳道 1-5为GLU-1阳性克隆验证,6-10为GLU-2阳性克隆验证。图2 GLU-1和GLU-2工程菌株示意图及琼脂糖电泳图
阳性克隆鉴定结果显示(图2b),工程菌株插入大小与BgLUS(2 298 bp)和RcLUS(2 310 bp)基因大小一致的片段。测序结果显示序列并未发生突变,菌株构建成功。但这两个工程菌株均检测不到羽扇豆醇,可能的原因有解脂耶氏酵母自身的MVA途径较弱,无法合成足够的FPP和角鲨烯供羽扇豆醇的合成。因此,优化MVA途径成为促进解脂耶氏酵母中羽扇豆醇的合成的重要手段。
2.2 调控MVA途径对羽扇豆醇和角鲨烯合成的影响
MVA途径是萜类合成的第一道关键步骤,许多研究表明经过MVA优化后的萜类合成菌株产量可上调。其中HMGR是合成MVA的关键酶,此步骤不可逆转,有研究表明,去掉N端氨基酸的HMGR(tHMGR)具有更高的合成MVA能力。而IDI作为MVA途径中的一步可逆反应的酶,催化IPP与DMAPP的相互转化,也同样对FPP的积累产生重要的影响[18]。这两种酶同时调控着IPP和DMAPP在整个途径中平衡配比,也是代谢工程改造的主要靶点[19]。通过将来源于解脂耶氏酵母的tHMGR和IDI整合到GLU-1和GLU-2中,转化子经过缺陷培养基筛选后,利用引物验证和测序验证,获得MVA途径优化后的工程菌GLU-1M和GLU-2M。
阳性克隆鉴定结果显示(图3b,3c),工程菌株插入大小与tHMGR(1 500 bp)和IDI(813 bp)基因大小一致的片段。测序结果显示序列并未发生突变,菌株构建成功。如图3d所示,在调控了MVA途径后羽扇豆醇合成途径构建成功,羽扇豆醇产量为11.74 mg/L,角鲨烯产量为8.33 mg/L。确定了过表达IDI和HMGR两种关键酶对羽扇豆醇和角鲨烯的生成起到了强化作用,实现了羽扇豆醇在解脂耶氏酵母中从无到有的合成。然而,BgLUS和RcLUS对羽扇豆醇的合成无显著差异。
2.3 过表达SQS和SQE对羽扇豆醇和角鲨烯合成的影响
在酵母中,固醇合成途径是萜类合成的有力竞争途径,为了使更多的2,3-环氧角鲨烯投入到萜类合成当中,对其含量调控就尤为重要。在酿酒酵母中,SQE是三萜合成的一个关键限速酶。研究表明,角鲨烯作为重要中间体,其含量极大程度上影响了羽扇豆醇的合成。本研究通过过表达解脂耶氏酵母自身的SQE,构建了GLU-1MS,GLU-2MS。另外,经过MVA优化的GLU-1M和GLU-2M对角鲨烯的积累水平仍然不足。因此在GLU-1MS基础上,整合来源于解脂耶氏酵母的SQS成功构建了GLU-1MSS工程菌。

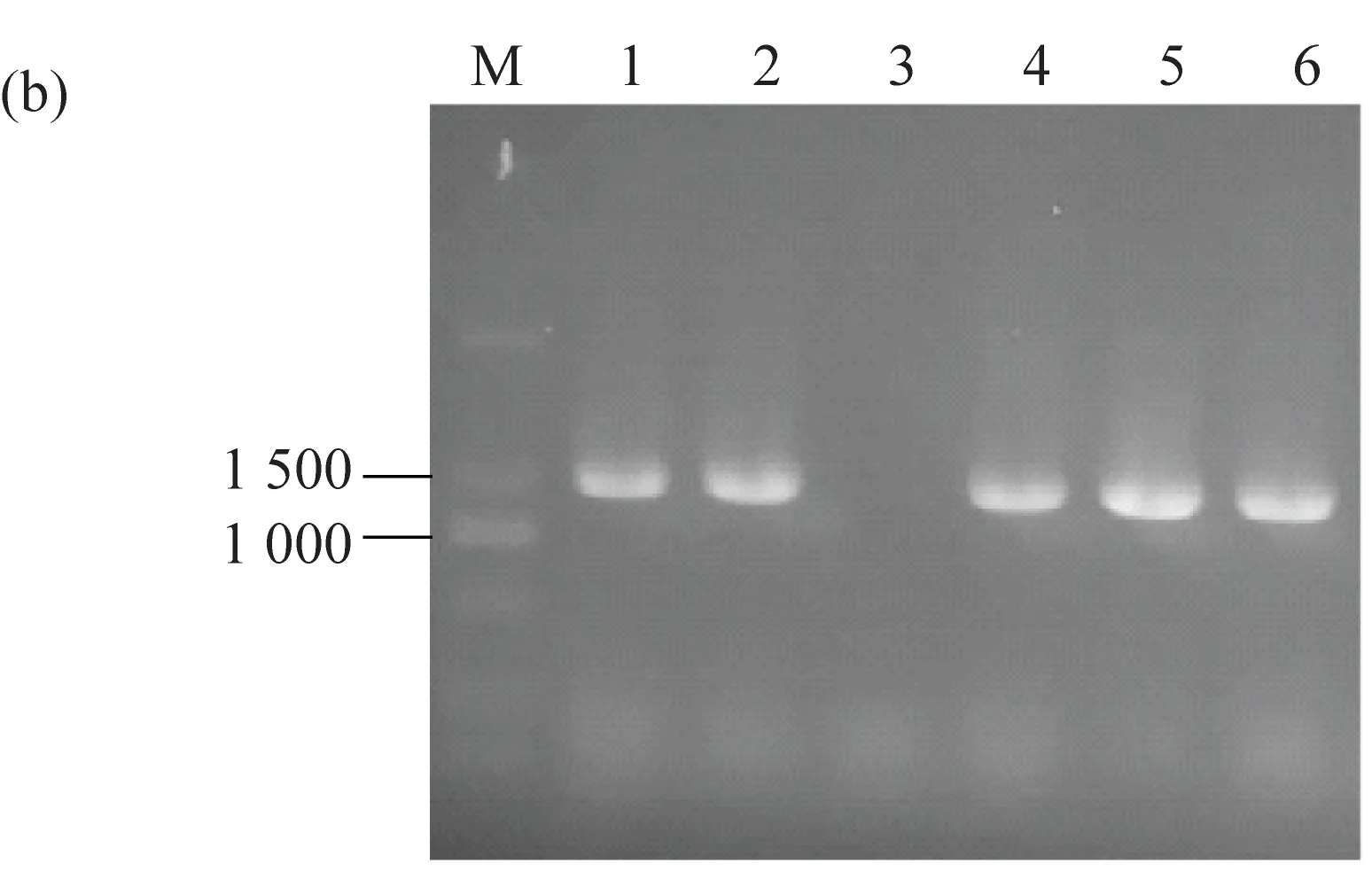

a:GLU-1M和GLU-2M工程菌株图解;b:工程菌株tHMGR片段阳性克隆验证;c:工程菌株IDI片段阳性克隆验证;d:过表达tHMGR和IDI对羽扇豆醇和角鲨烯产量的影响。图3 GLU-1M和GLU-2M工程菌株示意图、琼脂糖电泳图及角鲨烯和羽扇豆醇产量图
阳性克隆鉴定结果显示(图4b,4c),工程菌株插入片段大小与SQE(1 467 bp)和SQS(1 338 bp)基因大小一致的片段。测序结果显示序列并未发生突变,菌株构建成功。如图4d所示,在强化2,3-环氧角鲨烯的合成后羽扇豆醇的产量有所上升,两种不同来源的LUS在羽扇豆醇的合成效果上出现差异,整合了木榄来源的BgLUS的GLU-1MS可合成19.8 mg/L的羽扇豆醇,而蓖麻来源的RcLUS合成的羽扇豆醇不到15 mg/L。为了进一步增强中间产物角鲨烯的产量,在GLU-1MS的基础上整合了SQS。最终,工程菌GLU-1MSS合成的羽扇豆醇可达24.62 mg/L,角鲨烯产量为14.17 mg/L。相较于上一步优化提升了1倍。



a:GLU-1MS、GLU-2MS和GLU-1MSS工程菌株图解;b:泳道3为GLU-1MS阳性克隆验证,6为GLU-2MS阳性克隆验证;c:GLU-1MSS菌株SQS片段阳性克隆验证;d:过表达SQS和SQE对羽扇豆醇和角鲨烯产量的影响。图4 GLU-1MS、GLU-2MS和GLU-1MSS工程菌株示意图、琼脂糖电泳图及角鲨烯和羽扇豆醇产量图
3 结论
本文以解脂耶氏酵母作为表达菌株,进行了羽扇豆醇合成途径的构建与调控。向解脂耶氏酵母po1g中分别引入了BgLUS和RcLUS基因及MVA途径的关键酶HMGR和IDI,构建了GLU-1M和GLU-2M工程菌,成功在解脂耶氏酵母中建立了羽扇豆醇合成途径。为了提升解脂耶氏酵母中羽扇豆醇的产量,进一步过表达了三萜合成的关键限速酶SQE和SQS,构建了GLU-1MSS工程菌,使产量羽扇豆醇提升为GLU-1M的2倍。然而目前工程菌中羽扇豆醇的产量仍然很低,这一现象可能是由较低水平的角鲨烯积累和2,3-环氧角鲨烯的利用不足所导致的。因此,未来对羽扇豆醇在解脂耶氏酵母中的优化可以从以下几个方面展开:(1)过表达整条MVA途径;(2)抑制固醇合成途径;(3)使用强启动子表达关键限速酶;(4)优化培养条件;(5)选择目的基因最佳插入位点。本研究完成了羽扇豆醇解脂耶氏酵母工程菌株的构建,为大规模合成羽扇豆醇提供思路,为进一步合成羽扇豆烷型三萜奠定了基础。

