茴香酸产生菌发酵条件的优化
张 健,郑景辉,高程海,林 瑜,李学坚,冯玉燕,郑雪莹,银江林
广西中医药大学,广西南宁 530200
茴香酸(Anisic acid)化学名为对甲氧基苯甲酸(4-Methoxybenzoic acid,CAS:100-09-4),是多种食品香料和工业香精的主要原料[1-2],是化妆品的良好抑菌剂[3-4],可用作脑功能改善药茴拉西坦、抗心律失常药乙胺碘呋酮等多种药物的中间体[5-7],有抗肝毒活性[8]和抗肿瘤活性[9],是一种高附加值天然芳香族香料,具有重要的经济价值。
当前工业生产茴香酸主要采用化学法,以对甲基苯酚、对羟基苯甲酸为原料合成而得。化学法存在生产成本较高、工艺条件苛刻、副产物较多、容易产生污染等问题[10-12]。因此迫切需要寻找一种经济环保的制备方法。微生物转化法具有高效专一、反应条件温和、绿色环保等优点,已广泛应用于食品加工、生物制药及化妆品研发等领域[13-16],利用该法制备茴香酸具有广阔的应用前景。
目前,国内外关于微生物转化法制备茴香酸的研究尚处实验室阶段,主要聚焦在以反式茴脑或茴香油为底物转化合成茴香酸,研究内容包括菌株筛选[17-19]、发酵条件优化[20-21]和代谢相关基因或途径的探索[22-24]等。有关研究表明,通过单因素法结合正交试验法优化发酵条件后,假单胞菌BT-13[20]、霉菌ZZ-1[18]的茴香酸摩尔生成率分别提高了92.8%、107.38%。通过单因素法结合响应面法优化发酵条件后,伯克霍尔德氏菌WGB31[21]的茴香酸摩尔生成率提高了199.5%。蒋琼等[24]通过构建重组菌使茴香酸浓度提高了约4倍。目前已报道的产茴香酸的微生物资源较少,这些菌株的原始产酸能力普遍较低,优化发酵条件或者构建重组菌在一定程度上提高了其茴香酸生产能力,但与工业生产还有很大距离。目前只发现粟桂娇等[20]进行了5 L机械搅拌发酵罐的放大试验。因此,继续挖掘微生物资源、优化发酵条件以及进一步探索放大试验以获得更好的茴香酸产率显得尤为重要。本研究以课题组保藏的以反式茴脑为唯一碳源相对高产茴香酸的假单胞菌Pseudomonassp. NT2为出发菌株,通过单因素试验和响应面设计优化菌株的发酵条件,以期进一步提高茴香酸产量,为工业化生产茴香酸奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1菌种
假单胞菌NT2(Pseudomonassp.)为本课题组筛选保藏,能够以反式茴脑为唯一碳源生产茴香酸。
1.1.2主要试剂
标准品反式茴香脑(HPLC≥99%)、茴香酸(HPLC≥99%)购于上海源叶生物科技有限公司;底物反式茴香脑(99%)购于Macklin;乙腈和甲醇(色谱纯)购于Thermo Fisher Scientific;无水乙醇(分析纯)购于天津市富宇精细化工有限公司;其他化学试剂均为分析纯的国产试剂。
1.1.3培养基
LB培养基(g/L):胰蛋白胨 10.0, 酵母粉 5.0,NaCl 10.0。
发酵培养基(改良M9培养基,g/L):Na2HPO4·12.0,H2O 17.14,KH2PO43.0,NH4Cl 1.0, NaCl 0.5,MgSO4·7H2O 1.0,FeSO4·7H2O 0.02,CaCl20.02,pH 7.0。
1.2 仪器与设备
恒温培养箱(精宏,上海)、Waters e2695型高效液相色谱仪(Waters,美国)、SW-CJ-2F型超净工作台(苏净安泰,江苏)、HVA-110型全自动灭菌锅(Hirayama,日本)。
1.3 实验方法
1.3.1种子液制备
挑取菌株NT2接种于50 mL/250 mL的LB液体培养基中,于30 ℃、200 r/min培养12 h作为种子液。
1.3.2初始发酵工艺
将种子液按1%的接种量加入到50 mL/250 mL发酵培养基中,30 ℃、200 r/min发酵15 h,加入1%反式茴脑,继续发酵36 h获转化液。用2倍体积无水乙醇萃取转化液,取适量萃取转化液用无水乙醇稀释,通过高效液相色谱法检测其中反式茴脑、茴香酸浓度。转化液中茴香酸浓度1.96 g/L,摩尔生成率21.8%,反式茴脑降解率45.41%。
1.3.3茴香酸和反式茴脑标准曲线测定
精密称取标准品,配置浓度为1.173 6 mg/mL、0.978 0 mg/mL、0.782 4 mg/mL、0.586 8 mg/mL和0.195 6 mg/mL的反式茴脑溶液,1.086 mg/mL、0.868 8 mg/mL、0.651 6 mg/mL、0.434 4 mg/mL和0.108 6 mg/mL的茴香酸溶液。参考粟桂娇[25]方法,选择Agilent 反相C18柱(4.6×250 mm,5 μm),采用等度洗脱,检测波长260 nm,流动相为乙腈∶水∶冰乙酸=70∶30∶0.02(V/V/V),流速0.8 mL/min,进样量5 μL。以物质浓度为纵坐标,峰面积为横坐标,制作反式茴脑、茴香酸的标准曲线和线性回归方程。
1.3.4计算公式
茴香酸摩尔生成率/%=
反式茴脑降解率/%=

1.3.5菌株NT2降解反式茴脑生产茴香酸发酵条件单因素试验
考察碳源种类(葡萄糖、果糖、柠檬酸钠、麦芽糖、甘油、无水乙醇),碳源浓度(0.5 g/L、1 g/L、2 g/L、5 g/L、10 g/L和20 g/L),氮源种类(牛肉膏、蛋白胨、尿素、氯化铵、硝酸钾、硫酸铵),氮源浓度(0.5 g/L、1 g/L、2 g/L、5 g/L、10 g/L和15 g/L),底物反式茴脑添加量(0.5%、1%、1.5%、2%和2.5%),接种量(1%、2%、4%、6%、8%和10%),发酵温度(26 ℃、28 ℃、30 ℃、32 ℃和34 ℃),初始pH(6.0、7.0、8.0、9.0、10.0),装液量(10 mL/250 mL、30 mL/250 mL、50 mL/250 mL和70 mL/250 mL)对茴香酸生成量、反式茴脑降解率的影响。试验按上述顺序进行且每个因素考察建立在前一因素取最优值的基础上。每个处理做3个平行。
1.3.6Plackett-Burman试验筛选影响茴香酸浓度的因素
Plackett-Burman是一种以不完全平衡块为原理的试验设计,能从众多变量中有效筛选出最重要的因素。结合单因素试验结果,以茴香酸浓度为响应值,试验运用Design-Expert 8.0.6软件对7个因素(柠檬酸钠浓度、氯化铵浓度、反式茴脑添加量、发酵温度、接种量、初始pH和装液量)设计N=12的二水平因子的Plackett-Burman试验(见表1),以95%水平(P<0.05)为显著因素,从中筛选出对茴香酸浓度影响较大的主要因素。

表1 Plackett-Burman试验设计因素和水平
1.3.7最陡爬坡试验确定因素的最优值范围
对Plackett-Burman试验筛选出的3个最显著影响因素进行最陡爬坡试验,确定因素的最优值范围,确定试验中心点。
1.3.8Box-Behnken试验和响应面分析
根据最陡爬坡试验确定的范围,利用Box-Behnken的中心组合试验设计原理,对此3因素进行试验设计,采用Design Expert 8.06软件对响应面分析法试验结果进行回归分析,分析和预测显著因素最佳值。
1.3.9预测验证试验
结合单因素试验和响应面分析获得最佳发酵条件预测方案,对预测方案进行3次验证试验,每次测3个平行。
2 结果与分析
2.1 茴香酸和反式茴脑标准曲线
茴香酸、反式茴脑浓度与高效液相检测的峰面积x之间的标准曲线及线性回归方程见图1。
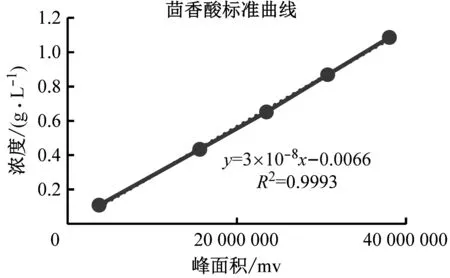

图1 茴香酸、反式茴脑标准曲线
2.2 单因素试验
2.2.1碳源种类及浓度优化
碳源是微生物生长的重要营养物质,同时影响微生物的新陈代谢。本实验初始培养基为不含碳源的改良M9培养基,添加适量的合适碳源能够满足菌体生长,有利于反式茴脑转化生成茴香酸。考察了6种碳源(添加量均为10 g/L),结果如图2A所示。


添加柠檬酸钠时,转化液中茴香酸浓度最大(2.18 g/L),优于其它实验组;反式茴脑降解率较无碳源对照组(初始发酵工艺)降低了9.41%,即减少了反式茴脑用于菌体生长的消耗,故选取柠檬酸钠作为最佳碳源,对添加量进行优化,结果如图2B。添加量为0.5 g/L~10 g/L,茴香酸浓度随柠檬酸钠添加量的增加呈上升趋势,在10 g/L时达到最高值。继续增加柠檬酸钠添加量到20 g/L,反式茴脑几乎不被菌株降解,无茴香酸累积,这可能是因为碳源过剩阻碍了菌株对反式茴脑的转化。因此,选择柠檬酸钠浓度10 g/L作为下一步优化的基础。
2.2.2氮源种类及浓度优化
考察了6种不同氮源(初始添加量均为1 g/L)对菌株转化合成茴香酸的影响,结果见图2C。不同的氮源种类对转化效果有显著影响。以氯化铵作为氮源时,茴香酸累积浓度最大,反式茴脑降解率最高,其次为硝酸钾,牛肉膏效果最差。因此,氮源选择氯化铵。氯化铵浓度对发酵的影响见图2D,当浓度为0.5 g/L~1 g/L时,茴香酸浓度呈上升趋势,继续增加氯化铵的浓度,茴香酸累积浓度明显下降,当氯化铵添加量超过10 g/L时,茴香酸几乎不再累积,这可能是因为高浓度的氯化铵抑制了菌体对反式茴脑的转化。浓度范围在1.0 g/L~2.0 g/L时反式茴脑降解率差别不大,结合茴香酸生成量,选取氯化铵浓度1.0 g/L进行下一步条件优化。
2.2.3底物反式茴脑添加量优化
底物反式茴脑添加量优化结果见图3A。当添加量为0.5%时,反式茴脑降解程度最高,但茴香酸累积浓度最低,这可能是由于部分反式茴脑被菌体消耗用于生长,未能有效转化为茴香酸。当添加量为1.0%时,茴香酸累积浓度3.50 g/L,反式茴脑降解率48.32%,转化效果较好。继续提高底物添加量,茴香酸的累积增幅不大,反式茴脑降解率变低。因此,以加入1%的底物量最为合适。
2.2.4发酵温度优化
发酵温度优化结果见图3B,26 ℃~34 ℃范围内,茴香酸浓度、反式茴脑降解率升降幅度不大,其中茴香酸浓度呈现先升后降。30 ℃时,茴香酸浓度最高(3.56 g/L),28 ℃和34 ℃时反式茴脑降解率都比较高(~70%),但茴香酸浓度比30 ℃时低,故选择30 ℃作为转化的最适温度。
2.2.5菌株接种量优化
由图3C可知,随接种量增加,茴香酸浓度先升高后急剧降低,以4%的接种量为最佳,此时茴香酸浓度达到5.8 g/L,同时反式茴脑降解率也达到最高值(86.49%)。接种量影响菌体在发酵液中的生长速度,接种量过低菌体生长过缓,过高则竞争生长导致加速死亡,均不利于反式茴脑的转化利用,因此本实验选择4%的接种量进行下一步优化实验。
2.2.6初始pH优化
培养基初始pH对菌株NT2产茴香酸有显著影响,pH过高或过低对菌体生长和酶活性均会造成抑制(图3D)。当发酵培养基的初始pH为7.0时,茴香酸浓度和反式茴脑降解率均达到最高,分别为6.63 g/L和85.19%。因此本实验选择pH 7.0进行下一步实验。
2.2.7装液量优化
装液量主要影响菌株的供氧,从图3E可知,装液量过高或过低均不利于菌体生长。装液量为30 mL/250 mL时,茴香酸浓度达到最高(6.41 g/L)、反式茴脑降解率也达到最高(88.87%),因此,装液量选择30 mL/250 mL为宜。
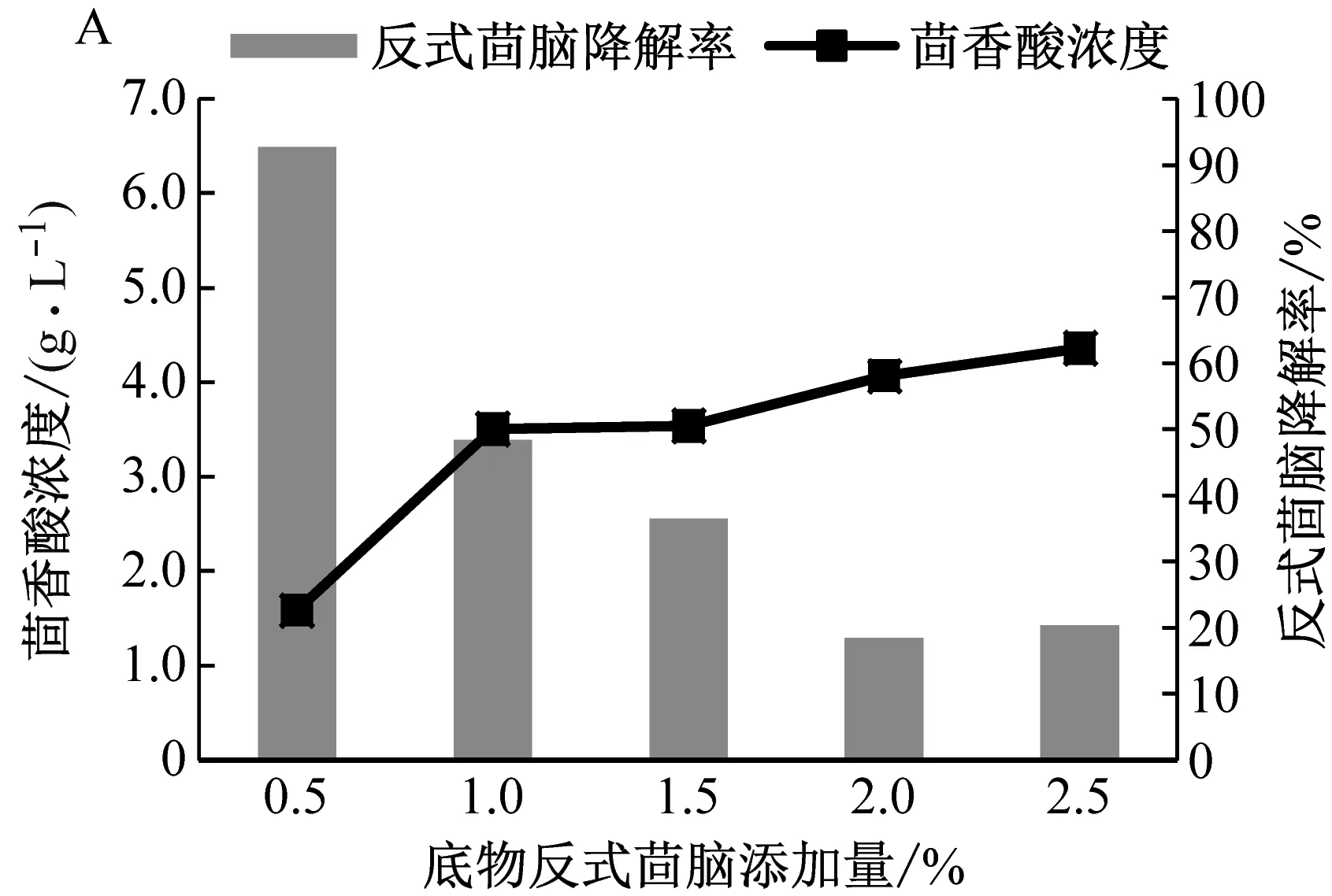


图3 底物添加量、温度、接种量、pH及装液量对反式茴脑降解率及茴香酸产量的影响
2.3 Plackett-Burman试验筛选结果
Plackett-Burman试验设计结果如表2所示。根据试验结果进行模型显著性分析,回归模型P值为0.014 7<0.05,表示该模型显著;R2=0.955 2,表明该模型可解释95.52%的数据,说明该回归模型拟合度较好。因素显著性分析如表3所示,在所有因素中,氯化铵浓度、初始pH和装液量的P值均小于0.05,即对实验结果影响大于95%,prob>F值<0.05,说明这3个因素均为模型显著因素。在这3个因素的主效应中,由贡献度可知重要性排序为初始pH>氯化铵浓度>装液量,其中初始pH和装液量为正向效应、氯化铵浓度为负效应。因此选择这3个因素进行下一步的最陡爬坡试验。

表2 Plackett-Burman试验设计与结果
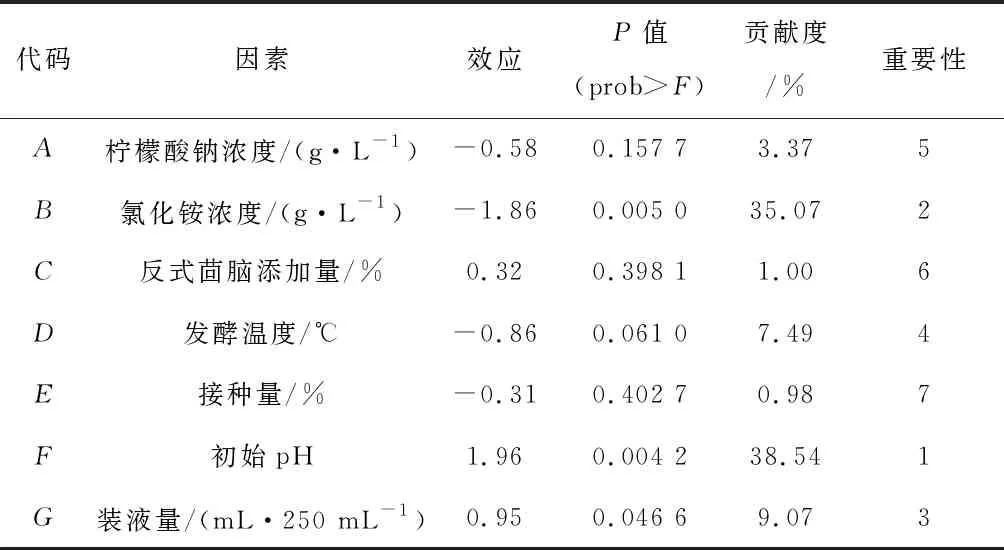
表3 基于Plackett-Burman试验方差分析
2.4 最陡爬坡试验确定因素最优范围
响应面试验的设计要求逼近最佳值区域才能建立有意义的拟合方程,因此在响应面试验之前,需利用最陡爬坡试验来逼近最优值区域。在Plackett-Burman试验基础上,对氯化铵浓度、初始pH和装液量这3个显著因素进行最陡爬坡试验设计,结合实际,根据效应正负设计步长方向,即氯化铵浓度的值逐渐减少、初始pH和装液量的值逐渐增大,试验设计和结果如表4所示。从表4中可知,当氯化铵浓度为1.0 g/L,初始pH为7.5,装液量为40 mL/250 mL时,发酵液中茴香酸累积浓度最高。因此,选第4组试验条件作为下一步Box-Behnken试验的中心点。
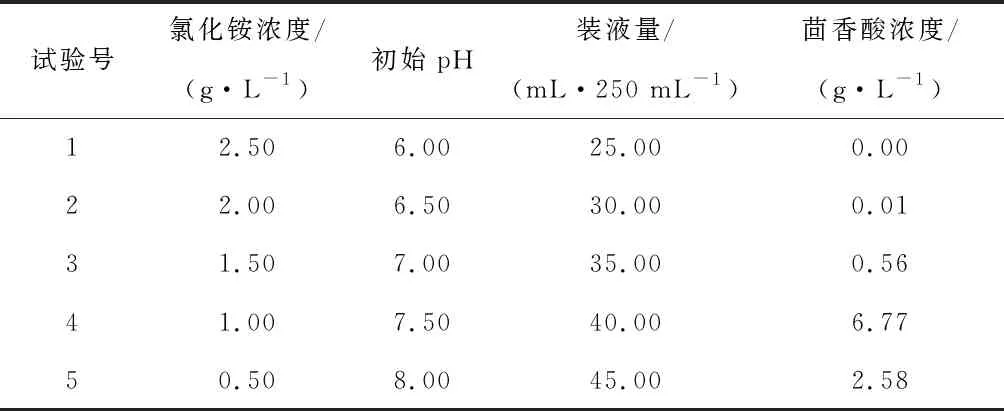
表4 最陡爬坡试验设计与结果
2.5 响应面优化结果与分析
2.5.1Box-Behnken试验设计结果
根据最陡爬坡试验结果,以氯化铵浓度、初始pH和装液量为响应因子,茴香酸浓度为响应值,采用Box-Behnken试验设计进行3因素3水平的响应面分析试验,结果见表5。每组结果重复测3个平行。

表5 Box-Behnken试验设计与结果
2.5.2响应面优化分析
运用Design-Expert 8.0.6软件对Box-Behnken结果进行模型建立与方差分析,结果见表6。对3个显著因素进行回归拟合后,得到如下多元二次响应面回归模型:

表6 回归模型及方差分析
Y=7.01+1.07A+0.29B+0.47C+1.06AB+0.73AC-0.43BC-2.09A2-0.44B2-0.79C2
各因素交互作用的响应面图及等高线图如图4所示。响应面的坡度表示因素对茴香酸浓度的影响大小,坡度越大表示影响越大,等高线的椭圆程度表示两因素交互作用对茴香酸浓度影响的显著性,椭圆程度越大表示影响越显著。由图4可知,A1和B1响应面整体坡度较C1的大,其中氯化铵浓度0.5 g/L~1.5 g/L范围内,茴香酸浓度先升后降,曲面坡度最大,说明氯化铵浓度对茴香酸浓度的影响最大,其次是装液量,最后是初始pH。由等高线情况可知,等高线椭圆程度由大到小为A2>B2>C2,说明氯化铵浓度和初始pH的交互作用最大,对茴香酸浓度的影响最显著,其次是氯化铵浓度和装液量的交互作用,最后是初始pH和装液量的交互作用。


(A) 氯化铵浓度及初始pH对茴香酸浓度的影响
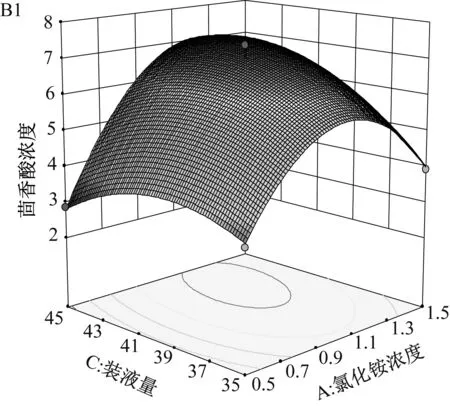

(B) 氯化铵浓度及装液量对茴香酸浓度的影响


(C) 装液量和初始pH对茴香酸浓度的影响
2.5.3最佳发酵条件验证试验
经响应面分析,获得3个显著因素的最优值为:氯化铵1.26 g/L, 初始pH 7.9,装液量41.6 mL/250 mL,此时预测茴香酸浓度最高为7.48 g/L。为确认响应面结果的可靠性,根据上述条件进行验证试验,考虑到实际操作,将装液量调整为42 mL/250 mL。在最优条件下,菌株NT2发酵液中茴香酸累积浓度为7.24 g/L,逼近方程预测值,表明该模型可靠,具有实际意义。
3 结论
试验结果证明,假单胞菌Pseudomonassp. NT2为生产茴香酸的潜力菌株。经单因素试验、Plackett-Burman和Box-Behnken试验优化发酵参数,可知氯化铵浓度、初始pH和装液量是该菌株生产茴香酸的3个显著影响因素。优化后获得最佳发酵条件为:柠檬酸钠10 g/L,氯化铵1.26 g/L,底物反式茴脑加入量1%,发酵温度30 ℃,接种量4%,初始pH 7.9,装液量42 mL/250 mL。优化后,茴香酸生成量可达7.24 g/L,为原始发酵工艺时的3.5倍,是已报道的较高产率菌株BT-13[25](3.49 g/L)的2倍。茴香酸摩尔生成率为80.72%,反式茴脑降解率为89.81%,分别提高了270.28%、97.78%,说明发酵工艺得到了有效优化。本研究丰富了产茴香酸微生物资源,为微生物转化法生产茴香酸的工业化奠定了基础。

