生物制造高附加值乳糖衍生物的研究进展
夏洪志,李 娜,王晨浩,刘雅知,於 昊,徐 铮*
1. 南通励成生物工程有限公司, 南通 226010;2. 南京工业大学 食品与轻工学院, 南京 211816
乳糖存在于人类和其他哺乳动物的乳汁中,是由D-半乳糖与D-葡萄糖通过β-1,4-糖苷键组成的还原型二糖,通常含有一分子结晶水(C12H22O11·H2O),在牛奶中的质量比为4.5%~5.0%[1]。婴幼儿通过小肠上皮细胞刷状缘分泌的乳糖酶将其水解为单糖,并随细胞主动转运获得吸收。D-葡萄糖为机体提供能量,而D-半乳糖以糖苷键结合于神经酰胺上形成半乳糖脑苷脂参与大脑的发育。婴儿期是神经发育的关键期,因此乳糖对婴儿期的神经系统发育至关重要[2]。成年人消化乳糖的能力显著下降,尤其是亚洲人缺乏乳糖酶普遍不能利用乳糖,所以食入乳糖后会造成胀气、腹泻、腹痛等症状[3]。这导致乳制品中通常需要去除乳糖,或将其水解为单糖来避免乳糖不耐受症,例如舒化奶类产品[4]。乳糖主要用于制造婴儿食品和配制药物,譬如作为药用辅料和填料,已广泛应用于国际制药行业,因此是乳糖增值的有效手段。2019年我国药用乳糖产量就已增长至18 400吨[5]。除此以外,近年来利用生物工程技术将乳糖转化为更高附加值的糖类产品也具有很大市场;例如乳果糖(lactulose)、岩藻糖基乳糖(fucosyllactose)、D-塔格糖(D-tagatose)、低聚半乳糖(galacto-oligosaccharides)等(表1)。这些产品为大幅提升乳糖的商业附加值提供了可能,因而具有很大的发展潜力,下面就这几种产品的研发进展予以综述。

表1 高附加值乳糖衍生物
1 乳果糖的生物制备
乳果糖(Lactulose)是由D-半乳糖和D-果糖通过β-1,4-糖苷键构成的还原型二糖(分子式C12H22O11,分子量342.3),甜度是乳糖的1.5倍[6]。乳果糖难以被人体消化吸收,因此经过胃和小肠后可以到达结肠,被益生菌发酵为短链的有机酸并产生大量二氧化碳;从而显著降低肠道pH并提高渗透压,保留肠道水分起到软化大便的作用,也可以中和肝代谢异常症产生的血氨[7]。乳果糖的水溶性极好,因此能够浓缩为糖浆,不易腐败可作为非处方药物(OTC)用于慢性便秘和肝性脑病的治疗[8]。乳果糖一般是以乳糖为底物在强碱性条件下催化获得的,常用催化剂包括氢氧化钙(钠、钾)、硼盐、铝盐等[9]。其中前者的转化率低(~20%)且污染大;后者(硼/铝盐)转化率高,但对人体有害而完全去除成本又很高[10],这导致生产乳果糖的工艺成本居高不下,企业利润率低。欧美国家是乳糖的主要生产国,因此欧美企业在原料购买上极具优势,乳果糖生产总成本较国内企业低因而长期垄断了该产品。
近年来乳果糖的生物法研究获得突破,使用纤维二糖差向异构酶(Cellobiose 2-epimerase,CE酶,EC 5.1.3.11)能够直接催化乳糖获得乳果糖且转化率较高[11]。KIM和OH使用150 U/mL纯化后的解糖热解纤维素菌Caldicellulosiruptorsaccharolyticus来源CE酶(CSCE),能够在80 ℃、pH 7.5的条件下催化700 g/L乳糖获得408 g/L乳果糖,转化率58%,产率204 g/L·h;此外还生成了107 g/L的依匹乳糖,因此总计有74%的底物乳糖获得了转化[12]。由于乳糖溶解度较低,未转化的乳糖可以通过浓缩结晶获得回收得以进一步降低成本[13]。后续又发现Dictyoglomusturgidum、Dictyoglomusthermophilum、Caldicellulosiruptorobsidiansis等来源的CE酶适用于乳果糖的生物法制备[14](见表2)。常见的CE酶表达宿主为大肠杆菌,优点是酶活高且发酵周期短,但存在易感染噬菌体、含内毒素等问题。目前已开发了多种食品级微生物宿主来表达CE酶,包括枯草芽孢杆菌和毕赤酵母菌。其中CE酶在枯草芽孢杆菌中的酶活为7.5 U/mL(胞内)或5.3 U/mL(胞外),在毕赤酵母中的胞外分泌酶活为0.42 U/mL[15]。以上研究表明,生物法制备乳果糖技术已走向成熟,且转化率和生产强度均不低于化学法,应用前景良好。

表2 已报道的CE酶酶学性质
2 岩藻糖基乳糖的生物制备
岩藻糖基乳糖(Fucosyllactose)是被L-岩藻糖(L-fucose)基修饰的乳糖三糖,是母乳中含量最高的寡糖,即人乳寡糖HMO的一种。常见的岩藻糖基乳糖如2′-岩藻糖基乳糖(2′-FL)和3-岩藻糖基乳糖(3-FL)[16]。2′-FL在HMO中含量最高,对新生儿具有很强的益生效果,能够抑制肠道病原菌的生长并促进双歧杆菌增殖[17]。由于牛、羊奶中均不含有HMO,因此由人工合成并将其添加到奶粉产品中具有迫切的需求[18]。2′-FL和3-FL都可以通过重组大肠杆菌进行生产,方法是强化胞内的GDP-L-岩藻糖合成途径(包含基因manA、manB、manC、gmd、wcaG),同时表达岩藻糖基转移酶(基因fucT2或futA)。再将lacZ、wcaj、lon等不利于产物积累的基因敲除,即可获得能够代谢乳糖和葡萄糖(或甘油)合成岩藻糖基乳糖的基因工程菌株,其中2′-FL产量可达20.28 g/L、3-FL可达12.43 g/L[19]。此外,还可以通过外源添加L-岩藻糖的方式来合成岩藻糖基乳糖,在这种情况下产量会有较大幅度提高,例如2′-FL产量可达47 g/L[20](见表3)。构建这种代谢途径则需要过表达fkp基因,从而直接将外源L-岩藻糖转化为胞内的GDP-L-岩藻糖,进一步与乳糖缩合为2′-FL或3-FL[21]。然而,L-岩藻糖本身是稀缺的单糖,价格十分昂贵,因此外源添加L-岩藻糖目前看来尚不经济。此外,高密度发酵技术是获取岩藻糖基乳糖高产的重要手段之一,这是因为岩藻糖基乳糖的合成量具有与菌株细胞干重(DCW)增长基本一致的特点[22]。除大肠杆菌外,枯草芽孢杆菌和酵母也被用于生物法制备2′-FL。其中解脂耶氏酵母(Yarrowialipolytica)所得的最高产量可达到24 g/L,生产强度0.44 g/L·h[23],具有较好的产业化前景。国际上能够生产2′-FL的公司包括丹麦Glycom、德国Jennewein、美国Glycosyn LLC等[24],国内尚没有产业化报道。然而,生物工程技术制备HMO的工艺正获得迅速发展,相信在我国将很快进入技术转化阶段。

表3 已报道的2′-FL生物制备技术
3 D-塔格糖的生物制备
糖尿病是我国极为高发的疾病,2013年的调查研究表明我国11%的成年人患有糖尿病,近36%的人处于糖尿病前期[25]。糖尿病与肥胖有着密切联系,如何遏制肥胖成为预防糖尿病的关键问题。控制蔗糖或果葡糖浆的过度摄入能够有效减少肥胖,因此必须开发代糖产品作为替代品来满足人们的口感需求。D-塔格糖(D-tagatose)是一种优秀的代糖,分子式C6H12O6、分子量180.16;甜度与蔗糖相当,但热量仅为后者的39%(1.5 kcal/g)[26]。D-塔格糖无法被人体小肠吸收,到达结肠后能够促进肠道益生菌的生长,起到了益生元的作用[27]。此外,D-塔格糖还可以控制血糖浓度并且不导致龋齿[28]。基于以上优点,D-塔格糖已被我国批准为新食品原料(国家卫计委2014年10号公告)[13],国内企业如无锡甘泉医药科技有限公司等已完成D-塔格糖的生物法生产技术。D-塔格糖可以利用L-阿拉伯糖异构酶(L-arabinose isomerase,L-AI酶,EC 5.3.1.4)催化D-半乳糖获得,而D-半乳糖通过乳糖酶水解乳糖获得[29]。此类工艺方法已走向成熟,有较为丰富的文献报道(总结为表4);例如LIANG等人[30]利用固定化的Thermoanaerobactermathranii(TMAI)酶催化D-半乳糖获得39.5%的转化率,转化液通过酿酒酵母L1菌株可以消耗掉剩余D-半乳糖,获得纯度为95%以上的D-塔格糖液。然而,由于乳糖至D-塔格糖的总转化率较低,以上工艺的成本较高,这导致D-塔格糖的售价居高不下,限制了其大规模的应用推广。最新研究表明,通过在酿酒酵母中构建微生物细胞工厂,能够将乳糖直接发酵为D-塔格糖,减化了中间步骤[13]。伊利诺伊大学的LIU等人[31]在酿酒酵母中构建了此类代谢途径,表达了纤维二糖转运蛋白Cdt-1、β-葡萄糖苷酶Gh1-1、木糖还原酶XR、半乳糖醇-2-脱氢酶GDH;同时还敲除了D-半乳糖激酶编码基因gal1以避免D-半乳糖的消耗。经过300 h的发酵后,重组酿酒酵母将乳糖历经水解、D-半乳糖还原为D-半乳糖醇、D-半乳糖醇氧化为D-塔格糖等步骤实现了乳糖一步转化为D-塔格糖。而乳糖水解产生的D-葡萄糖用于细胞生长,最终的发酵液中D-塔格糖含量为37.69 g/L,此外还有微量的D-半乳糖(含量为D-塔格糖的10%)。由于终产物中D-半乳糖占比较小,因此D-塔格糖的分离纯化步骤较为简单。可以预见,微生物细胞工厂技术的使用实现了乳糖到D-塔格糖的一步转化,并且副产物少、有利于产品分离结晶,具有很强的应用潜力。
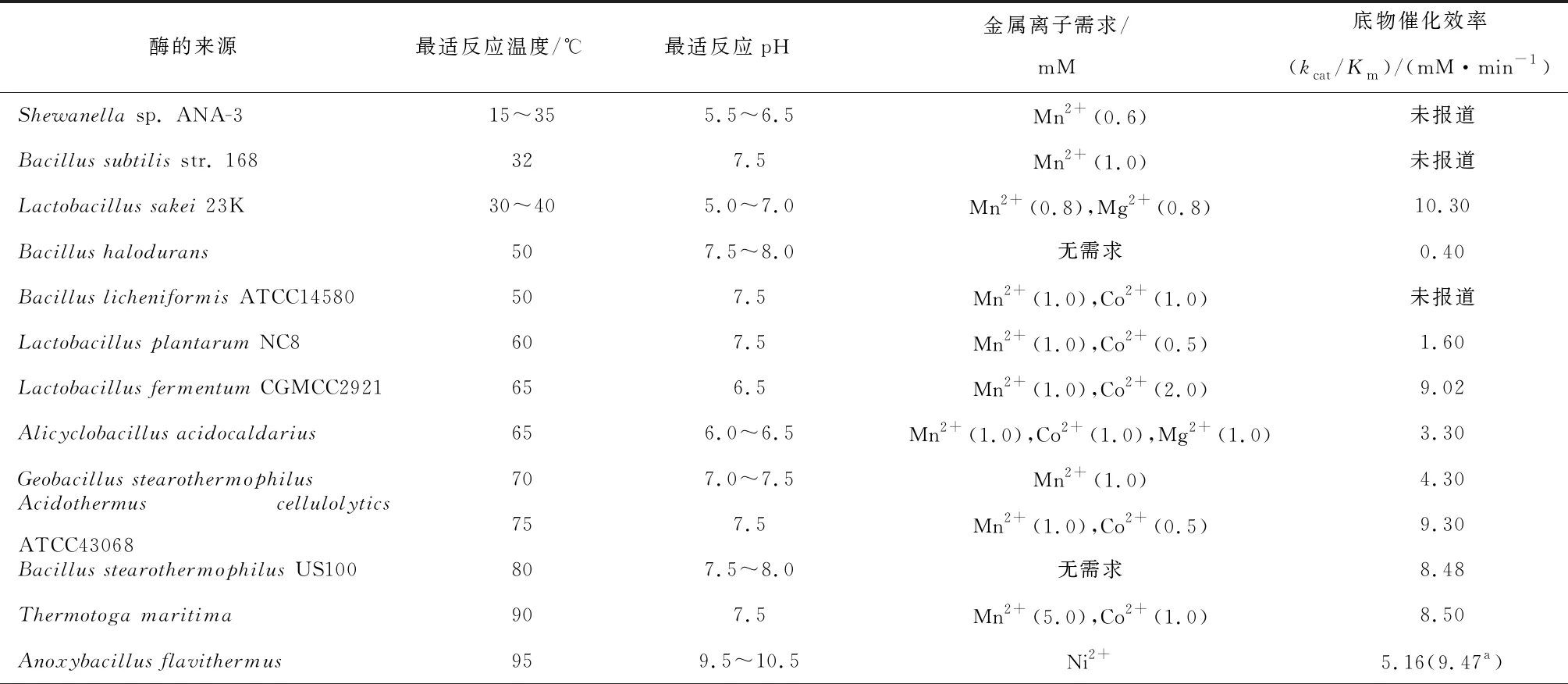
表4 不同微生物来源L-AI酶的酶学性质比较
4 低聚半乳糖的生物制备
低聚半乳糖(Galactooligosaccharides,简称GOS)是母乳中天然含有的益生元,现有临床实验数据表明,它能够改善肠道菌群,强化双歧杆菌繁殖、提升人体免疫力,还具有降低血脂、抗肿瘤和抗衰老的功效[32]。2018年全球GOS产值达到36.31亿元,我国也达到2.42亿元,呈现出逐年增长的良好态势[33]。GOS的生物制备方法主要利用β-半乳糖苷酶的转糖苷功能来催化乳糖获得。例如李美玲等[34]利用Bacilluscirculans来源的β-半乳糖苷酶催化50 g/L乳糖,加酶量6 U/g,反应温度60 ℃、pH 7.5;在该反应条件下GOS的产率为45.5%。PARK等[35]利用嗜热型的Sulfolobus solfataricus来源β-半乳糖苷酶催化600 g/L乳糖,用酶量3.6 U/mL,反应温度80 ℃、pH 6、反应时间56 h,终转化率52.5%,GOS浓度315 g/L。酶法生产GOS工艺需要解决的瓶颈问题是转化液成分复杂,包含没有被酶转化的D-葡萄糖、乳糖等杂质成分。这样造成所生产的低聚半乳糖纯度不高,因此必须通过下游分离技术来进行纯化[36]。常见的分离方法为色谱分离法,冯咏梅等报道用Sephadex G-25葡聚糖凝胶柱可将GOS纯度提高到89.39%[37]。李良玉等[38]利用模拟移动床色谱系统和顺序式模拟移动色谱进行GOS分离,进料折光度60%、系统柱温60 ℃、最终获得95.1%纯度的GOS产品。综上所述,GOS的生物技术制备工艺已日趋成熟,对乳品添加剂产业是一种重要的补充。
5 展望
乳糖作为乳制品行业常见的副产物,深加工渠道较少故需求量有限。直接废弃又易造成水体污染等问题,通过生物酶法或微生物细胞工厂合成,可以将其高效转化为高附加值产品。本文介绍的乳果糖、岩藻糖基乳糖、D-塔格糖、低聚半乳糖等分别用作非处方药和食品添加剂类产品,具有广阔的市场前景;对于乳糖资源的深加工利用是重要的技术补充,在技术路线上各产品都具有通用性。2014年仅美国的乳糖产量就达到52.6万吨,随着全球乳制品行业的不断发展,乳糖产能逐年增长;相信对乳糖资源的挖掘利用能够为乳品行业的产业升级提供新思路。

