生物活性产品角鲨烯的特性及其开发应用
程鹏飞 王海霞 伯亚慧 周成旭 严小军
(1. 宁波大学食品与药学学院, 宁波 315000; 2. 浙江海洋大学国家海洋设施养殖工程技术研究中心, 舟山 316022)
角鲨烯是一类具有六个双键的全反式三萜烯类天然化合物, 广泛存在于动物、植物、微生物等多种生物中, 人体的皮脂中也有角鲨烯的存在[1, 2]。角鲨烯可以为胆固醇、胆汁酸和类固醇的合成提供碳骨架, 是动植物甾醇和三萜类物质合成的重要中间产物。同时, 角鲨烯还具有多种生物活性, 如抗氧化、调节胆固醇代谢、解毒等, 被广泛应用于功能性食品、药品及化妆品等领域的研究开发[3—5]。
传统的角鲨烯主要来源于鲨鱼等海洋动物及某些植物。但由于对海洋野生动物及生态环境的保护, 角鲨烯生产受到极大限制。而以植物源的角鲨烯也受限于原材料的季节性以及密集劳动力需求。因此, 寻找并筛选可持续的角鲨烯资源, 利用某些微生物(尤其是微藻)以替代传统的动植物来源, 对角鲨烯的生产成本降低及海洋生态环境改善都具有重要的意义。微藻是一类广泛存在于淡水及海水, 可进行光合作用的低等植物, 并作为一种新型的角鲨烯替代来源已引起人们的关注[6]。微藻生物质常用于多糖、蛋白质、类胡萝卜素等高价值物质的生长, 在一定条件下能积累丰富的角鲨烯[7]。但目前对于以微生物(微藻)为角鲨烯潜在来源的研究并不常见, 利用微生物合成角鲨烯的机制仍未明确。基于此, 本文主要概述了高价值角鲨烯的特征、来源、代谢通路及生产应用, 以期为角鲨烯的工艺化生产与应用提供理论基础。
1 角鲨烯的化学特征
角鲨烯是由六个异戊二烯单元作为基本碳骨架组成的高度不饱和长链三萜类化合物(图 1), 分子式为C30H50, 是几类常见甾醇的前体物质。一般而言, 角鲨烯主要以对称、线性或卷曲等几种构象出现[8]。角鲨烯属于脂质不皂化物, 常温下呈液态,不溶于水, 易溶于乙醚、石油醚、丙酮及四氯化碳等有机溶剂, 具有较强的疏水性。由于其化学结构的高度不饱和性, 角鲨烯易在镍、铂等金属作用下氧化形成角鲨烷[9]。此外, 细胞角鲨烯在有氧条件下会被进一步代谢, 以合成固醇的形式在细胞膜中存在。在有氧培养下, 角鲨烯的含量与培养时间密切相关, 随着时间的延长, 其含量相应减少, 这可能与角鲨烯向固醇等下游产物的转化有关[10]。因此,在实际利用微生物进行角鲨烯的工业化生产时, 还应考虑培养时间等因素对角鲨烯产量的影响。
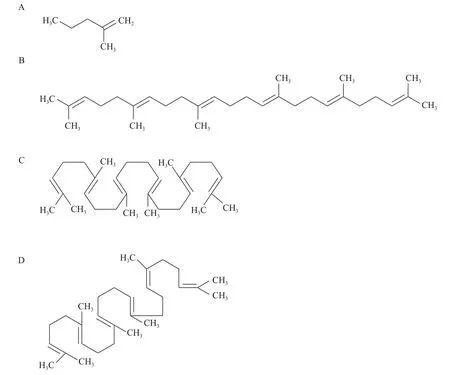
图1 角鲨烯及其前体的化学结构Fig. 1 Chemical structure of squalene and its precursor
2 角鲨烯的来源
目前, 角鲨烯的商业来源主要是深海鲨鱼的肝脏油和高等植物种子油。相比于动物、高等植物源, 一些微生物或低等植物来源的角鲨烯目前也越来越受到重视, 它们快速生长的优势为角鲨烯基础研究及其资源开发利用提供了新方向。
2.1 角鲨烯的动物来源
人们在过去几十年的研究中发现, 由于软骨鱼体内没有鱼鳔, 需要借助脂肪和油等来降低它们的身体密度。因而, 鲨鱼、鲸鱼等软骨鱼体内的角鲨烯含量较为丰富。鲨鱼肝油中, 角鲨烯含量高达80%[11], 一般在40 g/100 g以上[12], 以猎捕鲨鱼为代价提取其体内角鲨烯而造成的海洋生态环境破坏不容忽视[13]。
在哺乳动物体内, 角鲨烯一般来源于外源食物的摄入, 部分也可通过生物的内源合成。其中, 皮肤是人体产生角鲨烯的主要来源, 由皮脂合成的角鲨烯含量约占总脂质的13%[14, 15]。人体角鲨烯的分泌因皮肤部位而异, 但只有极少量能进一步转化为胆固醇, 摄入较高含量的角鲨烯也不会改变体内胆固醇水平。因此, 适当增加血清中角鲨烯的含量不仅安全, 而且具有降低胆固醇等化学预防作用。
2.2 角鲨烯的高等植物来源
除了一些传统的动物来源, 某些植物, 包括各类水果、叶子和子实体等也是角鲨烯生产的重要来源。Thorbjarnson等[16]于1935年首次在橄榄油中发现角鲨烯, 而后以植物为来源的角鲨烯研究与开发也受到越来越多的关注。橄榄油是公认的角鲨烯主要来源之一, 但其含量与生长阶段、季节性有关, 难以满足人们的需求[17]。此外, 由于橄榄油不是大宗化油类, 致使其角鲨烯生产始终有限。植物原材料的季节性生产和密集的劳动力需求等可能会限制其作为潜在替代来源[18], 进而限制角鲨烯的工业化应用[19]。随着角鲨烯资源的“稀缺”, 海洋微生物生产角鲨烯或许有引人瞩目的发展趋势。
2.3 角鲨烯的微生物来源
为了追求可持续、环保的角鲨烯生产工艺, 近些年研究人员开始尝试开发廉价无毒的角鲨烯生产方法。微生物发酵虽然积累的角鲨烯产量低于一些高等植物及鲨鱼肝油等, 但发酵过程中具有生长周期短、产量高、方法简单、原料丰富、价格低廉、环境约束少等优点, 是一种经济有效的潜在角鲨烯生产方法。
Chang等[20]从海水中分离得到一株Pseudozymogenus, 利用葡萄糖和钠氮作为营养源, 能产生340.52 mg/L角鲨烯。此外, 利用酿酒酵母(Saccharomyces cerevisia)的萜类途径生产角鲨烯, 工程菌株(FOH-0)比野生型产生的角鲨烯产量提高了29.41倍[21]。尽管如此, 酵母生产角鲨烯含量依然相对较低, 适合大规模生产的工艺还需要进一步研究。
破囊壶菌(Thraustochytrids)由于缺乏固定碳的光合器官, 能在异养条件下生产较高含量的角鲨烯[22, 23]。研究发现,ThraustochydridACEM 6063和Aurantiochytrium mangroveiFB1含有较高的角鲨烯, 分别可达到细胞干重的0.1和0.162 mg/g[24]。研究还认为,少数破囊壶菌属可产生约占细胞干重30%的角鲨烯, 如Aurantiochytriumsp.18 W-13a菌株, 其角鲨烯含量可达干重的32%[25, 26], 是迄今为止发现的角鲨烯产量最高的微生物。Chen等[27]通过对Aurantiochytriumsp.生长所需的氮源谷氨酸钠、酵母提取物及胰蛋白胨的最佳浓度进行了优化, 最终角鲨烯含量和产率分别达到0.72 mg/g和5.90 mg/L。此外,研究还发现, 酶抑制剂特比萘芬可以促进角鲨烯的生物合成, 并且对藻细胞生长的抑制作用较小[28]。然而, 利用破囊壶菌属生产角鲨烯仍然在藻株选择和累积动力学等方面存在不少问题。
不同的是, 微藻作为一种新型的角鲨烯替代来源已引起人们的关注。微藻是一类广泛存在于各类水域中, 能进行光合作用的低等植物[6]。微藻生物质常用于多糖、蛋白质、类胡萝卜素等高价值物质的生长。一些典型微藻包括斜生栅藻(Scenedesmus obliquus)、莱茵衣藻(Chlamydomonas reinhardtii)、小球藻(Chlorella fusca)和布朗葡萄藻(Botryococcus braunii)等, 在一定条件下都能积累丰富含量的角鲨烯[7]。角鲨烯的含量在不同藻株之间有所差异, 且角鲨烯的累积程度与藻株的生长阶段和脂质积累密切相关[29]。
布朗葡萄藻被认为是可高产角鲨烯的优势藻株, 在合成过程中, 不会损害藻细胞, 其高产角鲨烯的代谢途径为工程菌株的应用提供了方向。本文团队前期将B品系葡萄藻B. braunii Showa贴壁培养于1/4 N浓度的BG11培养基中, 结果发现角鲨烯的含量约提高了50%, 而且对藻细胞生长影响不大,这意味着基于低N诱导的葡萄藻高产角鲨烯特性研究可以为阐释角鲨烯代谢调控机制提供可行性思路[30]。此外, 前期研究还证实相比较于液体培养,B品系葡萄藻在贴壁培养过程中具有较高的光合利用效率和生物量产率, 可诱导产生较高的角鲨烯[31]。该藻株生长缓慢的特性限制了角鲨烯的工业化生产[32], 但对葡萄藻产角鲨烯的代谢途径展开研究是有必要的。此外, Fagundes等[33]在利用农业废水培养Phormidium autumnale生产角鲨烯时, 角鲨烯含量可达0.18 g/kg, 其中不饱和脂肪酸含量占52%, 这为角鲨烯低成本资源化生产提供了一种新的方法。
与传统的动植物源油脂产角鲨烯相比, 微生物培养成本低, 可定向改造。同时, 在利用微藻产角鲨烯时, 还含有丰富的DHA、DPA等, 具有较广阔的应用前景。但目前仍有待于进一步考察微藻藻株、提取工艺等的差异对角鲨烯含量的影响。此外, 在后续的研究中也可考虑微藻的异养或兼养发酵, 并对微藻进行定向培育以及通过基因工程手段,以获得繁殖速度快且稳定、高产的角鲨烯来源。
3 微生物细胞角鲨烯的代谢调控
由于角鲨烯的市场需求量较大, 使得通过人工对定向基因进行改造以实现角鲨烯的大规模生产成为可能。一般而言, 不同生物体合成角鲨烯的途径有许多相似之处, 主要分为3个阶段: 首先通过两条独立的途径——甲羟戊酸途径(MVA)与甲基赤藓糖醇磷酸化途径(MEP), 形成角鲨烯重要的前体物质异戊二烯(IPP)和二甲烯丙基焦磷酸(DMAPP)[34];骨架形成阶段, IPP与 DMAPP经催化形成多种三萜骨架; 最终经环化及后修饰完成三萜骨架的氧化、酰基化、糖基化及基团置换, 形成多样的萜类产物。
3.1 原核生物中角鲨烯的合成
原核生物中角鲨烯的合成因物种而异。角鲨烯的前体物质IPP和DMAPP主要通过MVA、MEP或由两种途径共同合成[34]。MEP途径主要发生在真细菌和蓝细菌中, 而MVA途径主要存在于古细菌、真核生物和某些植物的细胞质与线粒体中[35, 36]。一些专性寄生真细菌, 如立克次氏体或支原体由于可以从宿主细胞获得IPP, 因而不会利用上述两条途径合成IPP[37, 38]。
以大肠杆菌(E. Coli.)为例, 真细菌中角鲨烯形成的MEP途径如下图所示(图 2)。这条途径的关键是1-脱氧-木酮糖-5磷酸合酶(DXS), 它在原核生物的MEP途径中起着限速作用[39—43]。在MEP途径中,DXS能催化丙酮酸与3-磷酸甘油醛(G3P)缩合生成1-脱氧-D-木酮糖-5磷酸酯(DXP), 进而在DXR酶的作用下反应形成MEP。Sangari等[44]在布鲁氏菌(Brucella abortus)中发现了一种DXR样酶(DRL酶),它同样能够催化DXP向MEP转化。因此, 尽管有些细菌可能缺乏DXR, 但DRL酶的存在也可以催化该反应。随后, MEP经一系列焦磷酸化、脱羧和脱水等反应后, 形成IPP。形成的IPP在异戊二烯异构酶(IDI)的作用下, 进一步被催化生成DMAPP。此外,许多细菌中存在两种类型的IDI, 即IDI Ⅰ型和Ⅱ型。Ⅰ型反应依赖二价阳离子, 在厌氧条件下的反应Ⅱ型需要金属离子、FMN和NADPH的参与[45—47]。与大肠杆菌中典型的MEP途径不同, 蓝细菌细胞内Ⅱ型IDI失活时, DMAPP也能通过其他替代途径被合成。
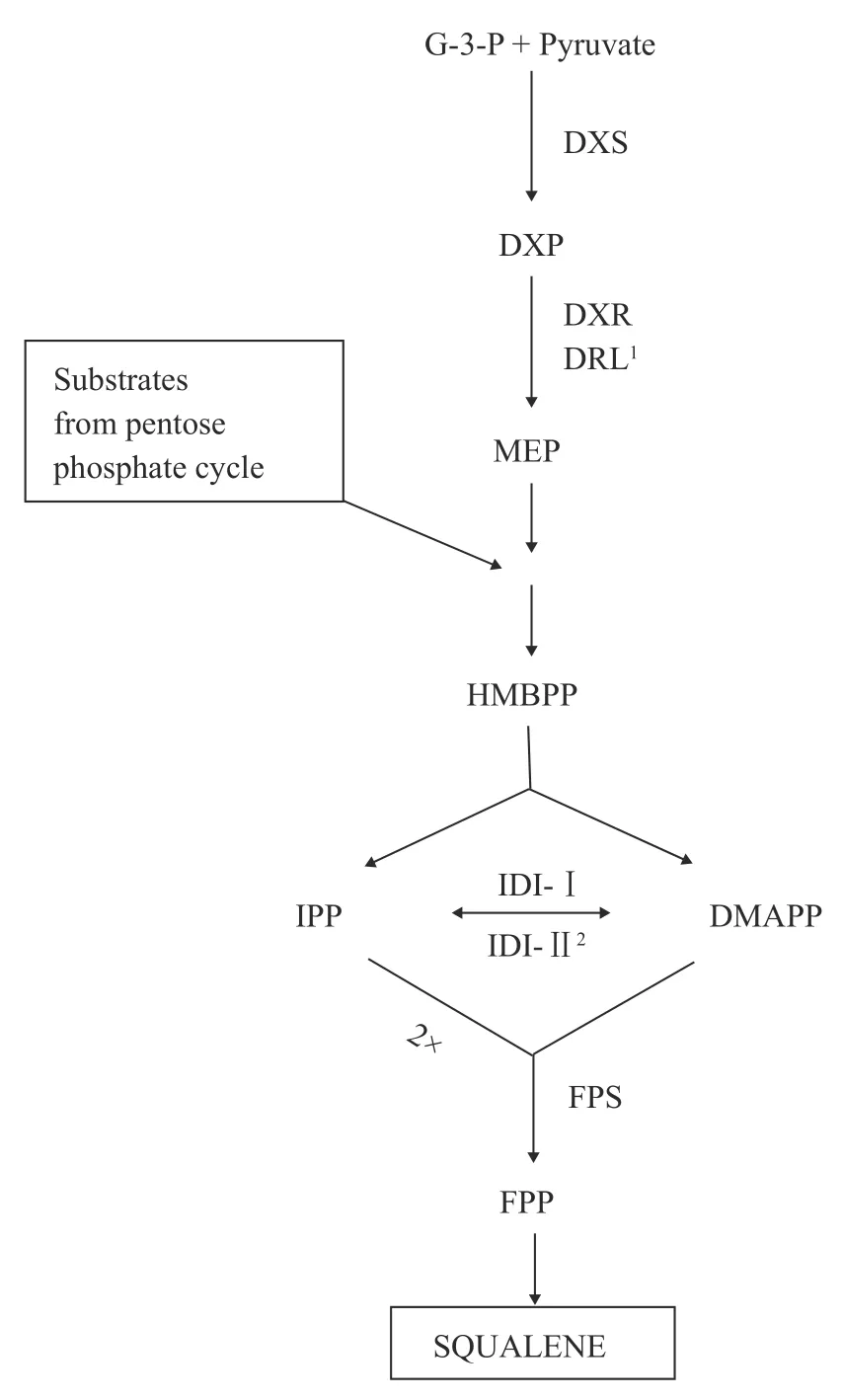
图2 大肠杆菌合成角鲨烯的MEP途径[62]Fig. 2 Squalene synthesized via methylerythritol phosphate(MEP) pathway in E. coli.
古细菌大多利用MVA途径合成角鲨烯, 例如极端嗜盐杆菌(Halobacterium cutirubrum)或嗜酸杆菌(Caldariella acidophilus)[48, 49]。其中, 参与形成MVA的三种酶主要是羟甲基戊二酸单酰辅酶A合成酶(HMGS)、3-羟基-3甲基戊二酰辅酶A还原酶(HMGR)和甲羟戊酸激酶。此外, 在古细菌中也发现了IDI Ⅱ型。例如, 在一些链霉菌(Streptomyces)中, 发现了完整的MEP和MVA途径[50]。研究表明,MEP途径主要合成初级代谢产物, 在次级代谢物的合成中, MVA途径并不是一个必需的代谢途径[51, 52]。因此, 从目前的研究来看, 相比于MEP途径, 利用MVA 途径生产异戊二烯化起源更早且更为有效。
原核生物通过上述途径形成IPP和DMAPP后,将会进一步合成法尼基焦磷酸(FPP), 然后在角鲨烯合成酶(SQS)的作用下, 两个FPP分子缩合形成角鲨烯[53—55]。角鲨烯是生成三萜类化合物重要的前体物质, 可经过角鲨烯环氧化酶(SQE)催化氧原子插入线性角鲨烯, 形成2, 3-氧化角鲨烯, 最后在2,3-氧化鲨烯环化酶家族的作用下, 经过一系列氧化还原反应生成不同碳骨架的三萜类化合物。
原核生物形成角鲨烯后向其他化合物的转化各不相同。细菌中主要是产生一些三萜类、五环藿烷类化合物参与细胞膜上的生物反应[56, 57]。藿烷类化合物主要维持膜完整性和渗透性[58], 并可以应对外部压力, 如乙醇耐受性[59]、氧扩散[60]等。藿烷类化合物的合成始于角鲨烯, 由SQE催化, 也可能通过S-2,3-氧化角鲨烯环化酶合成甾体。以上两种酶活性均在荚膜甲基球菌(Methylococcus capsulatus)中得到证实。最近, Lamb等[61]研究发现在角鲨烯形成后存在羊毛甾醇合成酶, 它是原核生物合成甾醇的一个关键组成部分, 这也证实了一些细菌可能具有合成甾醇的能力, 这可能是了解甾醇和甾体合成系统的关键。
3.2 微藻中角鲨烯的合成
与蓝细菌不同, 目前对于其他微藻中角鲨烯的形成机制尚未明细。以布朗葡萄藻为例, 它能合成多种烃类化合物, 依据其合成碳氢化合物的种类,可分为A型、B型和L型[62]。A型布朗葡萄藻主要积累长链脂肪酸衍生而成的奇数碳的二烯烃或者三烯烃; B型布朗葡萄藻主要合成三萜类化合物如甲基化角鲨烯; L型布朗葡萄藻则主要合成四萜类化合物[63]。B型布朗葡萄藻中的角鲨烯主要通过由光合反应产生的底物经MEP途径合成[64, 65](图 3)。简言之, 两个IPP和一个DMAPP分子缩合产生FPP。此外, 法尼醇或其衍生物法尼醛和3-羟基-2, 3-二氢法尼醛也可以作为FPP合成的底物[66, 67]。随后, 两个FPP分子缩合生成角鲨烯二磷酸酯, 并由SQS催化重排环丙烷的裂解从而产生角鲨烯。但环丙烷的直接裂解也会产生一种碳原子数为C30—C37的多不饱和三萜类碳氢化合物, 被称为Botryococcenes, 随后Botryococcenes进一步甲基化形成更高的同系物。目前, 已经鉴定出了一种SQS酶, 但尚不清楚该酶是否能催化角鲨烯或Botryococcenes的合成[68, 69]。角鲨烯中未用于甾醇合成的部分通常被非特异性甲基化酶甲基化, 并与其他碳氢化合物一起储存[70]。甲基化角鲨烯可进一步代谢产生botryoxanthins[71]、braunixanthin[72]和四甲基角鲨烯环氧化物[73]。然而, 一些环氧化酶会将角鲨烯转化为氧化鲨烯[74]。因此, 需要阻止B型布朗葡萄藻产生的脂质与氧原子接触, 使得脂质始终保持游离细胞外烃类化合物的形式, 例如Botryococcenes或甲基化角鲨烯。因此, 明晰B品系布朗葡萄藻产角鲨烯的代谢途径和关键酶的作用是进一步研究的重点。
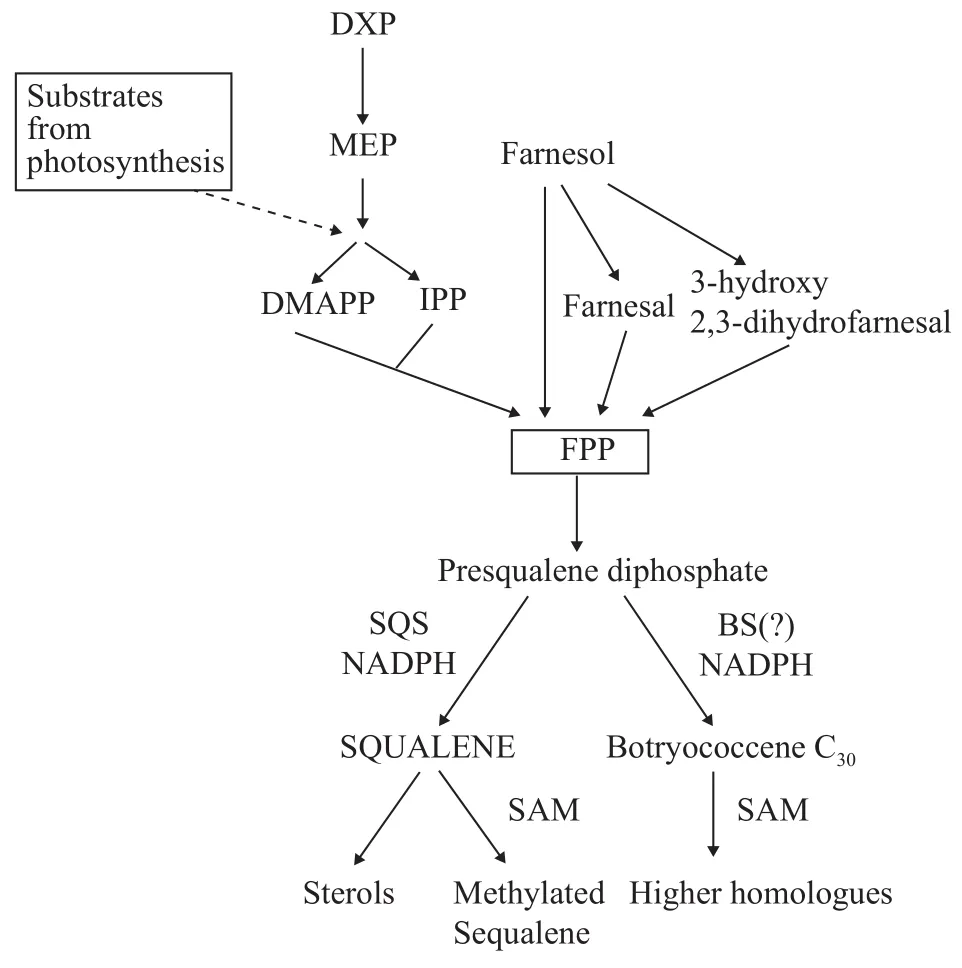
图3 布朗葡萄藻合成角鲨烯的MEP途径[74]Fig. 3 Squalene synthesized via methylerythritol phosphate(MEP) pathway in green algae B. braunii
3.3 酵母中角鲨烯的合成
7与许多真核生物相似, 酵母中甾醇的形成可以分为两部分, 首先通过MVA途径生成角鲨烯的前体物质FPP, 进而由FPP分子缩合形成角鲨烯和甾醇等物质(图 4)。研究人员前期开展了许多以酵母为真核生物模型合成角鲨烯的系统性研究。一般认为, MVA的合成途径始于乙酰辅酶A, 进而被还原为MVA。这个过程主要通过激活或降低HMGR表达来实现角鲨烯积累的高度调控。HMGR是一种内质网膜的完整蛋白质, 含有一个跨膜蛋白固醇敏感结构域, 在蛋白酶体的降解中起着重要的作用。MVA经焦磷酸化、脱羧和脱水后, 形成IPP,然后在IDI的作用下, 进一步被催化生成DMAPP[75]。随后, DMAPP在香叶基焦磷酸(GPPS)和法尼基焦磷酸合成酶(FPPS)的催化下, 依次与IPP单元生成FPP, 进而转化为角鲨烯和甾醇, 或者直接合成异戊二烯化的细胞代谢产物, 如血红素、多里醇和泛醌等物质[76, 77]。

图4 酵母中角鲨烯的合成途径[88]Fig. 4 Squalene synthesis in yeast
酵母MVA途径中的第一个调控点是HMGR。酵母细胞一般具有由HMG1和HMG2编码的两种HMGR酶, 粟酒裂殖酵母(Schizosaccharomyces)除外, 仅包含一个HMGR基因[78]。研究表明, 截短的HMG1过表达将会导致HMG-CoA还原酶活性增加约40倍, 从而提高角鲨烯积累的干重产量[79]。虽然Hmg1p和Hmg2p在功能上相似, 但它们的表达调控却不同。Thorsness等[80]报道血红素能够刺激HMG1的表达, 并会抑制HMG2的表达。此外, 将酵母细胞中的HMG1和HMG2敲除后, 由于无法生成甲羟戊酸而会失去细胞活性[80]。
前期合成的FPP分子进一步转化, 将形成该途径的终产物, 由两个FPP分子结合在SQS Erg9p的催化下产生一个角鲨烯分子[81]。与HMGR相似, ERG9也受到高度的转录调控[82]。在正常生长条件下, 酵母中的角鲨烯不会在细胞内积累, 它能有效地转化为麦角甾醇。Milla等[83]在野生型的脂滴中仅检测到了少量角鲨烯, 其余以甘油三酯(TAGs)和甾酯等形式存在。这也说明, 角鲨烯的积累并不会引起脂质毒性作用。
在麦角甾醇合成途径中, 通过上述反应形成的角鲨烯被SQE Erg1p[84]进一步转化为角鲨烯环氧化物[85], 随后进行2, 3-氧化角鲨烯的环化和羊毛甾醇的合成。该反应由ERG7基因编码的羊毛甾醇合成酶催化[86, 87]。
目前, 对于角鲨烯代谢途径的相关研究主要集中于酵母和大肠杆菌中, 而微藻生产角鲨烯的代谢通路仍不明晰。布朗葡萄藻因其低N下诱导产生角鲨烯的独特的性质有望通过对其基因注释和相关基因功能分析, 筛选与角鲨烯合成有关的基因, 研究角鲨烯合成代谢通路, 为从基因层面探究微藻角鲨烯合成机制提供基础。
4 角鲨烯的提取
一般来说, 角鲨烯主要贮藏在脂滴、膜及内质网等不同细胞器中。因此, 采取经济有效的方法从细胞中提取角鲨烯至关重要。目前, 角鲨烯的提取方法主要分为传统提取方法和新型提取方法。由于角鲨烯是一种亲脂性小分子化合物, 传统的提取方法如皂化法等需要消耗大量有机溶剂, 存在热不稳定性, 且操作过程繁琐、耗时等缺陷[89—91]。新型提取方法主要包括有超声波辅助提取、固相萃取法和超临界CO2提取法等, 这些方法在某种程度上能克服传统提取过程的局限性[92]。
4.1 超声波辅助提取法
超声波辅助提取法, 指的是借助超声波辅助溶剂从细胞中提取角鲨烯。在超声波的强烈作用下,植物和其他原料的细胞壁被破坏, 使溶剂渗透到细胞内充分反应。Kalaivani等[93]使用几种方法从啤酒酵母中提取角鲨烯, 基于超声波辅助粉碎酵母细胞, 并通过氯仿-甲醇混合有机溶剂提取, 能够有效回收细胞中的角鲨烯。该研究发现, 与60% KOH皂化法、酸性皂化法及玻璃珠法比较, 超声波辅助提取法相对高效、安全, 且超声波提取工艺回收的角鲨烯产率分别可提高3.5倍、10倍和8.1倍, 具有较好的应用前景。
4.2 固相萃取法
固相萃取法是利用选择性吸附和解析来提取、分离、富集及纯化植物油中角鲨烯的方法。该方法首先用正己烷或甲醇活化固相萃取柱(Strata SI-1柱和Bond Elute LRC氨丙基柱), 通过样品溶解到固相萃取柱后进行洗脱及后续的角鲨烯分析[94]。Sagratini等[95]用正己烷活化硅胶固相萃取柱后, 用正己烷-乙酸乙酯(体积比9﹕1)进行样品洗脱, 再以体积比为7﹕3的异丙醇-四氢呋喃溶解, 最后基于HPLC方法同时测得的角鲨烯、生育酚及β-胡萝卜素等含量。与传统的有机溶剂萃取法、皂化法相比, 固相萃取法具有有机溶剂消耗少、样品回收率高等优点。但该方法需要特定的萃取柱和萃取装置, 这在一定程度上导致角鲨烯提取成本的增加。
4.3 超临界流体萃取法
与其他方法不同, 超临界流体萃取结合了液体和气体的优点, 分离选择性较高, 可在低温下提取,适用于分离和精制低挥发性、热敏性、易氧化的物质。由于CO2是一种“绿色溶剂”, 且无毒、不易燃、低廉可再生, 因此使用超临界CO2提取角鲨烯是一种相对温和的方法[96, 97]。利用超临界CO2萃取技术从酒糟中分离提取角鲨烯, 样品在12—30 MP和40℃的等温条件下进行收集, 角鲨烯产量可达16.9 g/kg[98]。Kraujalis等[92]选择超临界CO2法提取角鲨烯, 当萃取压力为55 MPa时, 添加5%的乙醇作为辅助溶剂对苋菜籽中角鲨烯和生育酚进行萃取,不皂化物中角鲨烯和生育酚含量分别为2.89 g/kg和317.3 mg/kg。Bouriakova等[99]对植物油脱臭馏出物(ODD)先进行超临界乙醇酯化反应, 降低颗粒中FFA的含量, 再利用超临界CO2萃取提取角鲨烯, 从橄榄、向日葵和大豆油中分别测定了角鲨烯的得率和纯度。Bondioli等[100]利用超临界CO2萃取法从橄榄油脱臭馏出物中回收角鲨烯, 该方法可回收约90%的高纯度角鲨烯。比较而言, 超临界CO2萃取法虽然萃取条件温和、选择性好、提取效率高、无毒害溶剂残留, 但同时也存在设备成本高, 不能连续萃取等缺点。
总体来说, 目前已有的多种提取方法在甾醇、角鲨烯的分离及磷脂、多不饱和脂肪酸的萃取、分级等方面仍存在不同因素的限制。但随着亚临界、循环超声等技术在油脂提取方面的应用与推广, 角鲨烯提取制备技术有望实现新的突破。同时,在实际生产中应适当考虑经济效益情况, 选择操作简便、设备投资较低的提取方法, 或可考虑与其他技术相耦联, 以形成集成工艺在商业水平中降低成本, 获得最大的经济效益。
5 角鲨烯的应用
角鲨烯作为一种有效的单线态氧淬灭剂, 含有六个非共轭双键, 可以终止脂质自氧化过程中过氧化物的链式反应, 以清除自由基, 实现抗氧化等作用。此外, 角鲨烯还可用于保健食品、化妆品和医药领域, 如抗衰老、抗疲劳、抗皮肤癌、修复细胞等[101]。
5.1 食品领域中的应用
角鲨烯作为一种自由基清除剂, 常以功能性食品添加剂的形式用于食品中, 制成胶囊, 以达到促进人体新陈代谢, 增强身体免疫力等目的。角鲨烯因具有良好的抗氧化活性, 已被添加到大豆油、花生油等食用植物油中[102], 通过抑制或延缓油脂氧化来提高食用植物油的稳定性, 从而延长食品的保质期[103]。然而, 角鲨烯因易氧化, 水溶性差等特性, 目前在我国仍未被明确列入食品添加剂的国家标准中。
5.2 化妆品领域中的应用
角鲨烯对自由基的稳定性使人体皮肤表面能够抵抗脂质过氧化, 可作为保湿霜中的抗氧化剂、抗静电剂和润肤剂等。它能够迅速渗透到皮肤中,不会留下油脂痕迹, 在与其他油脂和维生素充分混合后, 能避免高温或紫外线对皮肤的伤害, 防止皮肤水分的流失, 从而达到保湿的目的。值得注意的是, 角鲨烯加氢后形成的角鲨烷是市场上比角鲨烯更有效的抗氧化剂, 纯度高达99%。Okuda等[104]发现, 角鲨烯经过5%月桂基硫酸钠处理后, 可以逆转大鼠和人的皮肤失水状况。因此, 角鲨烯在化妆品领域具有广泛的应用价值。
5.3 医学领域中的应用
在医学领域, 角鲨烯佐剂常被广泛用于疫苗和药物载体[105], 可以刺激免疫系统, 增强给定抗原的免疫反应。同时, 由于角鲨烯被公认为可以提高疫苗有效性, 这也是在近期全世界疫情大背景下制备新冠疫苗时所需的原材料之一。Schmidt等[106]发现, 含角鲨烯的佐剂可使中和抗体反应增强约100倍, 并显著降低病毒载量。同时, 作为合成甾醇的前体物质, 它对胆固醇的降低有一定作用, 可用于药品和保健品, 以促进血液循环, 预防和治疗因血液循环不良引起的心脏病、高血压、低血压和中风等疾病, 显著减缓冠心病、心肌炎、心肌梗塞等。研究人员通过添加外源角鲨烯可以降低HMGCoA还原酶的活性, 从而抑制胆固醇的合成[107]。Smith等报道角鲨烯可以通过激活过氧化物酶体增殖物激活受体(PPARs)来调节脂质代谢[2]。尽管角鲨烯对活体动物的心脏和血细胞有保护作用, 但其在活体动物中的作用机制尚不明确。
不仅如此, 许多研究结果还表明, 角鲨烯可以通过氧化应激发挥抗肿瘤作用, 或通过抑制某些致癌物的活性, 增强机体对肿瘤的抵抗力, 减轻上皮细胞的氧化应激反应。经常大量食用包括橄榄油和鲨鱼肝油等含角鲨烯产品的营养物质, 可以有效预防癌症。在大鼠的活体实验中发现, 通过使用150 mg/kg环磷酰胺诱导实验大鼠的毒性, 将不同浓度的角鲨烯[0.2—1.0 mL/(d·ind.)]添加到饮食中,0.4 mL剂量处理后能够以最小剂量和最大效率减轻氧化损伤[108]。此外, 还有研究表明, 角鲨烯与抗肿瘤药物阿霉素(角鲨烯基阿霉素, SQ-DOX)纳米组装后可以提高肿瘤细胞对阿霉素的敏感性, 降低心脏毒性, 具有显著的抗肿瘤治疗效果[109, 110]。Palaniyandi等[111]在对胃癌细胞系的体外研究发现, 角鲨烯对癌细胞的增殖具有显著抑制作用, 当角鲨烯浓度达到50μg/mL时, 抗胃癌效果更强。目前, 角鲨烯及其些衍生物也常被用作抗毒制剂[112]。除此之外, 角鲨烯对其他疾病如溃疡、痔疮、皮炎等也有一定的疗效[113, 114]。
6 结论
角鲨烯因具有较强的生物活性而被广泛应用于食品、医药及化妆品等领域。随着对海洋野生动物、渔业资源及海洋环境的重点保护, 角鲨烯的商业化生产受到了极大限制。一些以破囊壶菌、微藻、酵母等微生物为绿色可持续源的角鲨烯开发越来越受到重视。目前的研究对于原核生物及以酵母为代表的真核生物的合成机制较为明晰, 对于以微藻这一成本低廉、易于繁殖、环境适应强的角鲨烯合成代谢通路研究较少。其中, 布朗葡萄藻在低氮胁迫下高产角鲨烯的代谢途径或许为工程菌株的应用提供了方向。此外, 角鲨烯因自身易氧化、提取效率低、干扰物质多等因素, 以及对绿色可持续源(藻类)角鲨烯合成途径认知的缺乏, 角鲨烯的广泛应用依然存在不少困难。因此, 未来的研究或可通过开展高含量角鲨烯的微生物(藻类)筛选, 利用基因工程手段提高角鲨烯代谢通路的相关水平, 以及优化高效低成本的角鲨烯提取技术是角鲨烯产品开发与应用值得优先考虑的技术工艺。

