越冬胁迫对草鱼抗氧化能力及脂肪酸组成的影响
武文一 吉 红
(西北农林科技大学动物科技学院, 杨凌 712100)
在水产养殖中, 越冬(尤其是北方地区)是一个特殊的阶段, 鱼类遭受多种越冬应激影响, 例如食物匮乏、水温低和光照[1]。鱼类的免疫反应随着季节变化而变化, 冬季鱼类的免疫功能受到抑制, 同时造成较高的氧化应激反应, 进而导致鱼类高死亡率[2]。鱼类动员机体储备的能量物质, 以度过食物短缺时期, 例如在越冬期间[3]。这种动员不仅仅包括肝胰脏, 还包括肌肉和脂肪组织中的脂质分解;以肌肉中蛋白质为主要能量来源; 或者将肝糖原或肌糖原分解成葡萄糖作为能量底物[4]。根据本实验室的前期的研究结果, 越冬期间, 脂质动员是作为鱼类应对越冬胁迫的最重要能量供应方式之一, 自始至终从越冬开始到越冬结束维持鱼体能量之稳态[5]。有研究表明, 鱼类在长期营养匮乏胁迫下, 动员能量抵御不利应激的同时, 诱导机体产生了活性氧自由基(ROS), 长期累积造成氧化应激[6,7]。过多的ROS会破坏机体抗氧化系统的平衡以及稳定, 造成细胞的损伤、细胞核的凋亡以及脂肪酸过氧化[8,9]。尤其在越冬期间作为主要供能物质的脂肪酸, 其供能作用受到巨大威胁以及挑战。最直接结果就是降低供能水平, 造成机体抗氧化力以及免疫力的进一步降低, 故而提高了死亡率[10]。越冬期间造成了氧化应激的过度产生, 提高了鱼体死亡, 因此探索并解决越冬胁迫对鱼体抗氧化力乃至免疫力之间的相互作用关系具有重要的意义。
草鱼(Ctenopharyngodon idellus)作为我国主要经济淡水鱼之一, 其产量居2019年中国养殖鱼类产量的榜首, 达553.3×107kg[11]。由于草鱼生长迅速,繁育技术较为成熟, 价格亲民, 营养丰富, 因此深受养殖者以及消费者的欢迎[12]。但是在越冬胁迫下面临着鱼体内ROS的过量生成, 诱导了氧化应激胁迫。而过度的氧化应激可能导致机体免疫力下降,诱发疾病甚至死亡率的提高, 不利于草鱼水产养殖业的健康发展。为了建立有效的策略, 并指导管理决策以改善该草鱼的越冬存活率, 因而需要更好地了解越冬驱动的高度氧化应激的相互作用。因此,本研究以草鱼为研究对象, 探索越冬条件下氧化应激对草鱼免疫和抗氧化能力的影响, 以及与机体脂肪酸组成变化之间的相互联系, 为缓解草鱼越冬期间产生过度的氧化应激的反应以及降低鱼体死亡率提供相关的理论依据。
1 材料与方法
1.1 实验材料
实验用鱼均取自西北农林科技大学安康水产试验示范站室外培育池塘, 选择同一批次养成商品规格的草鱼, 挑选大小整齐以及健壮的个体作为实验对象, 实验鱼体重(1053.33±16.11) g。同时在室外培育水泥池中驯化两周后开始实验, 驯化期间每日正常投喂商品饲料(粗蛋白28%, 粗脂肪6%)。
1.2 实验条件和方法
实验在室外培育水泥池中进行(4 m×4 m×1 m),选取8个实验池, 中间用隔网隔开, 上面架设遮阳网,水深控制0.50 m左右, 水容量8 m3左右。经过2周投饲驯化后, 停食1天进行分组; 随机分为7组, 每组3个重复, 每个重复15尾鱼。当水温自然下降到草鱼停止摄食(水温: 15℃)时, 实验开始; 当水温自然升高到草鱼开始重新觅食(水温: 15℃)时实验结束,此过程即为越冬期。实验共计7 组, 分别为饥饿0周(Week 0)、1周(Week 1)、2周(Week 2)、4周(Week 4)、8周(Week 8)、12周(Week 12)和16周(Week 16)。实验用水为曝气后井水, 流水环境, 每2周清污一次。每日定时监测水温、水质, 同时观察实验鱼鱼体的健康状况以及死亡状况。实验用水条件:pH 7.8—8.2, 溶解氧5—6 mg/L, 氨氮<0.1 mg/L, 亚硝酸盐<0.01 mg/L, 硫化物<0.05 mg/L。
1.3 样品采集
采样程序经过西北农林科技大学动物保护与利用委员会批准, 同时按照动物福利与道德规范进行执行。在各实验组饥饿处理结束后, 所有鱼均用50 mg/L MS222麻醉后, 再对其进行取样。每组实验鱼, 逐一测量体质量、体长和全长等指标,计算肥满度。每个平行随机抽取2尾鱼进行尾静脉采血, 4℃冰箱静置2h后, 4℃离心(3000 r/min,15min), 上层澄清透明淡黄色的血清速冻于液氮中, 而后转入–80℃冰箱保存, 用作血清抗氧化酶活性指标测定; 每个平行随机抽取2尾鱼在冰盘上进行解剖, 取其内脏团, 分离肝胰脏、肾、脾及腹腔脂肪等组织, 称重, 同时量取肠道长度, 计算脏体比、肝体比、肾指数、脾指数、腹腔脂肪指数及肠体比等指标。随后在上述分离组织中, 取部分肝胰脏、肌肉、前肠和腹腔脂肪组织速冻于液氮中, 随后转–80℃冰箱保存, 用作酶活性测量及脂肪酸的测定。
1.4 测定指标和方法
根据以下公式, 计算肥满度、肝体比、脏体比、肠体比、肾指数、脾指数和腹腔脂肪指数:
肥满度(Condition factor,CF, g/cm3)=鱼体重×100/体长3;
肝体比(Hepatosomatic index,HSI)=肝胰脏重×100/鱼体重;
脏体比(Viscerosomatic index,VSI)=内脏重×100/鱼体重;
肠体比(Relative intestine length,RIL)=肠长×100/体长;
肾指数(Kidney index,KI)= 肾脏重×100/鱼体重;
脾指数(Spleen index,SI)= 脾脏重×100/鱼体重;
腹腔脂肪指数(Intraperitoneal fat body index,IPFI)=腹腔脂肪重×100/鱼体重;
成活率(Survival rate,SR, %)=最终鱼数×100/初始鱼数。
肝胰脏、肌肉、前肠、脂肪组织和血清中的丙二醛(MDA)、过氧化氢酶(CAT)和总超氧化物歧化酶(SOD)活性/含量使用南京建成生物工程研究所试剂盒测定(货号分别是: A003-1-2、A007-1-1和A001-3-2), 谷胱甘肽 S-转移酶(GST)活性和超氧阴离子含量使用北京索莱宝科技有限公司试剂盒测定(货号分别是: SN101和BC1295), 蛋白质浓度使用南京建成生物工程研究所考马斯亮蓝染色法试剂盒(货号: A045)测定。
脂肪酸测定分析过程中, 脂肪提取参照Tian等[13]的方法。取组织样品大约5 g, 放置于10 mL离心管;加入氯仿−甲醇混合液(体积比2﹕1)溶液5 mL, 高速匀浆后, 摇床震荡2h使之充分混匀, 随后再用定量滤纸过滤。加入4 mL 去离子水, 震荡混匀后在离心机上进行3000 r/min离心5min, 弃上清液及中间组织蛋白层, 下层40℃水浴蒸干。蒸干后加入1 mL正己烷(色谱纯)溶解提取出的油脂。油脂的皂化及甲酯化参照Tian等[13]的方法, 加入1 mL 氢氧化钾/甲醇溶液(0.4 mol/L), 再进行30min的甲酯化。最终加入2 mL去离子水, 震荡混匀后在离心机上进行3000 r/min离心5min, 取上层溶液–20℃保存。样品首先皂化以及甲酯化后, 使用气相色谱仪(Agilent7820a, Agilent Technologies, Santa Clara, CA, USA)进行测定。脂肪酸甲酯样品, 通过与脂肪酸甲酯混合标准品(47015-U, Sigma-Aldrich, USA)进行比较鉴定。取1 μL混合物进行上机检测。脂肪酸组成的相对值分析按面积归一化法计算, 以总脂肪酸的百分比形式呈现[14]。
1.5 数据处理
所有数据均采用SPSS统计软件(19.0版, Chicago, IL, USA)的单因素方差分析和Duncan’s多重比较检验进行分析。使用Origin Pro 2017C(Northampton,MA, USA)软件, 采用协方差矩阵法(Covariance matrix)对不同组织抗氧化酶活性数据进行主成分分析(Principal component analysis, PCA)分析, 解释不同越冬时间对不同组织抗氧化能力的相对影响和差异; 同时采用协方差矩阵法(Covariance matrix)对肝胰脏、肌肉和脂肪组织脂肪酸数据进行主成分分析分析[15], 解释不同越冬时间对上述组织脂肪酸组成的相对差异。采用相关矩阵法(Correlation matrix)对肝胰脏、肌肉和脂肪组织脂肪酸与酶活性数据进行主成分分析分析[16], 解释不同越冬时间处理对肝胰脏、肌肉和脂肪组织中的抗氧化能力与脂肪酸组成的相对差异。其中, 各组织脂肪酸数据首先进行正(余)弦或对数转换, 使之方差齐性, 以适应PCA分析对线性关系的要求[17], 再进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较检验; 主成分分析中的因子提取使用, 按特征值大于0.5的标准确定, 为了使因子易于解释和命名, 采用方差最大正交旋转法对其进行旋转处理。所有数据用平均值±标准差(mean±SD)的方式表示。P<0.05为差异显著。柱状图采用Prism 7 软件(Graph Pad Software Inc., San Diego, USA)进行绘制。
2 结果
2.1 不同越冬时间对草鱼生物学性状的影响
随着越冬时间延长, 越冬草鱼体重、肝胰脏重量、肥满度、肝体比、脏体比、肠体比和腹腔脂肪指数等指标均呈现显著下降的趋势(P<0.05); 而肾指数和脾指数呈现显著上升的趋势(P>0.05; 表 1)。

表1 不同越冬时间处理对草鱼生物学性状的影响Tab. 1 Effects of different overwintering time treatment on biometric parameters in grass carp (n=3)
2.2 不同越冬时间对草鱼组织抗氧化指标的影响
如图 1所示, 随着越冬时间延长, 肝胰脏、肌肉、前肠、脂肪组织和血清中抗氧化能力相关指标均发生了显著变化(图 1A—E;P<0.05), 故而采用主成分分析法降低原有多个组织中抗氧化能力相关指标变量的维度, 用较少的独立公因子反映原有变量的绝大部分信息。图 2显示了经PCA处理后形成的评分图和载荷图。载荷特征值如表 2所示, 只有特征值大于1.0才被视为数据差异的重要主成分(根据Kaiser规则)。前3个公因子的特征值均大于1.0, 表明这3个公因子对PCA解释的累计方差有着重要贡献。PC1和PC2一起解释了98.96%的累计方差贡献率(方差贡献率分别为84.79%和14.17%),PC3只解释0.96%方差贡献率。因此, 3个公因子足以解释不同越冬处理下, 不同组织中不同抗氧化能力相关指标的变化。在评分图中, 不同颜色椭圆面积大小表示不同组织中抗氧化能力相关指标在不同越冬时间处理下的变化趋势, 面积越大, 表示抗氧化能力相关指标在越冬时间处理下变化程度越大, 那么该组织在越冬时间内其抗氧化能力指标体系变化越剧烈。椭圆面积由大到小依次是: 脂肪组织>肝胰脏>肌肉>前肠>血清。显示脂肪组织在越冬时间内其抗氧化能力指标体系变化程度最剧烈,间接体现脂肪组织在越冬期间所有氧化应激程度最大; 其次是肝胰脏和肌肉, 变化最小的是前肠和血清。而载荷图显示, SOD和CAT对总体抗氧化能力的贡献中起主要影响(主成分载荷特征值绝对值大于0.5)。

表2 协方差矩阵法下的显著主成分载荷特征值分析Tab. 2 Eigen analysis of the covariance matrix loadings for significant principal components

图1 不同越冬时间处理对草鱼各组织抗氧化指标的影响Fig. 1 Effects of different overwintering time treatment on antioxidant indexes in tissues of grass carp (n=3)

图2 通过分析不同越冬时间处理下草鱼各组织中抗氧化能力, 根据选定的抗氧化酶活性含量变量(图 1)生成PCA评分图和载荷图Fig. 2 PCA score plot and loading plot are generated based on selected antioxidant capacity variables (Fig. 1) obtained by analyzing the fatty acid composition in tissue and serum of grass carp under different overwintering time treatments
2.3 不同越冬时间对草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成的影响
根据上述结果, 不同越冬时间内肝胰脏、肌肉和脂肪组织中抗氧化体系变化最剧烈, 故而选定这3种组织进行脂肪酸比例测定。随着越冬时间的增长, 肝胰脏、肌肉和脂肪组织中各类脂肪酸组成比例均产生了显著差异(P<0.05; 表 3—5)。通过主成分分析, 图 3中评分图表示不同越冬时间处理下草鱼肝胰脏、肌肉和脂肪组织中脂肪酸比例的变化趋势, 各组织在不同越冬时间处理下, 均表现出了较大的差异性; 在肝胰脏中, 越冬第0、第1和第4周处理组在评分图第一四象限, 越冬第2和第12周处理组在第二象限, 越冬第8和16周处理组在第三象限; 在肌肉中, 越冬第0、第1、第4和第8周处理组在评分图第三四象限, 越冬第2周处理组在第一象限, 越冬第12和第16周处理组在第二象限; 脂肪组织中, 越冬第2周处理组在第一象限, 越冬第0、第8、第12和第16周处理组在评分图第二三象限, 越冬第1和第4周处理组在评分图第四象限。表 6中,主成分分析后, 对肝胰脏、肌肉和脂肪组织分析得出: 前3个公因子累计贡献率均超过95%, 表明可以使用上述3个主因子(PC1、PC2和PC3)较好地代表18项脂肪酸变量指标。结合图 3, 对肝胰脏、肌肉和脂肪组织载荷图进行分析可得: 肝胰脏PUFA比例变化对总体脂肪酸比例变化产生主要影响(主成分载荷特征值大于0.5), 在越冬期间, PUFA比例变化呈现显著上升(P<0.05); 肌肉C18:2n-6和C16:0比例变化对总体脂肪酸组成产生了主要影响, C18:2n-6比例变化在越冬期间呈现先显著下降而后显著上升, C16:0比例变化显著下降(P<0.05); 腹腔脂肪PUFA、n-6PUFA、SFA和MUFA比例变化对总体脂肪酸比例产生了主要影响, 越冬胁迫期间, PUFA、n-6PUFA和MUFA比例变化呈现显著下降后上升保持稳定, SFA比例变化呈现显著上升后下降保持稳定(P<0.05)。

表6 协方差矩阵法下的显著主成分载荷特征值分析Tab. 6 Eigen analysis of the covariance matrix loadings for significant principal components
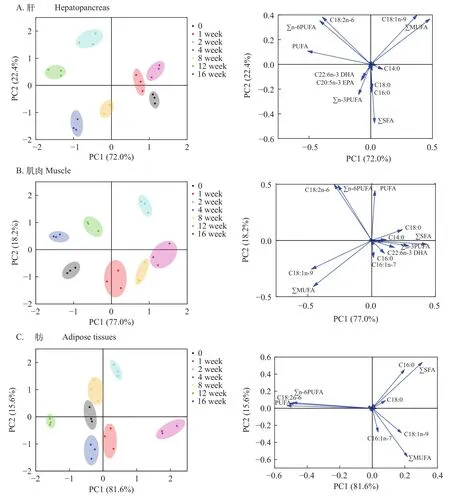
图3 通过分析不同越冬时间处理下草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成, 根据选定的脂肪酸变量(表 3—5)生成PCA评分图和载荷图Fig. 3 PCA score plot and loading plot are generated based on selected fatty acid variables (Tab. 3—5) obtained by analyzing the fatty acid composition in hepatopancreas, muscle and adipose tissue of grass carp under different overwintering time treatments

表3 不同越冬时间处理对草鱼肝胰脏组织脂肪酸组成的影响Tab. 3 Fatty acid composition of hepatopancreas in grass carp under different overwintering time treatments (% total fatty acid; mean±SD;n=3)
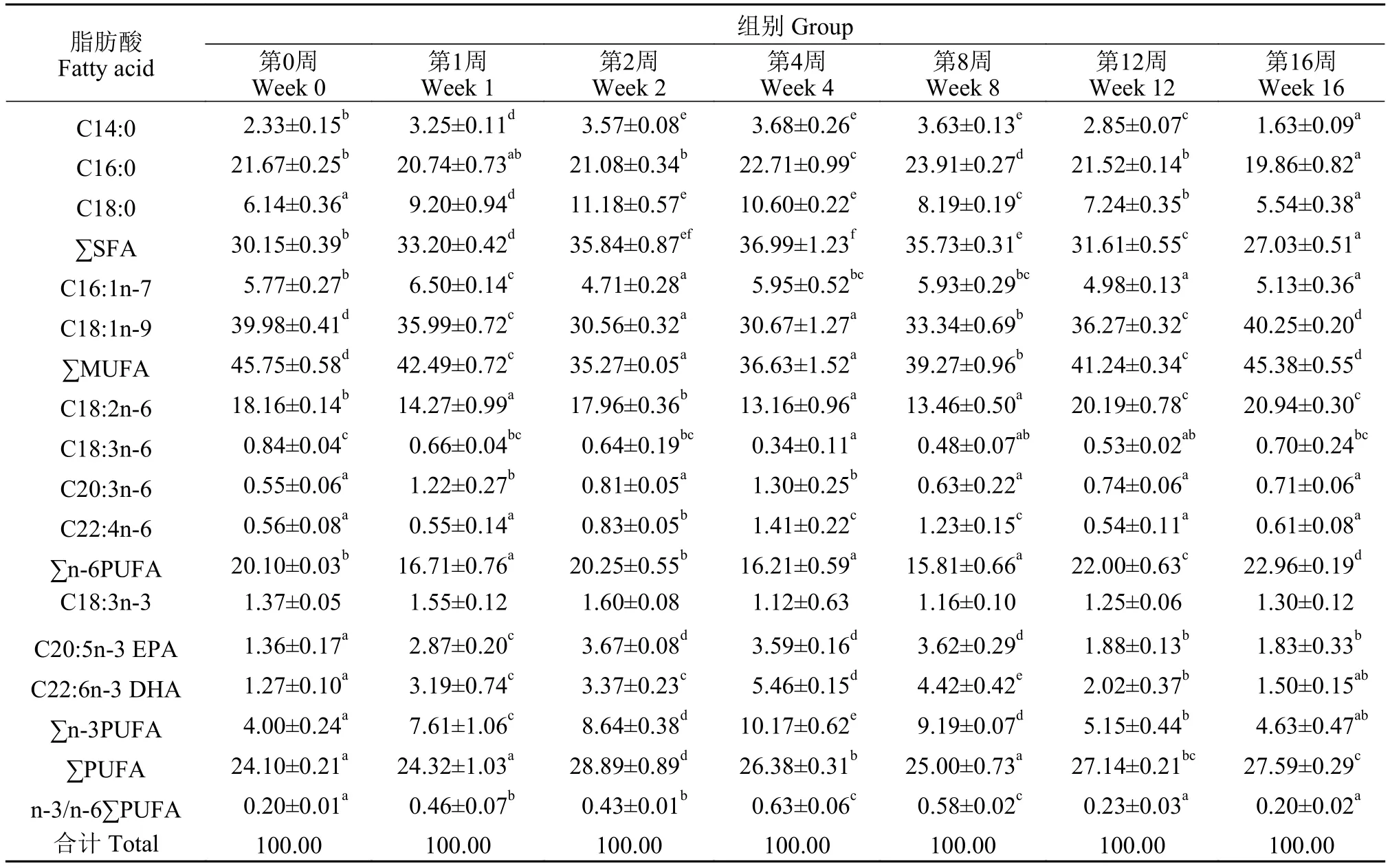
表4 不同越冬时间处理对草鱼肌肉组织脂肪酸组成的影响Tab. 4 Fatty acid composition of muscle in grass carp under different overwintering time treatments (% total fatty acid; mean±SD; n=3)
2.4 不同越冬时间对草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成和抗氧化能力相关指标关联性的影响
对越冬胁迫下, 草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成以及抗氧化能力的相关指标进行了相关矩阵法主成分分析之关联性分析(图 4)。载荷特征值如表 7可得: 当特征值大于1.0才会认为是数据差异的重要主成分(Kaiser规则)。由于前3个公因子特征值均大于1.0, 表明前3个公因子对PCA解释累计方差贡献率有着极其重要的贡献。肝胰脏和肌肉PC1、PC2和PC3累计方差的贡献率超过了80%, 脂肪组织累计方差贡献率则超过了75%。但是载荷特征值表 7显示, 没有任何指标变量起到了主要影响(主成分载荷特征值绝对值大于0.5), 但是按高低排序, 发现其中最具有影响作用的3个变量,分别是肝胰脏中的MUFA、n-3PUFA和PUFA; 肌肉中的DHA、n-3PUFA和MUFA; 脂肪组织中的SFA、C16﹕1n-7和PUFA。图 4中, 肝胰脏脂肪酸组成的比例和抗氧化能力指标位于得分图的同一区域, 如CAT、SOD、GST和脂肪酸C18﹕2n-6、C18﹕3n-6、n-6PUFA、PUFA均在第二象限紧密聚集, MDA和脂肪酸C20﹕3n-6、C18﹕1n-9、MUFA均在第一象限紧密聚集, 表明存在正相关; 肌肉脂肪酸组成比例和抗氧化能力指标位于得分图的同一区域, 如MDA、SOD、GST和脂肪酸C18﹕1n-9、MUFA均在第一象限紧密聚集, CAT和脂肪酸C16﹕0、C16﹕1n-7、C22﹕4n-6、DHA均在第二象限紧密聚集, 表明存在正相关; 脂肪组织脂肪酸组成比例和抗氧化能力指标位于得分图的同一区域,如CAT、SOD、GST和脂肪酸C16﹕0、C18﹕0、C20﹕3n-6均在第四象限紧密聚集, MDA和脂肪酸SFA、MUFA、EPA均在第一象限紧密聚集, 表明存在正相关; 虽然这些变量对方差贡献较小, 但从该分析中依然获得了组织脂肪酸组成与抗氧化能力相关变量间较为积极的关联性的结果。
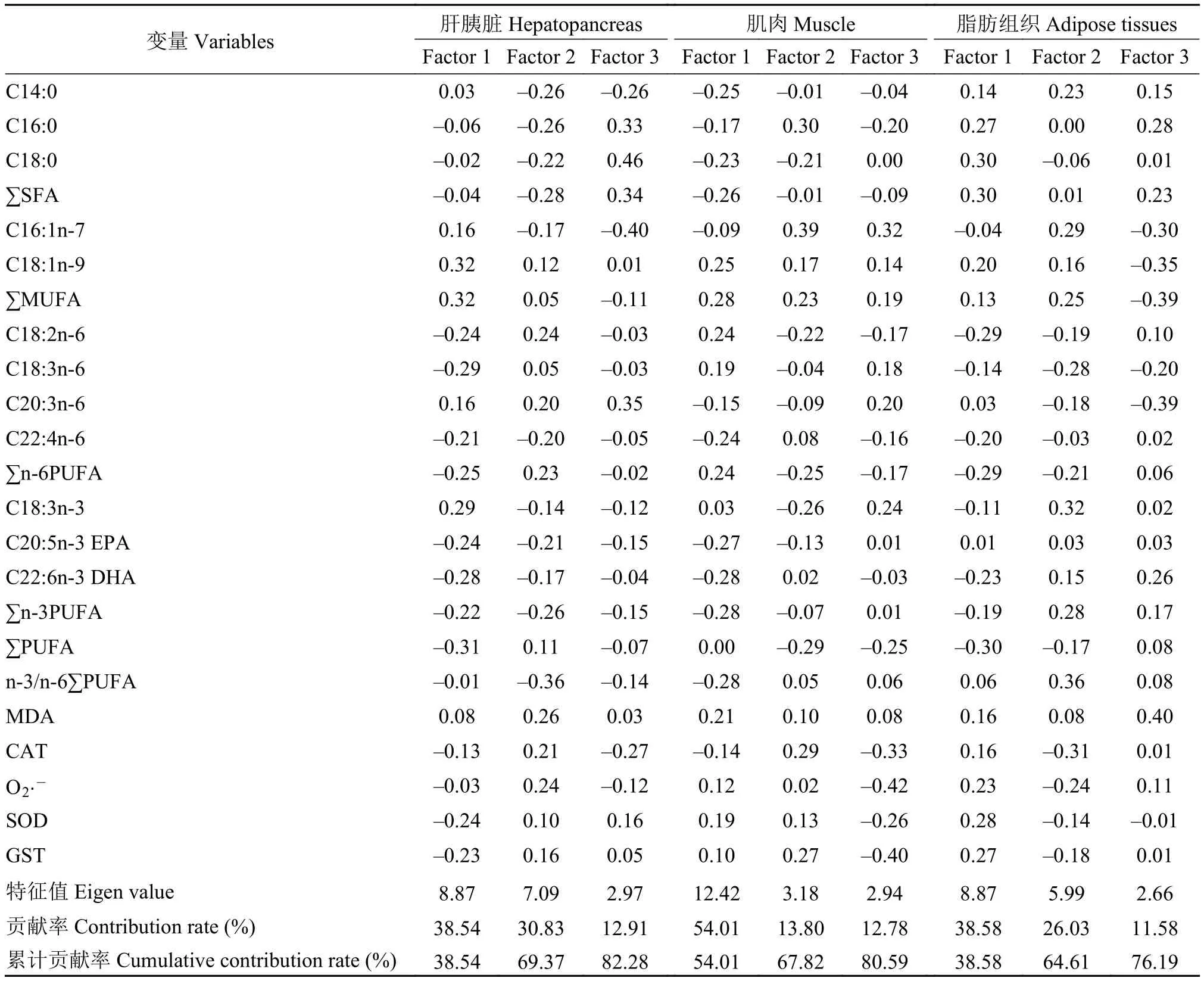
表7 相关矩阵法下的显著主成分载荷特征值分析Tab. 7 Eigen analysis of the correlation matrix loadings for significant principal components

图4 不同越冬时间处理对草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成及抗氧化能力的主成分分析Fig. 4 Principal component analysis (PCA) of fatty acid composition and antioxidant capacity variables in hepatopancreas,muscle, foregut, adipose tissue and serum of grass carp under different overwintering time treatments

表5 不同越冬时间处理对草鱼腹腔脂肪组织脂肪酸组成的影响Tab. 5 Fatty acid composition of adipose tissue in grass carp under different overwintering time treatments (% total fatty acid; mean±SD;n=3)
3 讨论
3.1 不同越冬时间对草鱼生物学性状的影响
鱼类在自然界生长过程中, 经常面临饥饿这一种自然生理胁迫。在饥饿胁迫影响下, 鱼体往往只能依靠自身的营养物质的消耗来维持机体能量的代谢平衡[18]。生物学性状是反映不同状态下鱼体营养储备消耗情况最直接量化指标[19]。本研究结果表明, 在越冬胁迫下, 草鱼的生物学性状参数中,体重、肝胰脏重量、肥满度、肝体比、脏体比、肠体比和腹腔脂肪指数均呈现显著下降的趋势, 但是肾指数和脾指数呈现显著上升的趋势; 相比较肝胰脏质量和腹腔脂肪指数, 则在第1和第2周就出现了显著的下降。这表明在越冬期间, 肝胰脏和腹腔脂肪组织均在第一时间进行了能量动员, 供应鱼体进行了能量消耗, 这也许是鱼体为了适应氧化应激状态下, 需要能量物质进行消耗进而来维持正常生理状态的一种保护性手段[20]。
3.2 不同越冬时间对草鱼组织抗氧化指标的影响
肝胰脏是鱼类重要的器官, 具有多种代谢及分解功能[21]; 肌肉是鱼类重要的运动组织[22], 前肠是重要的消化器官[23], 腹腔脂肪组织是作为草鱼重要的储能器官[24], 血清则作为一种组织液, 起维持机体内环境稳态的作用[25]。生物学性状指标的变化,如: 肝胰脏质量、肝体比、肠体比和腹腔脂肪指数, 也表明了这些组织应对氧化应激所做出的适应性调整。在整个越冬胁迫期间, 对上述组织及血清抗氧化指标的测定后, 同时进行了PCA分析, 结果表明, 各个组织和血清在越冬胁迫期间所受的氧化胁迫的剧烈程度有所不同, 显示: 脂肪组织>肝胰脏>肌肉>前肠>血清, 表明腹腔脂肪组织在越冬胁迫期间所受氧化应激的程度最大, 其次是肝胰脏和肌肉, 变化最小的则是前肠和血清。而SOD和CAT活性大小对总体抗氧化能力的贡献中起主要影响[26]。内源性抗氧化防御系统是保护鱼类组织和细胞免受氧化损伤的系统, 而SOD和CAT酶是该系统的主要反应元件之一。SOD可将细胞内的超氧阴离子转化成H2O2, 同时CAT又将H2O2转化成无毒无害的H2O以及O2, 进而降低组织内的氧化应激,维持细胞内的氧化还原平衡[27]。MDA水平的高低则间接反映了鱼体遭受氧化自由基损伤后的严重性, 是反映鱼体的细胞膜受到氧化破坏的重要指示物[28]。GST是组织中存在的较为丰富的抗氧化酶之一, 是抗氧化防御系统组成的关键部分[29]。腹腔脂肪组织作为草鱼体内储存能量物质最为丰富的器官[30], 在整个越冬胁迫期间自始至终保持着能量供应的状态, 脂肪分解供能较其他组织活跃很多,脂肪酸的分解和氧化供能以及脂肪酸转运也较其他组织活跃, 这可能就是草鱼越冬期间脂肪组织受到较高氧化应激的原因之一。
3.3 不同越冬时间对草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成的影响
这里选择越冬胁迫期间所受氧化应激程度最大的3个组织: 肝胰脏、肌肉和脂肪组织。在不同时间越冬胁迫处理下, 脂肪酸比例均有显著不同。这反映出了不同时间越冬胁迫下, 脂质动员出现了组织特异性。PCA分析表明, 肝胰脏中PUFA比例变化, 肌肉中C18﹕2n-6和C16﹕0比例变化, 腹腔脂肪中PUFA、n-6PUFA、SFA和MUFA比例变化对总体脂肪酸比例产生了主要影响, 脂肪酸比例种类差异较为明显[16,31]。脂肪组织中PUFA、n-6PUFA和MUFA比例显著下降后上升保持稳定, SFA比例显著上升后下降保持稳定; 肝胰脏PUFA比例显著上升; 肌肉中C16﹕0和C18﹕2n-6比例显著下降。尤其是功能性脂肪酸的代表之一PUFA, 在肝胰脏、肌肉和脂肪组织比例变化的趋势更能体现越冬胁迫下, 组织应对越冬胁迫所表现的组织特异性, 脂肪组织中PUFA和n-6PUFA也可能进行了供能; 肝胰脏PUFA比例变化的上升, 表明鱼体为了维持某些特殊生物学功能而间接保留PUFA; 肌肉PUFA比例的变化对总脂肪酸变化贡献不大, 但C18﹕2n-6比例变化的下降可能预示着进行了供能。
3.4 不同越冬时间对草鱼肝胰脏、肌肉和脂肪组织脂肪酸组成和抗氧化能力相关指标关联性的影响
对肝胰脏、肌肉和脂肪组织中, 抗氧化能力的相关指标与脂肪酸比变化例间的相关性进行的分析结果表明, 脂肪酸比例变化与各组织抗氧化能力大小有着较强的相关性, 图 5展示了脂肪酸组成在越冬胁迫下与机体抗氧化能力间关系的示意图。草鱼肝胰脏中抗氧化指标CAT、SOD、GST和脂肪酸变量C18﹕2n-6、C18﹕3n-6、n-6PUFA、PUFA有关联作用, MDA和脂肪酸变量C20﹕3n-6、C18﹕1n-9、MUFA有关联作用; 同时肝胰脏中脂肪酸变量MUFA、n-3PUFA和PUFA对关联分析相关指标贡献排名靠前, 表明肝胰脏中与氧化应激指标直接关联脂肪酸变量为PUFA, 对机体损伤指标MDA直接关联脂肪酸变量为MUFA。肌肉中抗氧化指标MDA、SOD、GST和脂肪酸变量C18﹕1n-9、MUFA有关联作用, CAT和脂肪酸变量C16﹕0、C16﹕1n-7、C22﹕4n-6、DHA有关联作用;同时肌肉中脂肪酸变量DHA、n-3PUFA和MUFA对关联分析相关指标贡献排名靠前, 表明肌肉中与氧化应激指标机体损伤指标MDA直接关联脂肪酸变量为MUFA。脂肪组织中抗氧化指标CAT、SOD、GST和脂肪酸变量C16﹕0、C18﹕0、C20﹕3n-6有关联作用, MDA和脂肪酸变量SFA、MUFA、EPA有关联作用; 同时脂肪组织中脂肪酸变量SFA、C16﹕1n-7和PUFA对关联分析相关指标贡献排名靠前, 表明脂肪组织与氧化应激指标直接关联脂肪酸变量为SFA中的C16﹕0, 对机体损伤指标MDA直接关联脂肪酸为SFA。上述结果表明: 草鱼腹腔脂肪组织中脂肪酸变量SFA在越冬胁迫期间供应能量的同时与氧化应激乃至机体损伤显示主要正相关, 肌肉中脂肪酸变量PUFA、MUFA分别与氧化应激乃至机体损伤显示主要正相关, 而肝胰脏中脂肪酸变量MUFA与氧化应激乃至机体损伤显示主要正相关[32,33]。相关性分析为我们揭示了, 草鱼在越冬胁迫期间, 受到氧化应激胁迫最大的3个组织与脂肪酸变量间产生的某种关联, 为越冬胁迫期间草鱼机体脂肪酸剧烈变化的同时, 将脂肪酸动员与氧化应激进而机体的损伤联系在一起, 提供了一条新的思路和见解。

图5 越冬胁迫下草鱼组织中脂质过氧化与机体抗氧化能力间的关系示意图Fig. 5 Relationship between lipid peroxidation and antioxidant capacity of grass carp under overwintering stress
4 结论
综上所述, 草鱼在越冬胁迫过程中, 生物学性状变化的结果表明了草鱼为了适应越冬胁迫下能量动员的需要采取了适应性调节, 同时, 我们证明了越冬期间所有氧化胁迫应激最大的3个组织分别是脂肪组织、肝胰脏和肌肉, 同时与越冬期间作为主要能量物质消耗的脂肪酸间进行了一种关联性分析, 确定了几种主要脂肪酸种类(肝胰脏MUFA, 肌肉PUFA、MUFA, 脂肪组织SFA)在越冬期间对氧化应激乃至机体损伤的直接相互联系。本研究提供的基准信息, 可用于制定有效的越冬胁迫期之前的投喂策略, 同时在越冬胁迫期间和越冬胁迫后的恢复阶段, 做出适当管理和精准的投喂决策, 以期改善草鱼越冬胁迫后的存活率和生产的效率。

