谷氨酸盐对胆囊收缩素引发的灌流摘出胰脏外分泌的影响
李娜+姜成哲+崔正云


摘 要:本实验的目的在于观察胰岛?茁细胞分泌的内源性GABA对胰脏外分泌的影响。胰脏外分泌由10pM浓度CCK唤起,GABA的前导物质谷氨酸盐以(1,4,10mM)浓度从开始CCK刺激45分钟前实施到实验结束。胰液被收集后检测其总分泌量和淀粉酶产量。GABAA受体拮抗剂荷包牡丹硷(10?滋M)对胰脏外分泌的影响也被记录。门静脉流出液中的GABA含量也被测定。实验结果强烈地提示谷氨酸盐能够促进大鼠胰岛?茁细胞分泌GABA到胰岛-腺泡细胞门脉体系并通过GABAA受体加强由CCK引起的胰脏外分泌。
关键词:胰脏;胆囊收缩素;γ-氨基丁酸
前言
胰脏是分泌胰岛素等的内分泌部,分散在分泌胰蛋白酶等消化酶及重碳酸离子(HCO3-)、水份的外分泌部的混合腺体器官。流入胰脏的血液的大部分直接供应到外分泌部,有约10%在内分泌部形成毛细血管网后再于外分泌部形成毛细血管网,即经过所谓的胰岛-腺泡细胞门脉体系再经内分泌部再供应到外分泌部[1]。胰脏的外分泌功能主要通过分布在胰脏的自律神经系统和胃肠管激素等胰脏外部机制来调节。
γ-氨基丁酸最初被Roberts和Frankel (1950)从哺乳类的脑组织中发现,之后也从心血管系统、胃肠管系统、泌尿生殖系统等神经系统以外的脏器中被发现[2],特别是γ-氨基丁酸以相当于脑组织中观察到的量存在于胰脏islet的β-细胞中。不仅如此,β-细胞中还发现有γ-氨基丁酸的合成酶L-谷氨酸脱羧酶和其代谢酶γ-氨基丁酸转氨酶。因此,γ-氨基丁酸可能在β-细胞中合成并代谢。但迄今为止γ-氨基丁酸是否由胰脏的胰岛分泌还找不到直接证据。只是在β-细胞中观察到了存在于神经细胞的突触样微泡,来源于胰脏的胰岛瘤细胞β-TC6细胞株[3]和体外培养的胰岛中都分泌γ-氨基丁酸的结果来看,γ-氨基丁酸由胰脏的胰岛分泌有充分的可能性。并且胰小叶内胰管细胞和腺泡中心细胞中观察到了γ-氨基丁酸的高亲和性结合部位[4],胰脏的腺泡细胞中检测出了γ-氨基丁酸的免疫反应性[5]。综合上述研究结果,γ-氨基丁酸如果由胰岛分泌,推测它将经过胰岛-腺泡细胞门脉系统影响外分泌部的功能的可能性极高,但迄今为止没有任何相关的发现。
近期利用大鼠灌流摘出胰脏的实验报道外源性γ-氨基丁酸对胰脏自发或促胰液素引起的外分泌影响不大,但对对促进酶分泌的GRP或膽囊收缩素(CCK)引发的胰脏外分泌,电场刺激引发的胰脏外分泌有上升作用[6]。而这些影响可被GABAA受体拮抗剂荷包牡丹硷(bicuculline)切断[7]。因此,本实验的目的在于观察胰岛?细胞分泌的内源性GABA对胰脏外分泌的影响。
1 材料与方法
1.1 实验动物
本实验中使用了体重在250-300g的Sprague-Dawley系的雄性大鼠,在开始实验前24小时起只供应水实施禁食。通过腹腔注射20%乌拉坦溶液麻醉实验动物,用量为7ml每公斤体重。在麻醉的状态下结束实验或摘出胰脏后静脉输注过量的乌拉坦牺牲实验动物。每组实验动物为六只。
1.2 大鼠的灌流摘取胰脏中的谷氨酸盐对胰脏外分泌的影响
1.2.1 大鼠灌流摘出胰脏中采集胰脏液
胰脏的摘出按Park等(1993)的方法去进行(8)。
1.2.2 谷氨酸盐对胆囊收缩素引发的胰脏外分泌的影响
把合成胆囊收缩素-8(USA)以10pM的浓度注射引发胰脏的外分泌,开始实施胆囊收缩素前45分钟开始把γ-氨基丁酸的前驱物质谷氨酸盐以1,4,10mM的浓度实施至本实验结束为止。
1.2.3 γ-氨基丁酸抑制剂对内因性γ-氨基丁酸的影响
注射胆囊收缩素前45分钟开始把GABAA受体的抑制剂荷包牡丹硷(B-6889, Sigma)以10?滋m的浓度为实施至本实验结束为止。
1.2.4 谷氨酸盐对灌流排液中γ-氨基丁酸浓度的影响
给胰脏注射胆囊收缩素以10pM的浓度引发外分泌再注入1,4,10mM的浓度的谷氨酸盐、每15分钟采集灌流排液测定其中γ-氨基丁酸的浓度。
1.2.5 测定γ-氨基丁酸
第一阶段反应是把从肝门脉采集的灌流液5ml试剂冻结干燥后与80?滋e GABA 鉴定试剂1混合,在37℃下反应30分钟。γ-氨基丁酸鉴定试剂1以0.3 M Tris-HCl buffer (pH 8.9, T-1503), 0.6 U/ml GABAse (G-7509), 5mm a-ketoglutarate (K-1750), 0.01% mercaptoethanol (M-6250), 0.5 mM NADP (N-0505)来组成。
第二阶段反应是加20?滋e、 1.5N NaOH,在60℃下反应20分钟来除掉剩下的NADP。再与250?滋e的酶回收液混合后在37℃下反应一个小时,再100℃下加热7分钟后中断反应。酶回收液以 0.2 M Tris- HCl buffer (pH 8.0),5mM a-ketoglutarate,1mM glucose-6-phosphate(G-7772),25mM a㎜onium acetate (A-7330),0.1mM ADP(A-2754),0.02% BSA,3.3U/ml glutamate dehydrogenase (G-2501)来组成。
第三阶段反应是再与 250?滋e的鉴定试剂2混合后在25℃下进行反应30分钟后测定在340nm下的吸光度,测定6-phos-phogluconate转化成ribulose-phosphate过程中产生的NADPH。鉴定试剂2以 0.1 M Tris- HCl buffer (pH 8.0), 1 mM NADP, 0.4 mM EDTA (E-9884), 22 mU/ml 6-phospho-gluconate dehydrogenase (P-4553)来组成。所有试剂都从Sigma采购来使用。
1.3 胰臟液和腺泡细胞培养液中的a-淀粉酶活性测定法
胰液和胰脏腺泡细胞培养液中的α-淀粉酶活性度是按已经发表的方法测定的[9]。
1.4 测定值的统计处理
本实验中得到的所有测定值按平均±标准偏差给出。平均差用Student's t test进行了统计学验证,显著性水平为5%。
2 实验结果
2.1 灌流摘出大鼠胰脏中谷氨酸盐对胰脏外分泌的影响
2.1.1 谷氨酸盐对已用胆囊收缩素引发的胰脏外分泌的影响
从正常大鼠灌流摘出的胰脏在基础环境下分泌出2.09±0.35 /60min的胰液和20.86 ± 6.69U/60min的淀粉酶。
把胆囊收缩素 以10pM的浓度注入,胰液和淀粉酶的分泌量各自增加了18.28±1.41 /60min、298.11± 25.59U/60min。
图1提示把1,4及10mm浓度的谷氨酸盐边注射到灌流摘出的胰脏边注射胆囊收缩素,注射胆囊收缩素的60分钟内胰液的分泌量随着谷氨酸盐的浓度增加。分别为23.24±2.34 /60min,25.94±2.90 /60min,26.34±2.72 /60min。比谷氨酸盐的浓度为4及10mM时单独注射胆囊收缩素得到的胰液分泌量都增加了。而且淀粉酶的分泌量为416.47 ± 34.20U/60 min,518.37± 42.77 U/60min及644.92±62.92U/60min,比单独注射胆囊收缩素时得到的淀粉酶分泌量明显增加。
2.1.2 γ-氨基丁酸抑制剂对内因性γ-氨基丁酸的作用的影响
正常大鼠灌流摘出的胰脏以10pM实施胆囊收缩素的60分钟内,上述分泌胰脏和淀粉酶分别为18.28±1.41 /60min,298.11±25.59U/60min。注射胆囊收缩素前45分钟开始以4㎜的浓度来注射谷氨酸盐注射胆囊收缩素的60分钟内胰液的分泌量增加了25.94±2.90 /60min、淀粉酶的分泌量也增加了518.37±42.77U/60min。(P<0.05)。
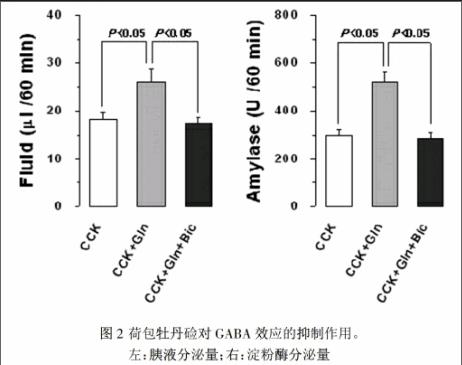
图2提示合并注射4㎜浓度的谷氨酸盐和10?滋Mγ-氨基丁酸抑制剂注射胆囊收缩素的60分钟内胰液分泌量和淀粉酶的分泌量分别为17.36±1.32 /60min,283.32±25.21U/60min。这些测定值比未注射γ-氨基丁酸抑制剂时的测定值都显低。
左:胰液分泌量;右:淀粉酶分泌量
2.1.3 谷氨酸盐对灌流排液中γ-氨基丁酸浓度的影响
正常大鼠灌流摘出实施10pM的胆囊收缩素采集灌流排液,测定γ-氨基丁酸的分泌量,测定值为292.05±59.63nmol/60min。
图3以1,4及10mM的浓度实施谷氨酸盐,γ-氨基丁酸的分泌量随着谷氨酸盐浓度增加,分别为340.04±72.86nmol/60min,643.42±57.97nmol/60min,871.75±54.08nmol/60min。
GABA的含量的影响。
*表示和对照组相比差异显著(P<0.05)。
3 讨论
已有文章报道外源性GABA对胰脏外分泌的影响[10]。现在不清楚在胰脏腺体细胞中GABA通过什么途径去改变其功能而影响胰脏外分泌,但在利用a-T3-1 gonadotropes的实验中提出GABA和其受体结合后引起GABA-gated Cl- 通道的兴奋导致voltage-operated Ca2+通道(VOCCs)开放,大幅度增加Ca2+的内流[11]。所以,在胰脏腺体细胞中GABA也有可能通过相同的机制引起细胞内Ca2+浓度的增加而影响胰脏的外分泌功能。从这种GABA的效果可被GABAA受体拮抗剂荷包牡丹硷阻断的现象分析,GABA肯定通过GABAA受体发挥其作用。
本实验中谷氨酸盐对胰脏外分泌的影响可看做是在胰岛?茁细胞中诱发了内源性GABA的合成分泌而上升了CCK唤起的胰脏外分泌。因此,在灌流摘除胰脏的门静脉端流出液中测定了GABA的含量,结果观察到谷氨酸盐浓度依赖地增加了GABA的分泌量。此结果强力地说明谷氨酸盐能够诱发胰岛?茁细胞中GABA的合成和分泌。实验中还用了GABAA受体拮抗剂荷包牡丹硷[7]阻断内源性GABA对已被CCK唤起的胰脏外分泌,可以断定GABA的作用是通过GABAA受体发挥其作用。可是,GABA受体的细胞内信号传导机制还没有完全解读出来,这需要往后的研究继续探索。
参考文献
[1]Gorelick FS & Jamieson JD. Structure-function relationship of the pancreas. In: Johnson LR et al,eds. Physiology of the gastrointestinal tract. second edition. New York: Raven Press 1089-1108,1987.
[2]Erdo SL and Wolff JR. γ-Aminobutyric acid outside the mammalian brain. J. Neurochem. 54: 363-372,1990.
[3]Smismans A,Schuit F and Pipeleers D. Nutrient regulation of gamma-aminobutyric acid release from islet beta cells. Diabetologia 40: 1411-1415,1997.
[4]Reusens-Billen B,Pirlot X,Remacle C,Hoet JJ,de Gasparo M. Localization of GABA high-affinity binding sites in the pancreas of neonatal rat. Cell Tissue Res. 235: 503-508,1984.
[5]Garry DJ,Garry MG,Sorenson RL. Ultrastructural immuno- cytochemical localization of 1-glutamate decarboxylase and GABA in rat pancreatic zymogen granules. Cell Tissue Res. 252:191-197,1988.
[6]Park YD,Cui ZY,Park HS,Park HJ. Effects of gamma- aminobutyric acid on pancreatic amylase secretion evoked by sodium oleate in anesthetized rats. Korean J. Physiol. Pharmacol. 6: 27-31,2002.
[7]Gilon P,Bertrand G,Loubatieres-Mariani MM,Remacle C & Henquin JC. The influence of gamma-aminobutyric acid on hormone release by the mouse and rat endocrine pancreas. Endocrinology 129: 2521-2539,1991.
[8]Park HJ,Kwon HY,Lee YL. Effects of pancreatic polypeptide on insulin action in exocrine secretion of isolated rat pancreas. J. Physiol. 463: 421-429,1993.
[9]Lee YL,Kwon HY,Park HS and Park HJ. Mechanism of action of panceatic polypeptide (PP) on pancreatic exocrine secretion in isolated rat pancreas. Kor. J. Physiol. Pharmacol. 1:83-90,1997.
[10]Park HS and Park HJ. Effects of gamma-aminobutyric acid on secretagogue-induced exocrine secretion of isolated,perfused rat pancreas. Am. J. Physiol. 5: G677-G682,2000.
[11]Williams B,Bence M,Everest H,Forrest-Owen W,Lightman SL,McArdle CA. GABAA receptor mediated elevation of Ca2+ and modulation of gonadotrophin-releasing hormone action in alpha-T3-1 gonadotropes. J. Neuroendocrinol. 12(2):159-66,2000.
通訊作者:崔正云。
——晚餐

