急性髓性白血病预后相关基因的分析与验证
梅凯 舒鹏 张松 谢红意
急性髓性白血病(acute myeloid leukemia,AML)是一种异质性的造血系统恶性肿瘤,不同基因型AML患者对治疗反应和预后差异极大[1],约有20%~30%患者存在着内部串联重复的突变,使得具有酪氨酸激酶活性的原癌基因FMS样酪氨酸激酶3基因(FLT3)异常激活,并影响患者预后。研究发现使用FLT3抑制剂治疗AML的疗效较好[2]。因此如何找出AML患者中预后相关基因,并进行相应的验证成为研究热点。目前已有多项研究发现AML预后相关基因,Li等[3]通过对499例AML患者基因表达数据与临床资料进行单因素Cox回归分析,得到24个与患者总体生存率显著相关的基因。Torrebadell等[4]先对40例造血干细胞移植后AML患者基因表达数据进行分析,得到187个疾病复发相关基因后,使用实时荧光定量聚合酶链式反应(qPCR)验证得到BAALC、MN1、SPARC与HOPX基因。尽管如此,在得到预后、治疗反应性相关的基因后,对于这些基因在肿瘤细胞发生、发展中具体机制的研究则相对较少。本研究采用Cox回归模型得到预后相关基因,并分析这些基因表达与患者总体生存率之间的关系,同时进行相应的机制探讨,现报道如下。
1 对象和方法
1.1 对象 收集2013年4月至2017年6月宁波市北仑区人民医院收治30例AML患者初治时的骨髓单个核细胞,患者中男21例,女9例,平均年龄(42.93±25.86)岁。所有患者经细胞形态学、免疫学、细胞遗传学、分子生物学(MICM)分型标准确诊。排除标准:合并糖尿病、心脑血管疾病、重要脏器功能异常、感染性疾病或是不配合本实验流程。收集2015年5月至2017年12月宁波大学医学院生物样本库10例健康志愿者的骨髓单个核细胞,健康志愿者中男6例,女4例,平均年龄(37.48±12.19)岁。排除标准:合并有糖尿病、心脑血管疾病等,或是基本资料不完整者。本研究经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 试剂及仪器 人急性单核细胞白血病细胞系AML-193购自国家实验细胞资源共享平台,包装病毒用293t细胞由本室保藏。IMDM培养基(12440079)、胎 FBS(10438026)、胰岛素(12585014)、转铁蛋白(T13342)、粒细胞巨噬细胞集落刺激因子(PHC2013)均购自美国Gibico公司。HECTD3-scramble与HECTD3-shRNA慢病毒载体购自美国Sigma公司,慢病毒包装载体 PMD2.G(12259)、psPAX2(12260)均购自美国 Addgene公司。Lipofectamine 2000(12566014)购自美国ThermoFisher公司,PEG慢病毒纯化试剂(LV810A-1)购自美国SBI公司。Western blot检测中RIPA强裂解液(P0013B)购自上海碧云天公司,HECTD3(ab173122)抗体购自美国 Abcam 公司,ubiquitin(3933)、NF-κB 通路p65(8242)、p-p65(3033)、IKBα(5206)、p-IKBα(2859)、内参抗体GAPDH(5174)均购自美国Cell Signaling Technology公司。RT-PCR+qPCR实验中Trizol(15596026)购自美国ThermoFisher公司,反转录试剂盒PrimeScript RT Reagent Kit with gDNA Eraser(RR047A)与 SYBR 检测试剂盒 SYBR Premix Ex TaqⅡ(Tli RNase H Plus)(RR820A)均购自北京宝日医生物技术有限公司,实验中全部引物均由深圳华大基因股份有限公司合成。细胞增殖检测中CCK-8试剂盒(CK04)购自日本同仁化学研究所,细胞凋亡Annexin V别藻蓝蛋白(Allophycocyanin,APC)/碘化丙碇(PI)双染试剂盒(A02001-11PG)购自天津三箭生物技术有限公司。细胞周期检测中高浓度PI购自美国Sigma公司(P4170)。凝胶迁移(EMSA)实验中生物标记的 NF-κB(GS056B)、OCT-1(GS061B)探针购自上海碧云天公司,核蛋白提取试剂盒(C500009-0050)购自上海生工生物工程有限公司,化学发光法EMSA试剂盒(GS009)购自上海碧云天公司。
1.3 细胞培养与分组 AML-193细胞系使用IMDM+5% FBS+5 μg/ml胰岛素+5 μg/ml转铁蛋白+5 ng/ml粒细胞巨噬细胞集落刺激因子(GM-CSF)培养基中培养,培养条件为37℃、5% CO2。在得到HECTD3-scramble与 HECTD3-shRNA慢病毒后,AML-193细胞分为HECTD3-scramble与HECTD3-shRNA组,分别感染HECTD3-scramble与HECTD3-shRNA慢病毒,感染复数(病毒/细胞的比值)为10 MOI。
1.4 慢病毒包装与纯化 HECTD3功能验证使用shRNA敲低的方法。HECTD3-scramble(对照载体)与HECTD3-shRNA载体首先包装为慢病毒,使用第三代慢病毒包装体系,包装步骤:(1)PMD2.G、psPAX2、目的载体分别取 3、9、12 μg 后,使用 lipofectamine 2000 转入 293t细胞中;(2)收集 36、48、72 h 时含有病毒的培养上清液,并将此上清液与PEG按照体积比4∶1混合,4℃沉淀过夜;(3)所得慢病毒沉淀使用无血清DMEM重悬即得到纯化后的慢病毒,使用纯化后的慢病毒感染293t细胞,并采用流式细胞仪检测绿色荧光阳性的细胞比例(感染效率)以判定感染滴度。
1.5 蛋白表达水平的检测 采用Western blot法。HECTD3-scramble与HECTD3-shRNA组细胞在感染慢病毒48 h后,使用RIPA裂解液冰上裂解30 min,12 000 r/min,15 min后取上清液,并加入上样缓冲液,沸水浴15 min。随后取20 μg蛋白样本加入预制胶中,50 V恒压电泳,待marker在分离胶与积层胶界限分开时,120 V恒压直至溴酚蓝跑至分离胶底部,使用湿法转膜将蛋白转至PVDF膜后,5%BSA封闭2 h,标记HECTD3、ubiquitin、p65、p-p65、IKBα、p-IKBα、GAPDH一抗过夜,并标记相应种属的二抗30 min。4℃过夜后,室温标记相应二抗30 min,使用ECL发光液检测蛋白的表达水平。
1.6 不同基因mRNA水平表达的检测 采用RTPCR+qPCR检测。细胞总RNA首先使用TRI-ZOL法提取,并使用反转录试剂盒反转录为cDNA,反转录步骤:(1)gDNA Eraser Buffer+gDNA Eraser+Total RNA+H2O按照相应比例混合后,42℃2 min;(2)第一步反应混合液+PrimeScript RT Enzyme Mix I+RT Primer Mix+PrimeScript Buffer 2+H2O按照相应比例混合后,37℃15 min,85℃5 s即得到cDNA文库。随后以GAPDH为内参,SYBR染料法检测mRNA表达水平的变化,15个基因qPCR引物序列如下Pla2g4a-F:ACGGTTCAGCATGGCACTGT,Pla2g4a-R:CCACCACAGGCACATCACGT,Tubg2-F:GAGGAGATGCACAGATCGAGG,Tubg2-R:GGACTGTGCTTCTTGTCCAGG,SPON1-F:CATGGTCCGAGTGGAGTGAC,SPON1-R:AGTCAATGGGGCATTCAGGG,TXLNB-F:AAAGCAACGAGGTGTTTGCC,TXLNB-R:GCTGGGCCTCTTTGAGTCTT,KIR3DL1-F:CCAGGTCCCCTGGTGAAATC,KIR3DL1-R:AAATTGGCCTTGGAGACCCC,SDHA-F:AACACTGGAGGAAGCACACC,SDHA-R:AGTAGGAGCGGATAGCAGGA,KIAA0-125-F:AGGACACTGACTTTGGCTAGGG,KIAA0125-R:TCACAGTGCTGTCCAGACCCAT,FAM83G-F:GCCCGCTCGATTGCTCA,FAM83G-R:CCAGACACTGCACCTGAGAG,ACOT7-F:CTAGCCACCATGGCTTTCCA,ACOT7-R:GAGACAGGAAGTCGGTGCG,ARPC5L-F:TCCTGGGGCTGTATAGGGAA,ARPC5L-R:TGTCCGCCACGTAACAGAAG,SLC2A5-F:GGCTTCTCCATCTGCCTCATAG,SLC2A5-R:GGAGATGACACAGACGATGCTG,SOCS1-F:TTCGCCCTTAGCGTGAAGATGG,SOCS1-R:TAGTGCTCCAGCAGCTCGAAGA,ATP13A2-F:GTTATCCAGGCTCTGCGAAGGA,ATP13A2-R:GTGGACGATGATCAGATGCTCC,CALCRL-F:TGGATGGCTCTGCTGGAACGAT,CALCRL-R:CCAGTTTCCATCTTGGTCACAGA,HECTD3-F:ATCGAGATCCGCATCGTGGAGT,HECTD3-R:TAGTTGGCTGGAACAGGTCTGC,内参基因GAPDH-F:GTCTCCTCTGACTTCAACAGCG,GAPDH-R:ACCACCCTGTTGCTGTAGCCAA,反应体系与条件按照SYBR qPCR试剂盒说明书进行,mRNA的相对表达量采用 2-ΔΔCT表示。
1.7 细胞增殖检测 采用CCK-8法。首先将HECTD3-scramble与HECTD3-shRNA细胞铺于96孔板中,并设立0、24、48、72、96 h时间点,每一时间点设立4副孔,每孔3 000个细胞,加入十分之一体积的CCK-8试剂后,37℃孵育3 h,并使用酶标仪检测光密度(optical density,OD)450 nm的值,细胞增殖指数即为细胞OD 450 nm值与细胞在0 h时OD 450 nm值的比值。
1.8 细胞凋亡检测 采用Annexin V APC/PI双染法。HECTD3-scramble与HECTD3-shRNA细胞在感染病毒48 h后,使用PBS洗2次,并使用100 μl binding buffer重悬,加入5 μl Annexin V APC抗体与5 μl PI染料,冰上孵育10 min后采用流式细胞仪检测细胞凋亡的变化,实验重复3次。
1.9 细胞周期检测 采用高浓度PI染色法。HECTD3-scramble与HECTD3-shRNA细胞在感染病毒48 h后,使用PBS洗2次,加入700 μl无水乙醇与300 μl PBS+5% FBS重悬,-20℃固定过夜后,加入终浓度为1 μg/ml RNA酶,37℃水浴30 min后,加入终浓度为50 μg/ml PI染料,室温避光标记30 min后,流式细胞仪检测细胞周期的变化。
1.10 NF-κB转录活性变化的检测 采用EMSA检测。HECTD3-scramble与HECTD3-shRNA细胞在感染病毒48 h后,使用核蛋白提取试剂盒提取核蛋白:(1)使用300 μl预冷 Hypotonic Buffer裂解 10 s,3 000 r/min 离心 5 min;(2)加入 400 μl预冷 Hypotonic Buffer裂解 30 s,500 r/min 离心 5 min;(3)200 μl lysis buffer裂解 20 min后,1 500 r/min 10 min,即得到裂解后的细胞核蛋白,随后使用NF-κB探针、OCT-1探针进行结合,在EMSA胶中进行分离、紫外交联,最后使用ECL发光液检测NF-κB探针的强度与OCT-1探针强度的比值,并以该比值表示NF-κB的转录活性。
1.11 公共数据库分析 采用R语言进行数据库分析,具体如下:(1)获得癌症基因组图谱(TCGA)AML患者基因表达数据与相应的临床信息(http://gdac.broadinstitute.org/);(2)去除RSEM值在60%样本中表达量低于3的基因;(3)使用limma包中VOOM功能对表达数据进行标准化;(4)计算 z值;(5)使用 caret包将原始数据集按照0.8的比例分为训练数据集与验证数据集;(6)使用survival包中的单因素Cox回归模型在训练数据集中得到P<0.0001的基因;(7)使用randomForest包对基因进行特征重要性排序,随机森林算法参数为nodesize=2、ntree=10 000、mtry=571、sampletype=swor、nsplit=10,在选取排名前15个基因后,使用多因素Cox回归模型计算;(8)将得到的基因在测试数据集中验证。
1.12 统计学处理 采用SPSS 20.0统计软件,计量资料以表示,组间比较采用两独立样本t检验。采用Cox回归模型得到患者预后相关基因。P<0.05为差异有统计学意义。
2 结果
2.1 预后相关基因 首先调取TCGA中173例AML患者的基因表达数据与临床信息,并按照4∶1的比例分为训练数据集与测试数据集,经单因素Cox回归模型得到116个预后相关的基因后,使用随机森林算法对116个基因与患者生存率之间的关联程度进行排序;将训练数据集中树的数量提高到10 000后,算法在测试数据集中的错误率逐渐降低(图1a、b),通过重要性排序,初步明确了116个基因与患者总体生存率关联程度(图1c,见插页),并最终选择前15个与患者总体生存率相关的风险基因(表1),使用多因素Cox回归模型计算预后指数,结果表明在训练数据集与测试数据集中,高风险患者生存率显著低于低风险患者(图1d);在AML患者和健康志愿者骨髓单个核细胞中测定上述15个基因表达水平,qPCR显示以上15种基因均高表达于AML患者骨髓单个核细胞(图1e,见插页)。
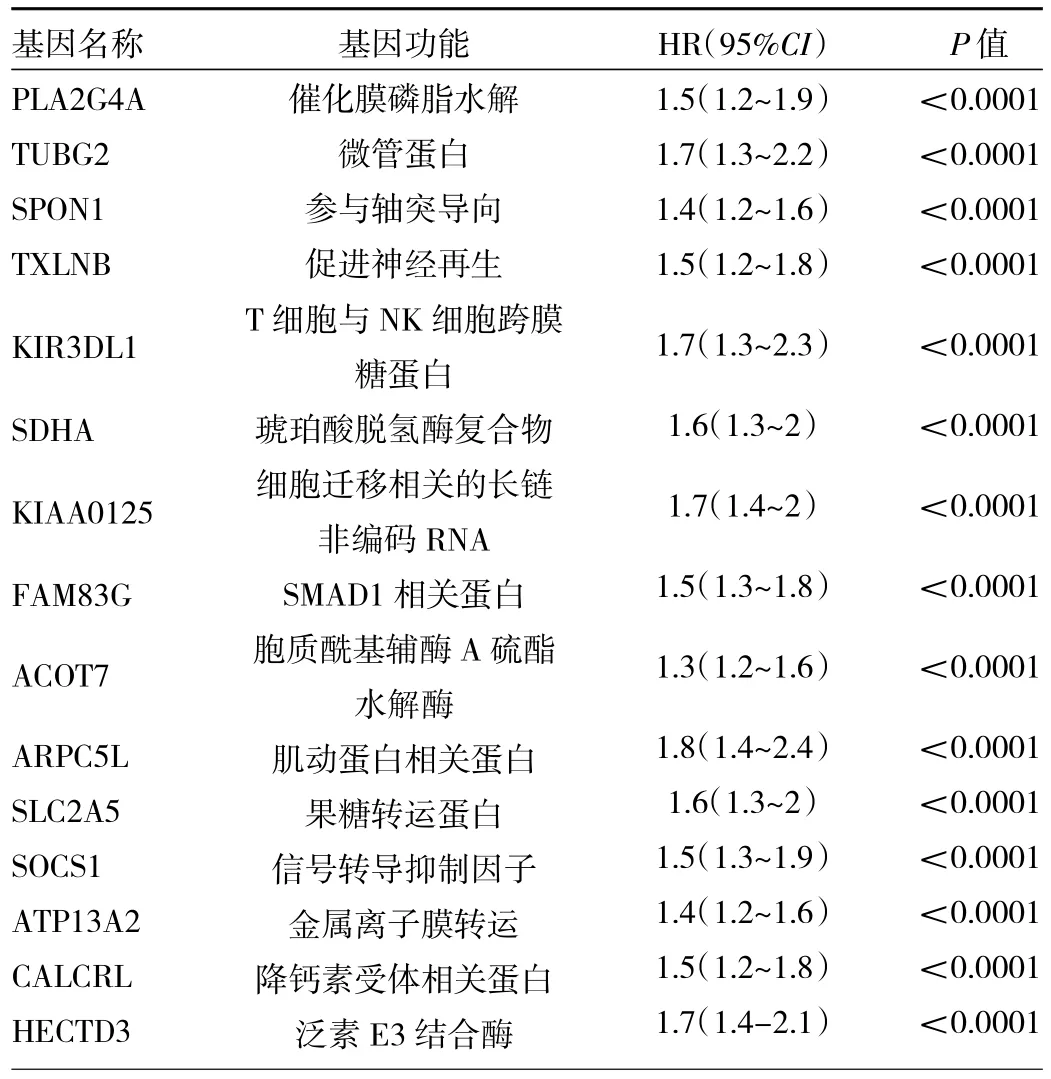
表1 15个预后相关基因与患者总体生存率之间的关系

图1 Cox回归模型得到15个预后相关的基因(a:使用Cox回归模型筛选预后相关基因流程;b:检测不同数量的树中,随机森林算法判定分类结果的错误率变化,并待错误率稳定后,使用该数量的树进行后续实验;d:得到15个预后相关基因在训练与验证数据集中对患者总体生存率的影响)

图1 Cox回归模型得到15个预后相关的基因[a:使用Cox回归模型筛选预后相关基因流程;b:检测不同数量的树中,随机森林算法判定分类结果的错误率变化,并待错误率稳定后,使用该数量的树进行后续实验;c:使用随机森林算法对单因素Cox回归分析得到的116个基因进行重要性排序(显示前52个基因);d:得到15个预后相关基因在训练与验证数据集中对患者总体生存率的影响;e:健康志愿者与AML患者骨髓单个核细胞经qPCR检测15个预后相关基因在mRNA水平的相对表达量]
2.2 15个预后相关基因的表达与验证 结果表明HECTD3在健康志愿者、AML患者骨髓单个核细胞中表达水平分别为1.00±0.10、5.83±0.24,差异有统计学意义(P<0.0001),HECTD3在15个基因中的相对表达量最高,而在GSE12417中,HECTD3的高表达与患者总体生存率显著相关(图2a,见插页)。HECTD3-shRNA在10 MOI下对AML-193具有很好的感染效率(图2b,见插页)。在使用qPCR与Western blot检测HECTD3在mRNA与蛋白水平的变化后,HECTD3-scramble组与HECTD3-shRNA组HECTD3 mRNA相对表达量分别为1.00±0.12、0.23±0.07,HECTD3-shRNA 降低了 HECTD3蛋白水平的表达(图2c,见插页)。
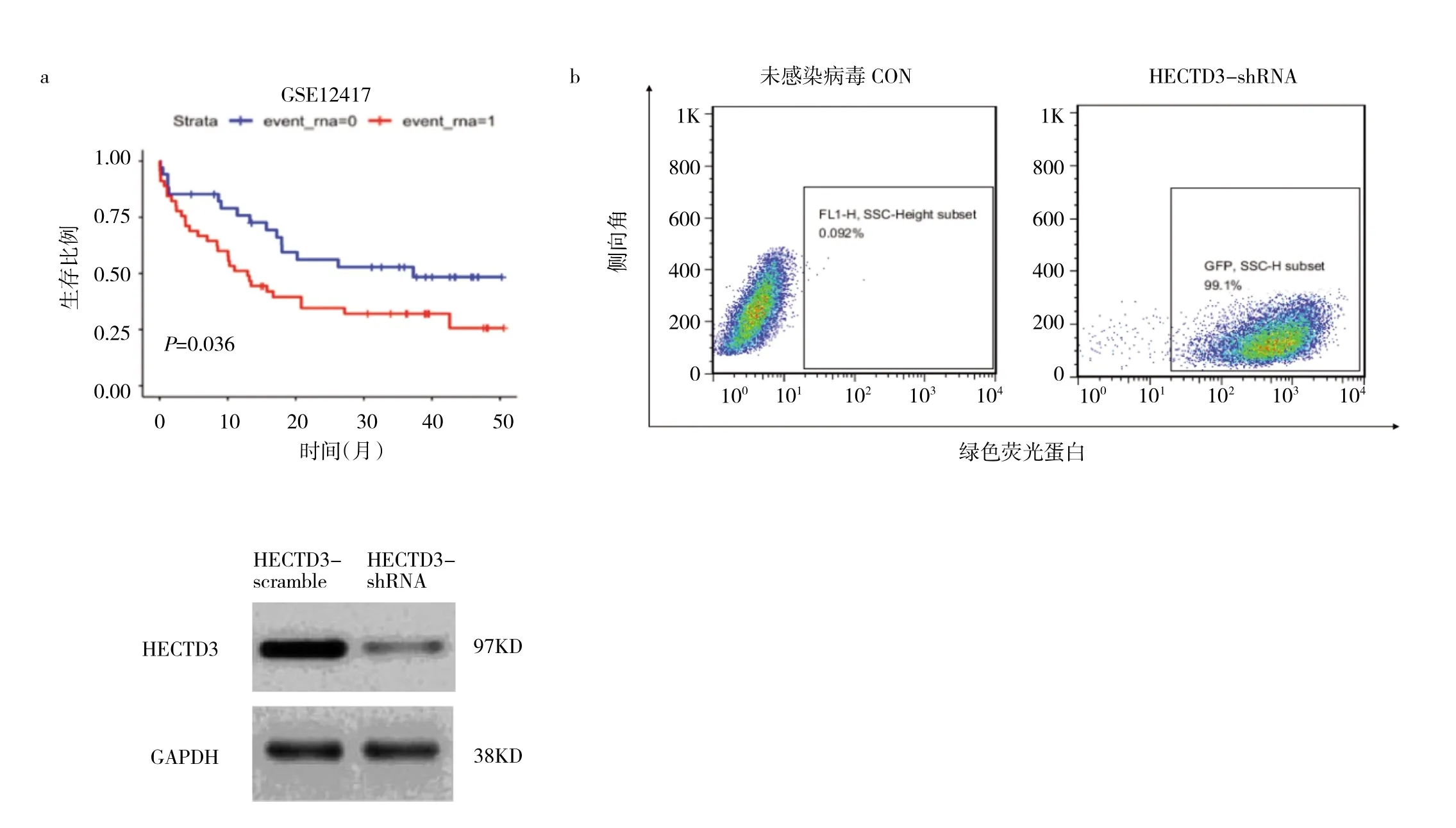
图2 15个预后相关基因的筛选与验证(a:HECTD3基因在GSE12417数据集中与患者总体生存率之间的关联;b:使用HECTD3-shRNA慢病毒感染AML-193细胞,感染病毒48 h后,利用流式细胞仪检测GFP+细胞比例的变化;c:HECTD3-scramble与HECTD3-shRNA感染AML-193细胞48 h后,Western blot检测HECTD3在蛋白水平表达的变化)
2.3 HECTD3的表达对AML-193细胞增殖、凋亡与细胞周期的影响 在确定HECTD3-shRNA具有很好的感染与敲除效率后,使用CCK-8检测HECTD3敲低后细胞增殖的改变,结果表明HECTD3-scramble组与HECTD3-shRNA组在72 h时增殖指数分别为5.41±0.21、3.34±0.18,HECTD3-scramble组显著高于 HECTD3-shRNA,差异有统计学意义(P<0.001),其余各时点比较差异均无统计学意义(均P>0.05),见表2。在细胞凋亡中,HECTD3-scramble组与HECTD3-shRNA组ANNEXIN V+比例分别为 4.21±1.38、28.64±5.89,HECTD3-shRNA显著高于HECTD3-scramble组(P<0.001),在细胞周期中,HECTD3-scramble组与 HECTD3-shRNA组 G1期细胞比例分别为 30.56±5.61、51.61±6.12,HECTD3-shRNA组显著高于HECTD3-scramble组(P<0.001)。见图3(插页)。
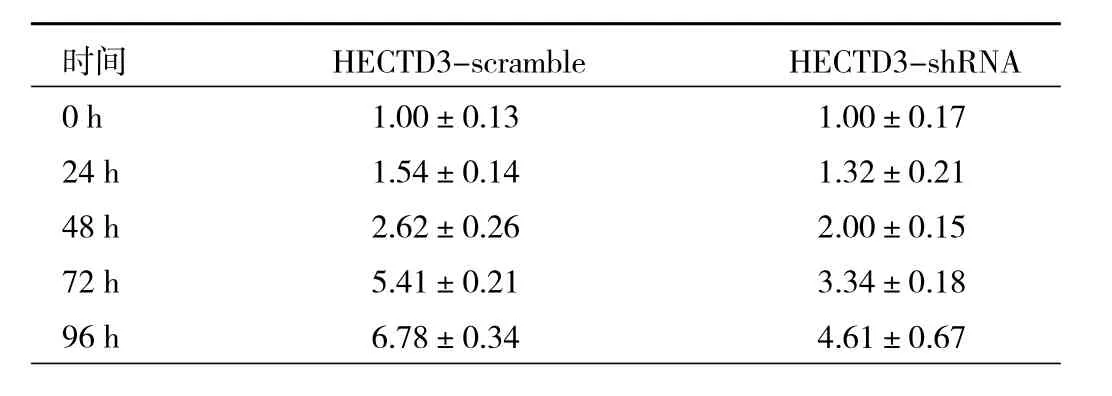
表2 两组细胞增殖指数的比较

图3 HECTD3的表达对AML-193细胞增殖、凋亡与细胞周期的影响(a:使用Annexin V/PI双染法检测细胞凋亡的变化;b:使用高浓度PI染色法检测细胞周期的变化)
2.4 HECTD3-shRNA对AML-193中NF-κB通路活性的影响 与HECTD3-scramble组比较,HECTD3-shRNA组泛素结合蛋白比例显著降低,灰度值分别为7.91±1.68与 3.72±1.35,差异有统计学意义(P<0.001)。HECTD3-shRNA组p65磷酸化显著降低,p65表达量并无明显改变,抑制因子IKBα磷酸化水平降低,同时表达量升高;HECTD3-scramble组、HECTD3-shRNA组 NF-κB探针与OCT-1探针灰度值的比值分别为1.4±0.15、1.03±0.12,差异有统计学意义(P<0.001),表明HECTD3-shRNA组NF-κB转录活性显著降低。见图4。

图4 HECTD3-shRNA显著抑制AML-193中NF-κB通路的活性(a:总泛素结合蛋白的变化;b:NF-κB通路p65磷酸化、总p65、抑制因子IKBα磷酸化、总IKBα的改变;c:NF-κB转录活性的改变)
3 讨论
AML是一种以骨髓性造血芽细胞异常增殖为特征的恶性肿瘤,可依据FAB分类分为M0~M7 8种亚型,目前是成人急性白血病中较常见的一种[5]。AML的预后与患者的细胞遗传学、白血病细胞的染色体结构显著相关,如在-5,-7,del(5q)型别患者中,预后显著变差,特定的基因异常激活如FLT3、c-KIT、VEGFR等同样能够显著影响患者预后[6],应用特异的激酶抑制剂如midostaurin能够在特定的基因型患者中得到很好的效果[7]。因此寻找与患者预后相关的基因,并进行特定的靶向治疗具有很好的前景。
在本研究中,首先使用单因素Cox回归模型得到116个与患者总体生存率显著相关的基因,对于临床决策与进一步的实验验证而言,116个基因数量过庞大,而随机森林能够通过对平均不纯度的衰竭来对特征的重要性进行排序,且能够通过加权表决的方式避免决策树中常见的过拟合问题[8]。随后使用随机森林对基因表达重要性进行排序,最终得到基于15个在训练、测试数据集中均有很好的表现的预后相关基因。在与现有预后相关标志物进行比较后,结果表明该15个预后基因与Li Z、Torrebadell的预后基因无任何重叠,本研究健康志愿者与AML患者骨髓单个核细胞中,HECTD3基因表达水平为15个基因中最高,同时HECTD3作为泛素E3结合酶[9],与其具有相似功能的WWP1[10]、FBXO9[11]、RNF5[12]、TRAF2[13]均被证实与 AML发病相关,尽管HECTD3目前与血液系统肿瘤之间的关系尚未有报道,HECTD3已被证实在乳腺癌中高表达[9],在食管鳞状细胞癌中,HECTD3特异性的促进Caspase9的泛素化,进而抑制了Caspase9与Apaf-1的结合,从而促进了食管癌细胞体内与体外的增殖[14]。在AML-193 HECTD3-scramble与HECTD3-shRNA细胞系中,感染病毒72 h时,HECTD3-shRNA组细胞增殖指数显著低于HECTD3-scramble,HECTD3-shRNA同时使得AML-193细胞凋亡比例增加、细胞周期中G1期细胞比例增加,证实了HECTD3对于维持细胞生存至关重要,可作为靶向治疗的靶点。
基于HECTD3的功能,首先使用ubiquitin抗体检测细胞泛素结合蛋白的变化,结果表明HECTD3的敲低使得泛素结合蛋白比例下降,而在之前的研究中,泛素结合蛋白比例的下降能够诱导NF-κB通路的抑制[15],而NF-κB同时也是AML发生、发展中重要的蛋白[16],HECTD3的抑制则使得p65磷酸化降低、IKBα磷酸化首先,总IKBα表达显著升高,HECTD3的抑制还使得NF-κB探针的信号强度降低,论证了HECTD3对NF-κB通路的维持作用,而HECTD3对AML细胞的作用则可能与NF-κB通路的改变。
综上所述,本研究使用了Cox回归模型、随机森林相结合的方式,鉴定出预后相关的基因,并进行了简单的功能、机制验证,为进一步小分子抑制剂的开发提供了实验基础。

