miR-21-5p靶向调控Spry1影响人乳腺癌细胞ERK的磷酸化
孙方正,檀 军,陆 祥,陈 伟
(遵义医科大学 组织胚胎学教研室,贵州 遵义 563099)
乳腺癌是女性发病率最高的恶性肿瘤,每年新发病约为30.4万[1]。虽然乳腺癌的诊断和治疗水平有了明显的提高,但乳腺癌传统治疗方法存在的不足和现有生物学治疗的靶向性较低、特异性较差,患者预后差、转移率高仍是该疾病导致女性死亡的主要因素之一[2]。因此,研究乳腺癌发生发展的相关分子机制对该疾病早期诊断和相关靶向药物研发具有重要意义。
大量临床资料显示,在乳腺癌患者的癌组织和血液中miR-21和ERK磷酸化均高表达[3-5],说明miR-21-5p和ERK磷酸化升高都与乳腺癌的发生相关。microRNAs(miRNAs)是一种非编码小分子RNA,能与靶基因3'-UTR结合,诱导mRNA降解或抑制mRNA翻译调控靶基因表达,参与细胞的生长、发育和分化[6]。
丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPKs)是广泛存在于真核生物细胞内的一种丝/苏氨酸蛋白激酶。其中,细胞外信号调节激酶(Extracellular regulated kinases,ERK)作为MAPK信号级联末端主激酶,激活前ERK1/2定位于细胞质中,受细胞外刺激后活化从细胞质进入细胞核,通过磷酸化其底物,调控细胞周期变化,促进细胞的增殖、分化、血管生成,抑制细胞凋亡等[7]。Xie等[8]研究发现在MCF-7细胞中过表达miR-21-5p通过抑制MAPK家族成员之一MAPK10的表达,促进了乳腺癌细胞增殖、侵袭和转移,抑制癌细胞凋亡。本课题采用生物信息学筛选miR-21-5p的靶基因,通过双荧光素酶报告实验检测miR-21-5p及其下游靶基因相互关系,并在人乳腺癌MCF-7细胞中验证miR-21-5p与靶基因表达是否影响ERK磷酸化。
1 材料与方法
1.1 材料 miR-21-5p mimic、miR-21-5p mimic-NC、miR-21-5p inhibitor、miR-21-5p inhibitor-NC、pEXP-RB-Mam-EGFP-Spry1质粒、pEXP-RB-Mam-EGFP空载体、si-Spry1和 si-Spry1-NC由中国广州锐博生物科技有限公司构建;miR-21-5p、Spry1引物由中国上海生工生物工程有限公司合成;HiSeript Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)反转录试剂盒、AceQ qPCR SYBR Green Master Mix试剂盒,购自中国南京诺唯赞生物科技有限公司;β-Actin Rabbit Monoclonal Antibody、山羊抗兔IgG(HRP)二抗、RIPA裂解液、BCA蛋白浓度测定试剂盒购自中国上海碧云天生物技术有限公司;Trizol试剂购自日本TAKARA公司;LipofectamineTM2000转染试剂购自美国Thermo Fisher scientific公司;Spry1一抗(批号:#13013S)、ERK1/2一抗(批号:#9102S)、Phospho-ERK1/2一抗(批号:#4370S)购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 人乳腺癌MCF-7细胞株培养 人乳腺癌MCF-7细胞株购自中国北京北纳创联生物技术研究院,将MCF-7细胞接种于T25培养瓶中,加入DMEM高糖完全培养基(内含10%胎牛血清),置于37℃恒温、5% CO2、饱和湿度培养箱中培养备用。
1.2.2 靶基因预测 采用Targetscan-Human 7.1(www.-targetscan.org)和miRDB(www.mirdb.org)数据库,预测miR-21-5p的靶基因。
1.2.3 质粒构建
1.2.3.1 荧光素酶质粒的构建 根据Targetscan-human 7.1预测到miR-21-5p与靶基因Spry1 3'-UTR区结合位点5'-AUAAGCUA-3'。利用点突变试剂盒突变该结合位点,突变序列5'-CAGCAUGG-3'。选取结合位点、突变位点上游150 bp和下游150 bp共计300 bp的序列克隆至psiCHECK2质粒载体萤火虫荧光素酶R-LUCIFERASE(hRLuc)末端多克隆位点,并由上海汉恒生物有限公司完成Spry1 3'-UTR 野生型质粒psiCHECK2-Spry1-WT(下文简称psi-Spry1-WT)及Spry1 3'-UTR突变质粒psiCHECK2-Spry1-MUT(下文简称psi-Spry1-MUT)构建。
1.2.3.2Spry1过表达质粒构建 首先通过NCBI查询到Spry1基因转录本(NM_001258038),获取CDS序列,并将其克隆至pEXP-RB-Mam-EGFP载体,酶切位点为XhoI和PmeI。构建成Spry1过表达质粒pEXP-RB-Mam-EGFP-Spry1(下文简称pEXP-Spry1),空载体pEXP-RB-Mam-EGFP(下文简称pEXP-EGFP)。
1.2.4 荧光素酶活性检测 将1×104个293T细胞接种96孔板中,待细胞汇合度生长至40%左右,操作流程参照LipofectamineTM2000试剂说明书进行。将psi-Spry1-WT和miR-21-5p mimic、psi-Spry1-WT和miR-21-5p mimic-NC、psi-Spry1-MUT和miR-21-5p mimic、psi-Spry1-MUT和 miR-21-5p mimic-NC(miR-21-5p mimic转染浓度为50 nmol/L,质粒浓度0.2μg/孔)分别共转至293T细胞中。转染48 h后,按照双荧光素酶报告实验检测试剂盒说明书进行(E1910,Promega),使用荧光酶标仪进行双荧光素酶活性的检测。
1.2.5 细胞转染 将2×105个MCF-7细胞接种六孔板中,待细胞汇合度生长至60%左右,设为8个转染组分别为:miR-21-5p mimic组、miR-21-5p mimic-NC组、miR-21-5p inhibitor组、miR-21-5p inhibitor-NC组、pEXP-Spry1组、pEXP-EGFP组、si-Spry1组、si-Spry1-NC组。转染前将六孔板内10%完全培养基更换为Opti-MEM培养1.5 h,使用250 μL Opti-MEM稀释LipofectamineTM2000(4 μL/孔)和miR-21-5p mimic(50 nmol/L)、miR-21-5p inhibitor(100 nmol/L)、si-Spry1(50 nmol/L)及相应阴性对照,室温放置5 min后,混合成500 μL转染复合物,pEXP-Spry1(4 μg/孔)、pEXP-EGFP(4 μg/孔)与LipofectamineTM2000(8 μL/孔),转染至MCF-7细胞。6 h后更换10%完全培养基培养,48 h后分别使用Trizol和RIPA提取细胞的总RNA和蛋白质并进行分析。
1.2.6 实时荧光定量PCR(RT-qPCR) 使用Trizol试剂提取各组转染48 h后MCF-7细胞总RNA,NanoDrop2000超微量分光光度计测定总RNA浓度,按照试剂说明书使用逆转录试剂盒获得cDNA;使用AceQ qPCR SYBR Green Master Mix试剂盒,在7500 Real-Time PCR系统中进行实时荧光定量PCR,检测miR-21-5p和Spry1基因mRNA表达水平,分别以U6和GAPDH作为参照基因;扩增完毕后,根据目的基因和内参基因CT值,采用2-△△CT(△△CT=△CT处理组-△CT对照组;△CT=CT目的基因-CT内参基因)方法计算miR-21-5p和Spry1的相对表达量。本研究使用引物如表1。
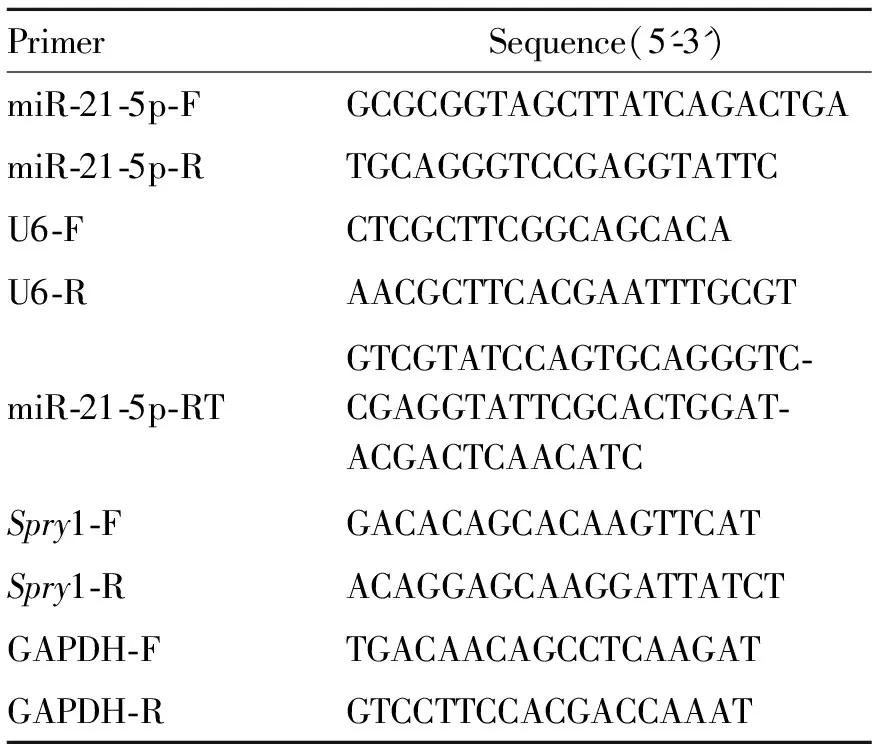
表1 引物名称及序列
1.2.7 蛋白质印迹(Western blot) 收集各组转染48 h后MCF-7细胞,加入RIPA裂解缓冲液,冰上裂解30 min,12 000 g 4℃离心10 min,收集上清液,BCA法测总蛋白浓度;蛋白上样,通过10%SDS-PAGE分离20 μg蛋白质,转膜,5% 脱脂奶粉室温封闭2 h,加入β-Actin、Spry1、ERK、Phospho-ERK1/2一抗4 ℃孵育过夜(1∶1 000);TBST洗涤3次,每次10 min,使用山羊抗兔IgG(HRP)二抗(1∶2 000)室温孵育1.5 h,TBST洗涤3次,每次10 min;加入ECL HRP底物显色液,凝胶成像系统拍照,ImageJ分析图像。

2 结果
2.1Spry1是miR-21-5p下游靶基因 根据Targetscan-human 7.1,得知Spry1是miR-21-5p的靶基因之一,并预测结合位点位于3'-UTR区(见表2);设计该区域突变结合序列(见表3);双荧光素酶报告实验结果显示,与阴性对照组相比miR-21-5p mimic和psi-Spry1-WT共转组,荧光素酶活性明显降低(P<0.001);而miR-21-5p mimic和psi-Spry1-MUT共转组与阴性对照组相比,荧光素酶活性无显著变化(P>0.05,见图1)。

psi-Spry1-WT和mimic共转组与psi-Spry1-WT和miR-21-5p mimic-NC共转组相比,***:P<0.001。

表2 miR-21-5p与Spry1 3'-UTR区的结合序列

表3 miR-21-5p与Spry1 3'-UTR区的突变序列
2.2 miR-21-5p对MCF-7细胞中Spry1的影响 将miR-21-5p mimic、miR-21-5p inhibitor和相应阴性对照(miR-21-5p mimic-NC、inhibitor-NC)分别转染MCF-7细胞,RT-qPCR检测miR-21-5p表达水平。与阴性对照组相比,miR-21-5p mimic组miR-21-5p RNA表达明显升高(P<0.01);但miR-21-5p inhibitor组miR-21-5p RNA表达无显著变化(P>0.05)(见图2A);RT-qPCR检测两组MCF-7细胞Spry1 mRNA表达水平,与阴性对照组相比,miR-21-5p mimic组和inhibitor组Spry1 mRNA水平均无显著变化(P>0.05,见图2B);Western blot检测结果,与阴性对照组相比,miR-21-5p mimic组Spry1蛋白表达水平降低(P<0.05),miR-21-5p inhibitor组Spry1蛋白表达升高(P<0.05,见图2C、D)。

A:miR-21-5p mimic、miR-21-5p inhibitor组中miR-21-5p RNA表达的影响;B:miR-21-5p mimic、miR-21-5p inhibitor对Spry1 mRNA表达的影响;C、D:miR-21-5p mimic、miR-21-5p inhibitor对Spry1蛋白表达影响;与相应阴性对照组相比,*:P<0.05,**:P<0.01。
2.3 miR-21-5p对MCF-7细胞中ERK磷酸化的影响 Western blot检测miR-21-5p mimic组、miR-21-5p inhibitor组、相应阴性对照组MCF-7细胞中ERK磷酸化表达。与阴性对照组相比,miR-21-5p mimic组ERK磷酸化水平升高(P<0.05);miR-21-5p inhibitor组ERK磷酸化水平降低(P<0.05,见图3A、B)。
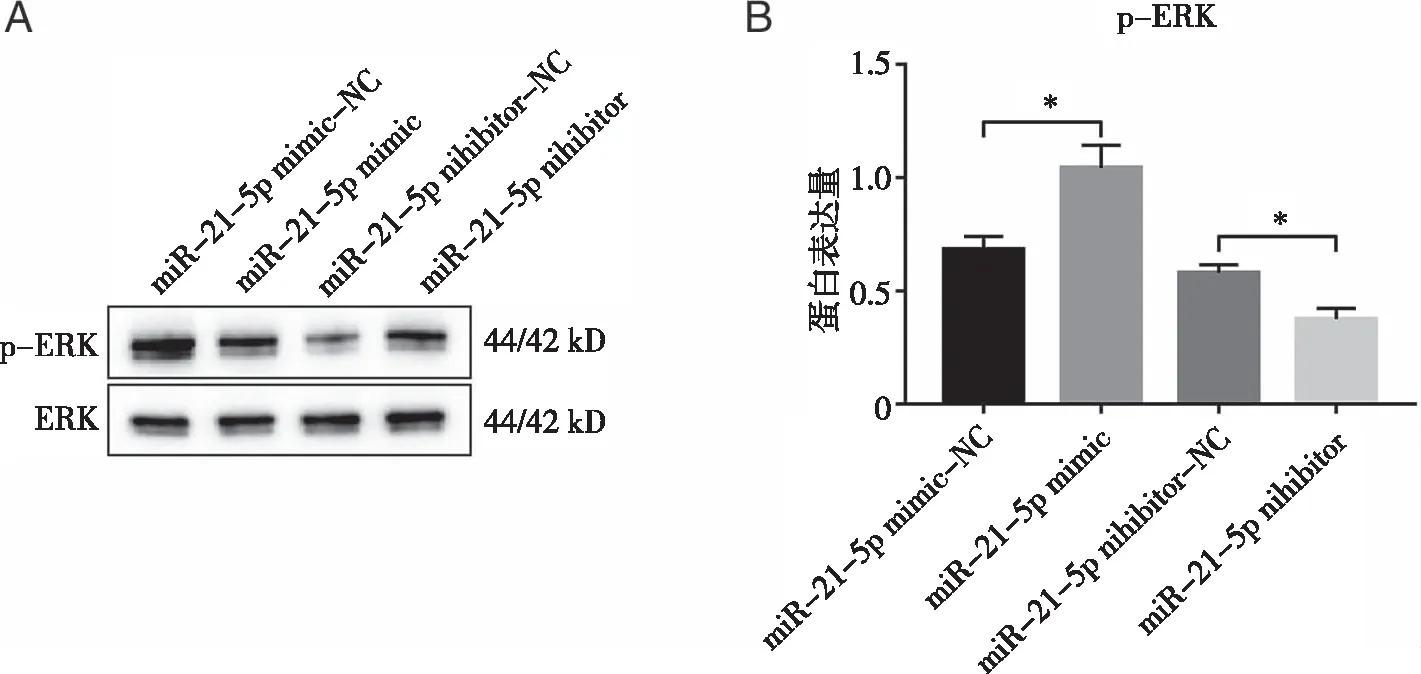
A、B:miR-21-5p mimic、miR-21-5p inhibitor对ERK磷酸化的影响;与相应阴性对照组相比,*:P<0.05。
2.4Spry1对MCF-7细胞中ERK磷酸化的影响 将pEXP-Spry1、si-Spry1和相应阴性对照转(pEXP-EGFP、si-Spry1-NC)染到MCF-7细胞,分别通过RT-qPCR和Western blot检测Spry1 mRNA和蛋白表达水平,与阴性对照组相比,pEXP-Spry1组Spry1 mRNA和蛋白水平显著升高(P<0.01,P<0.05);si-Spry1组Spry1 mRNA和蛋白水平降低(P<0.01,P<0.05,见图4 A、C);Western blot检测ERK磷酸化的表达变化。与阴性对照组相比,pEXP-Spry1组ERK的磷酸化水平降低(P<0.05);si-Spry1组ERK磷酸化水平升高(P<0.05,图4 B、D)。
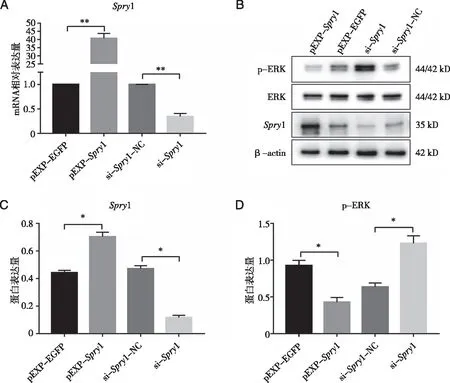
A:pEXP-Spry1、si-Spry1对Spry1 mRNA表达的影响;B-D:pEXP-Spry1、si-Spry1对Spry1、ERK磷酸化的影响;与相应阴性对照组相比,*:P<0.05,**:P<0.01。
3 讨论
乳腺癌是女性常见、难治、且死亡率高的恶性肿瘤[9]。研究发现miRNA异常表达与乳腺癌的发生、转移及预后关系密切[10]。miR-21-5p在多种肿瘤中表达升高,可调控与肿瘤细胞增殖相关的基因参与肿瘤的恶性进展,并在乳腺癌患者组织和血浆中检测出miR-21-5p表达水平高于健康女性[11-13]。miR-21-5p是由miR-21前体5'端臂端加工的致癌小分子RNA,可以在转录后或翻译水平调控靶基因表达,改变相应蛋白质以及信号通路的分子水平,影响细胞生物学效应[14-15]。Tao等[16]在MCF-7/PTX和MDA-MB-231/PTX紫杉醇耐药细胞系中检测到miR-21-5p表达被上调,会导致乳腺癌细胞增殖能力和化疗耐药性增强;Chang等[17]通过癌症基因组图谱(TCGA)分析发现miR-21-5p表达升高与人乳腺癌存活率有关。上述研究说明miR-21-5p不仅参与乳腺癌发生的过程,并且在乳腺癌治疗和患者生存率中也发挥一定作用。
田延龙等[18]采用不同浓度miR-21慢病毒转染乳腺癌 MCF-7细胞,检测 miR-21与 PDCD4 蛋白的调控关系,发现miR-21 通过调控 PDCD4 蛋白的表达可以影响乳腺癌 MCF-7 细胞的迁移和侵袭行为;与近期Pulito等[19]药理学相关剂量二甲双胍处理BT-474(三阳型乳腺癌)、MCF-7(Luminal A型乳腺癌)、SUM159PT和BT-549(三阴型乳腺癌)细胞的实验中,不仅发现4种乳腺癌细胞中miR-21-5p表达均降低,并且证实二甲双胍治疗后在小鼠乳腺癌荷瘤组织和96位乳腺癌患者血清中miR-21-5p水平也均降低,并分别通过细胞平板克隆、划痕愈合和Trans well侵袭实验证实,抑制miR-21-5p表达后4种乳腺癌细胞系克隆和迁移能力降低,均说明通过干扰miR-21的表达可以控制乳腺癌细胞的发生与进展。随着干扰miRNA表达的技术已日趋成熟,如能通过干预miR-21-5p的表达作为靶点影响乳腺癌细胞增殖、凋亡,可能成为有效治疗乳腺癌的一种新策略。
临床资料表明,在乳腺癌组织中ERK磷酸化水平明显高于癌旁组织,Ⅰ/Ⅱ期患者肿瘤组织ERK磷酸化明显低于Ⅲ/Ⅳ期,而ERK磷酸化水平低的乳腺癌患者有较好预后[20]。ERK是信号从细胞外转入细胞核内的传递者,活化后从胞质移位到核内,通过调节磷酸化转录因子、细胞骨架相关蛋白等基因表达,进而参与细胞多种生理过程[7,21]。田继华等[22]在ERK 抑制剂 U0126下调 Cyclin D1与 Survivin 蛋白表达抑制乳腺癌细胞增殖的研究中发现:在MCF-7、MDA-MB-231 细胞中通过阻断ERK信号通路,调控Cyclin D1和 Survivin蛋白的表达,获得抑制乳腺癌细胞增殖,促进癌细胞凋亡的结果。晋志远等[23]发现miR-21表达升高可抑制下游靶基因PTEN的表达,激活ERK和AKT信号通路,促进胆管癌细胞侵袭和转移。上述研究表明,miR-21通过激活MAPK/ERK信号通路途径,参与调节乳腺癌等肿瘤细胞的增殖、侵袭、转移和细胞凋亡。
研究报道Sprouty1(Spryl)蛋白作为生长因子信号通路的负性调节因子,在多种肿瘤中表达下调,与正常组织相比79%乳腺癌组织中Spry1表达也下调[24]。Ahmed等[25]研究发现Spry1可通过抑制肿瘤生长,调节细胞粘附以及抑制细胞迁移和侵袭而起到乳腺癌抑制剂的作用,说明Spry1是一种重要的乳腺癌抑癌基因。Spry1蛋白表达增加可以拮抗受体酪氨酸激酶(Receptor tyrosine kinase,RTK)信号通路,发挥抗肿瘤细胞增殖、迁移等作用[26]。MAPK/ERK作为RTK下游信号通路,当MAPK激酶被激活后使ERK活化,会导致ERK磷酸化水平增加并入核,参与细胞增殖、凋亡、分化等生物学效应[27]。上诉研究说明,Spry1表达异常参与乳腺癌的发生和进展,如若将Spry1作为治疗靶点,针对Spry1为靶点进行靶向药物的研发,以增强人乳腺癌细胞中Spry1对ERK磷酸化的抑制作用,进而抑制乳腺癌细胞的增殖和迁移。
我们研究表明Spry1是miR-21-5p潜在靶基因,在MCF-7细胞中过表达miR-21-5p后Spry1蛋白表达显著降低,ERK磷酸化水平升高;而抑制miR-21-5p表达后Spry1蛋白水平升高,ERK磷酸化水平降低;与Shen等[23]在miR-21通过PDCD4和Spry1的MAPKs负反馈调节对人胚肺成纤维细胞恶性转化影响的研究中miR-21与Spry1的相互关系结果一致。过表达Spry1可明显抑制ERK磷酸化,而干扰Spry1表达后ERK磷酸化水平升高,显示在MCF-7细胞中Spry1表达被抑制可促进ERK的磷酸化。
综上所述,miR-21-5p可在转录后或翻译水平抑制乳腺癌MCF-7细胞Spry1的表达,促进ERK磷酸化,可能是乳腺癌发生的分子机制之一,后续研究中将构建乳腺癌小鼠移植瘤模型,在体内实验中进一步探讨miR-21-5p对Spry1、ERK磷酸化的影响。
——一道江苏高考题的奥秘解读和拓展

