茶多酚脂质体温敏凝胶的制备工艺研究
宋婷婷,罗 珊,何碧玉,徐应淑
(遵义医科大学药学院暨基础药理省部共建教育部重点实验室,贵州 遵义 563099)
牙周疾病在全世界非常普遍,而氧化应激反应和炎症反应在牙周疾病的发病机理中起着重要作用[1-2]。茶多酚(Tea polyphenol,TP)是从茶叶中提取出来的多酚类化合物,具有良好的生物和药理作用,如抗氧化、抗菌、抗癌、降血脂等[3]。查阅近年文献发现,茶多酚可通过提供氢原子,作为自由基的受体,中断氧化反应,或通过螯合金属离子而用作抗氧化剂,并可抑制牙周病原体的生长,是控制牙周疾病的健康替代品[4-6]。然而,茶多酚中含有多羟基结构,对氧气和光的敏感性降低了其在加工和储存中的稳定性,并且其在人体内代谢时易与蛋白质结合而失去药理活性,导致其生物利用度较低,从而限制了其在医药领域的应用[7]。
脂质体是由膜状脂质分散在水性溶剂中形成的微观双层囊泡,可通过提高成分的溶解度,从而提高其生物利用度来改善产品性能,这些特性已在食品,化妆品和药品行业中广泛使用[8]。脂质体温敏凝胶作为一种新的透皮给药制剂,具有良好的生物相容性,对药物释放具有显著的缓释作用,可减少给药次数,提高患者的顺应性[9-10]。本研究拟将自制TP脂质体分散在以泊洛沙姆为基质的凝胶中,制备成脂质体温敏凝胶,并对TP脂质体温敏凝胶的制备工艺进行研究,筛选出最佳处方,提高制剂质量。
1 仪器与材料
1.1 仪器 T9CS双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);NanoBrook 90Plus PALS激光粒度仪(美国布鲁克海文仪器公司);DL-820D智能超声波清洗器(上海之信仪器有限公司);TGL-16C高速台式离心机(上海安亭科学仪器厂);SK220生物显微镜(麦克奥迪实业集团有限公司)。
1.2 药品与试剂 茶多酚(大连美仑生物技术有限公司,批号MB5041,纯度≥98%),蛋黄卵磷脂(PC-98T,艾伟拓(上海)医药科技有限公司,批号EK16068,BR),胆固醇(CH,成都市科隆化学品有限公司,批号2017090601,BR),泊洛沙姆188(P188,武汉华翔科洁生物科技有限公司,AR),泊洛沙姆407(P407,广州通哲生物科技有限公司,AR),1,2-丙二醇,0.02%苯扎溴铵、无水乙醇、三氯甲烷、磷酸氢二钠、磷酸二氢钠均为分析纯。
2 方法与结果
2.1 TP含量测定
2.1.1 TP紫外吸收波长的确定 精密称取茶多酚对照品适量,用无水乙醇配制成适宜浓度,以无水乙醇作为参比溶液,在200~700 nm波长范围内进行扫描[11],并记录紫外吸收光谱(见图1)。结果,TP对照品溶液在276 nm处有最大吸收,空白脂质体破乳溶液在276nm处无明显吸收,说明处方中辅料在276 nm处对TP含量测定无干扰。

图1 空白脂质体破乳溶(A)液和TP对照品溶液(B)的紫外吸收光谱图
2.1.2 标准曲线的绘制 精密称取茶多酚对照品0.0150 g至50 mL容量瓶中,加无水乙醇溶解稀释至300 μg/mL,得TP对照品储备液。再取配制好的TP对照品储备液适量,加无水乙醇稀释成6.0、12.0、18.0、24.0、30.0、36.0、42.0 μg/mL的标准溶液,以无水乙醇为参比溶液,在276 nm处测定吸光度A,并进行吸光度A-浓度C的线性回归。标准曲线的回归方程为A=0.024 8C+0.002 2(R2=0.999 9)。结果表明,TP在6.0~42.0 μg/mL范围内线性关系良好。
2.2 TP脂质体的制备及处方优化
2.2.1 TP脂质体的制备 采用薄膜超声分散法[12]制备TP脂质体。分别精密称取处方用量的蛋黄卵磷脂、胆固醇、TP于250 mL茄形瓶中,加入氯仿-无水乙醇(v/v 1∶1)混合溶剂超声溶解,35℃减压蒸发除去有机溶剂得到均匀透明薄膜。将膜用PBS缓冲液水合,在40℃水浴中保持30 min,超声处理即得TP脂质体混悬液,置于4℃保存。同法以不加TP制备空白脂质体。
2.2.2 脂质体包封率的测定 采用高速离心法[13]测定TP脂质体的包封率。精密吸取400 μL TP脂质体混悬液于离心管中,加无水乙醇混合至4 mL,超声破乳,吸取上清液加无水乙醇稀释至10 mL,在276 nm处测量其吸光度A,计算脂质体混悬液中TP总量(m1);另精密吸取400 μL TP脂质体混悬液加蒸馏水混合至2 mL,然后以12 000 r/min离心30 min,吸取上清液加无水乙醇稀释至10 mL,计算游离TP的量(m2)。根据公式计算TP脂质体的包封率EE%:包封率EE%=(m1-m2)/m1×100%;其中m1是脂质体混悬液中TP的总量,m2是脂质体混悬液中游离TP的量。
2.2.3 正交试验 在单因素试验基础上,选取蛋黄卵磷脂与胆固醇质量比(EPC:CH)、蛋黄卵磷脂与茶多酚质量比(EPC:TP)、水化介质pH值、超声时间4个因素,每个因素选定三水平,进行正交试验[14],对TP脂质体的制备工艺进一步优化(因素与水平见表1)。

表1 因素水平表
根据正交试验结果(见表2~3)可知,各因素对包封率的影响顺序为B>D>A>C,即蛋黄卵磷脂与药物质量比为主要影响因素,水化介质pH值的影响最小。最佳制备工艺条件为A3B2C1D3,即EPC:CH为4∶1、EPC:TP为5∶1、水化介质 pH 值为6.0、超声时间为4 min。

表2 正交试验结果
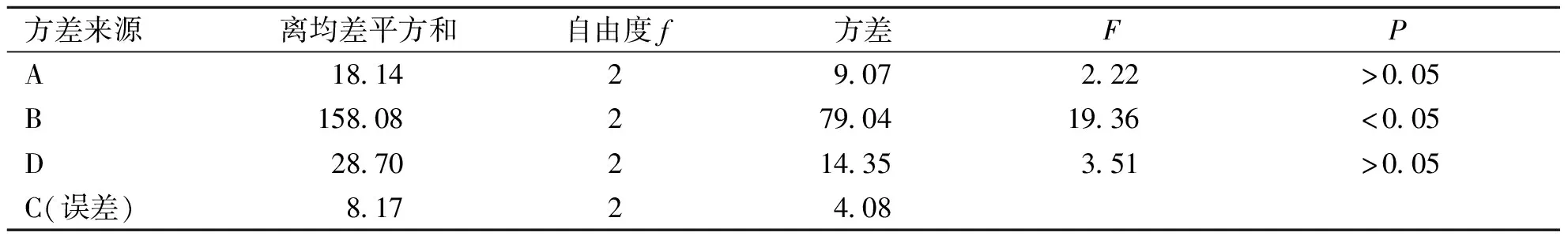
表3 方差分析表
2.2.4 最佳工艺的验证 按优化出的最佳工艺条件平行制备3批样品,测定包封率并计算载药量。测得茶多酚脂质体的平均包封率为68.84%(n=3),平均载药量为7.40%(n=3)。
2.3 TP脂质体质量评价
2.3.1 显微形态观察 取适量TP脂质体混悬液于载玻片上,加蒸馏水稀释,晾干后在显微镜下观察。如图2所示,在显微镜下TP脂质体形态均匀,呈球形或类球形。

图2 TP脂质体显微形态(×40)
2.3.2 粒径、粒度分布及Zeta电位的测定 取适量TP脂质体混悬液,加适量蒸馏水稀释,采用NanoBrook 90PlusPALS激光粒度仪测定其粒径、粒度分布及Zeta电位。结果见图3、表4。

图3 TP脂质体粒径分布

表4 粒径及Zeta电位测定结果
2.3.3 TP脂质体稳定性的考察 将TP脂质体在4 ℃条件下储存7、15、30 d后,测定脂质体的包封率和渗漏率,结果见表5。由表中数据可以看出TP脂质体储存在4℃条件下稳定性较好。
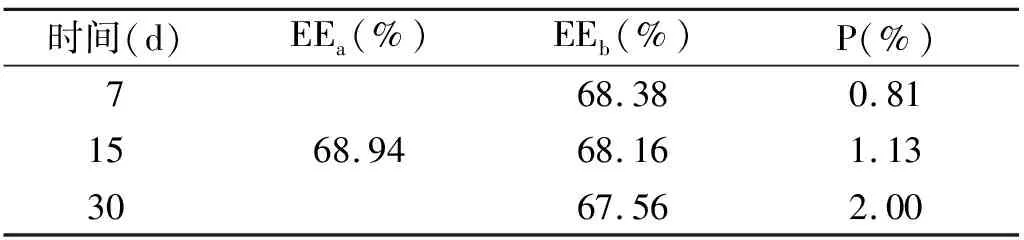
表5 渗漏率测定结果(n=3)
2.4 TP脂质体温敏凝胶的制备[15]称取处方量1,2-丙二醇、0.02%苯扎溴铵溶于适量蒸馏水中,再称取处方量的P407和P188撒布于上述溶液表面,置4℃冰箱中冷藏,使其充分溶胀至溶液澄清透明。另取TP脂质体混悬液,边搅拌边加入至上述凝胶中,充分搅拌混匀,使TP脂质体均匀分散在凝胶体系中,即得TP脂质体温敏凝胶。
2.5 胶凝温度的测定 采用倒置试管法[16]测定胶凝温度。量取适量冷藏的TP脂质体温敏凝胶溶液于试管中,置水浴锅中,以1 ℃/min的速率升温,每升高1℃,取出试管并倾斜90 °,观察温敏凝胶溶液的流动性。当完全无法流动时的温度即为胶凝温度。观察溶胶-凝胶状态的可逆变化,重复测量3次胶凝温度,计算平均值。
2.6 TP脂质体温敏凝胶处方用量的考察 以胶凝温度为考查指标,通过单因素试验分别考察P407用量,P188用量,TP脂质体用量及1,2-丙二醇用量对TP脂质体温敏凝胶胶凝温度的影响。
2.6.1 P407用量的考察 固定处方中其他用量,改变P407的用量(16%、18%、20%、22%、25%),按2.4项下方法制备TP脂质体温敏凝胶,并分别测定其胶凝温度。结果显示(见图3 A),P407浓度越高,胶凝温度越低。因此,选定P407的用量为16%进行单因素试验。
2.6.2 1,2-丙二醇用量的考察 固定处方中其他用量,改变1,2-丙二醇的用量,分别设为1%、3%、5%、10%、15%,按2.4项下方法制备TP脂质体温敏凝胶,并测定胶凝温度。结果见图3 B,1,2-丙二醇用量对其胶凝温度影响不大,选取3%的用量进行后续的单因素试验。
2.6.3 TP脂质体用量的考察 固定处方中其他用量,改变TP脂质体的用量,使其分别为20%、40%、60%、70%、80%,按2.4项下方法制备TP脂质体温敏凝胶,并测定胶凝温度。结果见图3 C,TP脂质体用量对其胶凝温度影响不大,选定20%的用量进行单因素试验。
2.6.4 P188用量的考察 在P407用量为16%,1,2-丙二醇为3%,TP脂质体为20%,苯扎溴铵为0.02%的基础上,改变P188用量,分别为3%、5%、8%、10%、15%制备凝胶。结果见图3 D,P188在3%~15%用量范围内均能使胶凝温度升高,但其升高温度的作用在此范围内无明显区别,即胶凝温度没有随浓度增大而增大的趋势。
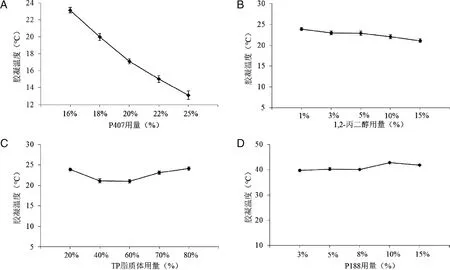
图4 不同P407用量、1,2-丙二醇用量、TP脂质体用量及P188用量对胶凝温度的影响
2.7 确定TP脂质体温敏凝胶的处方 根据2.6项的考察结果,确定1,2-丙二醇用量为3%,TP脂质体为20%,苯扎溴铵为0.02%。为进一步确定P407、P188的用量,分别选择用量为16%、17%的P407和2%、3%、4%的P188进行交叉实验制备温敏凝胶,并测定其胶凝温度。实验结果见表6。

表6 交叉实验结果(n=3)
因该制剂应用于口腔,用药时需为胶凝状态。由表中数据确定,当P407 16%,P188 3%,苯扎溴铵0.02%,丙二醇3%,TP脂质体20%时,其胶凝温度为36.8℃。经处方验证,该载有茶多酚脂质体温敏凝胶的胶凝温度为36.3℃(n=3),接近正常人口腔温度(36.3~37.2)℃。因此,本实验制备的温敏凝胶制剂适合局部递送药物。
3 讨论
本实验采用薄膜超声分散法制备茶多酚脂质体,简单易行,稳定性好。茶多酚脂溶性较差,将其制备成脂质体,可利用脂质体良好的透皮吸收特性,促进药物的吸收。采用高速离心法测定脂质体的包封率,准确率高,操作简便。处方及制备工艺是影响脂质体质量的关键步骤,通过单因素试验和正交试验进行优化,结果表明:①EPC:TP变化是影响脂质体包封率的主要因素,且EPC:TP为5∶1时,包封率最高,可能是由于包封茶多酚的脂质体囊泡体积有限。②胆固醇可镶嵌到磷脂膜中,调节膜的流动性,减少磷脂的氧化,但是过量的胆固醇会使膜的形成变得困难,导致包封率降低。实验结果也发现[17],随着磷脂与胆固醇比的增加,包封率会先升高再降低。③PBS缓冲液pH值约为6.0时,包封率最高。查阅文献得知[18],部分氢化的蛋黄卵磷脂在pH 6.5左右具有最大的稳定性。④荷电脂质体可以减少聚集和融合,提高脂质体的稳定性。Zeta电位是衡量电荷量的重要指标。一般情况下,如果Zeta电位绝对值大于30 mV,体系是稳定的。本实验制备的脂质体的Zeta电位值为-48.82,说明该脂质体混悬液稳定性良好。
由于脂质体难以黏附在皮肤表面,而凝胶与皮肤接触时,皮肤表层迅速被润湿,药物以被动扩散方式透过表皮,所以将TP脂质体与温敏凝胶相结合。脂质体温敏凝胶具有制备简单,使用方便等优点,通过改变泊洛沙姆188和泊洛沙姆407的用量,使其在室温时为溶胶,到达给药部位后能迅速发生相转变形成凝胶。利用凝胶载体的包封与阻滞作用[19],可在皮肤表层形成药物储库,延长药物作用时间;同时借助其良好的黏附特性降低脂质体的流动性,防止药物渗出脂质体,增加脂质体的稳定性,从而提高药物生物利用度[20-21],为茶多酚新剂型的临床应用提供参考。本实验制备的TP脂质体温敏凝胶成型性较好,与正常人的口腔温度相近,是具有温敏特性的凝胶溶液。但TP脂质体以液体状态存在,即使用量为80%时,凝胶的含药量也较低。因此,后期研究中可先将TP脂质体混悬液冷冻干燥后以脂质体冻干粉制备TP脂质体温敏凝胶。TP脂质体温敏凝胶的药效学及药代动力学实验还需进一步研究。

