lncRNA FOXCUT调控Notch通路抑制结肠癌细胞增殖、侵袭的实验研究
佘明豪,刘寒松,杨文辉,余洋,张磊
结肠癌是一种常见的消化系统恶性肿瘤,其中约90%的早期患者可通过手术切除治愈,但由于其早期临床症状不典型,多数患者确诊时已进入中晚期,严重威胁人类健康[1]。研究结肠癌的发病机制,寻找新的有效治疗靶点对于改善其预后、提高患者生存率和治愈率至关重要。长链非编码RNA(long non−coding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA,进化过程高度保守,可通过协同邻近编码基因表达发挥表观遗传、转录后调控功能,在结肠癌发生发展中起重要作用[2]。FOXC1 启动子临近转录体(FOXC1 promoter upstream transcript,FOXCUT)是一种位于促癌基因叉头框基因FOXC1 启动子上游的lncRNA。研究报道,FOXCUT在鼻咽癌[3]、结直肠癌[4]等多种癌症中表达上调,但关于其对结肠癌细胞生物学行为的影响尚鲜有研究。Notch信号通路由受体、配体及细胞内效应器3部分组成。已有研究证实,Notch信号通路激活在结肠癌中发挥重要作用[5]。本研究拟探究FOXCUT 对结肠癌细胞增殖、侵袭的影响及是否亦通过调节Notch信号通路发挥作用,以期揭示其作用机制。
1 材料与方法
1.1 主要试剂 Lipofectamine 2000 试剂盒(货号L7800)、CCK−8 试剂盒(CA1210)购自北京索莱宝科技有限公司;FOXCUT siRNA及其阴性干扰序列由南京金斯瑞生物科技有限公司设计合成;RNA提取试剂盒(货号DP419)购自天根生化科技(北京)有限公司;实时荧光定量PCR(qPCR)试剂盒(货号D7268S)购自上海碧云天生物技术有限公司;兔源一抗 anti−Notch1(货号 ab52627)、anti−Hes1(货号 ab108937)、anti−β−actin(货号ab179467),二抗羊抗兔IgG(货号ab6721)均购自英国 Abcam 公司。7500qPCR 仪、Evolution220 紫外分光光度计、Forma Steri−Cycle i160 5%CO2培养箱购自美国Thermo Fisher 公司;MODEL550 型酶标仪购自美国 Bio−Rad公司;ix73荧光显微镜购自日本Olympus公司。
1.2 方法
1.2.1 组织来源 选取2018 年1 月—2019 年5 月期间于郑州大学附属郑州中心医院收治的30例患者的结肠癌及其癌旁组织标本,均经病理学确诊。所有标本采集均取得患者及其家属知情同意并签字确认,经本院伦理委员会批准通过。
1.2.2 细胞培养 人结肠癌细胞株SW480、SW620、HCT116、HT29及人正常结肠上皮细胞NCM460(均购自中国科学院上海细胞库)采用含10%FBS、100 U/mL 青霉素和0.1 g/L链霉素的DMEM/F12培养基置于37 ℃、5%CO2细胞培养箱中培养,取对数生长期细胞进行传代培养,细胞传代采用0.25%胰蛋白酶消化处理。
1.2.3 细胞转染 取对数生长期HCT116细胞接种至6孔细胞板,待细胞汇合至80%时,采用Lipofectamine 2000试剂盒转染FOXCUT siRNA(FOXCUT siRNA组)及转染阴性siRNA为阴性对照组(FOXCUT siRNA−NC组),另设正常培养HCT116细胞为正常对照组(NC 组)。其中FOXCUT siRNA 序列:5'−AGAU⁃AAUUGUCUUAGUUCUCCAUCG−3';阴性 siRNA 序列:5'−CGUAGUGCGUAGUGCUAGUGCGUAG−3'。具体步骤严格按照试剂盒说明书进行,转染后48 h收集各组细胞进行相关实验检测。
1.2.4 qPCR实验检测FOXCUTmRNA表达 提取结肠癌组织、癌旁组织、结肠癌细胞、正常结肠上皮细胞及转染后各组细胞总RNA,反转录得到cDNA,置于−20 ℃保存备用。采用qPCR扩增FOXCUT及β-actin。其中FOXCUT引物:上游 5'−GTC⁃GCACCGATGACTAACG−3' ,下 游 5'−GCCCTCAAAGCC⁃GAACTG−3';内参β-actin引物:上游 5'−GAGACCTTCAA⁃CACCCCAGCC−3',下游5'−AATGTCACGCACGATTTCCC−3'。20 μL反应体系:TB Green Premix Ex Taq Ⅱ(2×)10.0 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA(50 μg/L)2.0 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,61 ℃ 31 s,40个循环。以β-actin为内参基因,FOXCUTmRNA相对表达水平采用2−ΔΔCt法进行定量分析。
1.2.5 CCK−8 实验检测转染后各组细胞增殖情况 取对数生长期HCT116细胞接种至96孔细胞板,接种密度分别为0、625、1 250、2 500、5 000、10 000、20 000、30 000、40 000个/孔,各设置3个复孔,待细胞完全贴壁后,每孔加入20 μL CCK−8溶液,37 ℃孵育3 h,酶标仪下测定各孔450 nm波长处吸光度(A)值,求各接种密度下均值A,以接种密度为横坐标,A值为纵坐标,绘制CCK−8标准曲线。根据CCK−8标准曲线,取对数生长期HCT116 细胞接种至96 孔细胞板,接种密度1×104个/孔,细胞分组同1.2.3,分别于转染48 h 后添加CCK−8 试剂,37 ℃孵育3 h 后,采用酶标仪检测各组细胞于450 nm 波长处A值。
1.2.6 集落形成实验检测转染后各组细胞克隆能力 各组HCT116 细胞培养14 d 后,采用纯甲醇固定,0.1%结晶紫染色,显微镜下计数细胞集落,以≥50 个细胞团块计数为1 个集落。
1.2.7 Transwell 实验检测转染后各组细胞侵袭能力 将转染后各组HCT116 细胞用无血清培养基重悬,添加至包被Matrigel 的小室中,每个小室下室添加 500 μL 含 10%FBS 的DMEM/F12培养基,孵育48 h后弃去培养基,PBS洗涤后,4%甲醛固定,0.1%结晶紫染色,显微镜下随机读取5 个视野计数侵袭细胞,取其平均值。
1.2.8 qPCR 检测各组细胞Notch1、Hes1mRNA 表达 参照1.2.4方法检测各组细胞Notch1、Hes1及β-actin。其中Notch1引物:上游 5'−GCTGACCTGCGCATGTCTGCCATG−3',下游5'−CATGTTGTCCTGGATGTTGGCATCTG−3';Hes1引物:上游5'−GCACAGAAAGTCATCAAAGCCTATT−3' , 下 游 5'−GCTATCTTTCTTCAGAGCATCCAA−3'。以β-actin为内参基因,计算Notch1及Hes1mRNA相对表达水平。
1.2.9 采用蛋白免疫印迹(Western blot)实验检测转染后各组细胞中Notch1、Hes1蛋白表达 蛋白提取试剂盒提取总蛋白,二喹啉甲酸法(BCA)法测定蛋白质浓度,依次进行SDS−PAGE、转膜、封闭,添加一抗 anti−Notch1(1︰2 000)、anti−Hes1(1︰1 000)、anti−β−actin(1︰2 000),4 ℃孵育过夜,添加二抗IgG(1︰5 000)室温避光孵育1 h,增强化学法显影,蛋白条带灰度值用Image J软件分析。
1.3 统计学方法 采用SPSS 25.0 软件进行统计学分析,计量资料均采用均数±标准差()表示,2 组间比较采用独立样本t检验,多组间数据比较采用单因素方差分析(one−way ANOVA),组间多重比较采用Bonferroni 校正的t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 FOXCUT 在结肠癌组织及结肠癌细胞中表达上调 与癌旁组织比较,结肠癌组织中FOXCUTmRNA 表达水平显著增高(t=9.660,P<0.01),见图1A。与正常结肠上皮细胞NCM460 比较,结肠癌细胞株 SW480、SW620、HCT116、HT29 中FOXCUTmRNA 表达水平均显著增高(P<0.01),其中以HCT116 细胞中表达水平最高,因此选择HCT116 细胞作为细胞载体进行下游试验,见图1B。NC 组与FOXCUT siRNA−NC 组 HCT116 细 胞 中FOXCUTmRNA 表达水平差异无统计学意义(t=0.540,P>0.05);与 FOXCUT siRNA−NC 组 比 较,FOXCUT siRNA 组 HCT116 细胞中FOXCUTmRNA 表达水平显著降低(t=12.316,P<0.01),见图1C。
2.2 沉默FOXCUT 对HCT116 细胞增殖活力的影响 与 FOXCUT siRNA−NC 组(0.97±0.11)比较,FOXCUT siRNA 组 HCT116 细胞增殖活力(0.52±0.07)显著降低(t=8.454,P<0.01),见图2。
2.3 沉默FOXCUT对HCT116细胞集落形成能力的影响 与FOXCUT siRNA−NC 组(127.49±16.35)比较,FOXCUT siRNA 组HCT116 细胞集落形成数量(38.17±10.81)显 著 减 少(t=11.162,P<0.01),见图3。
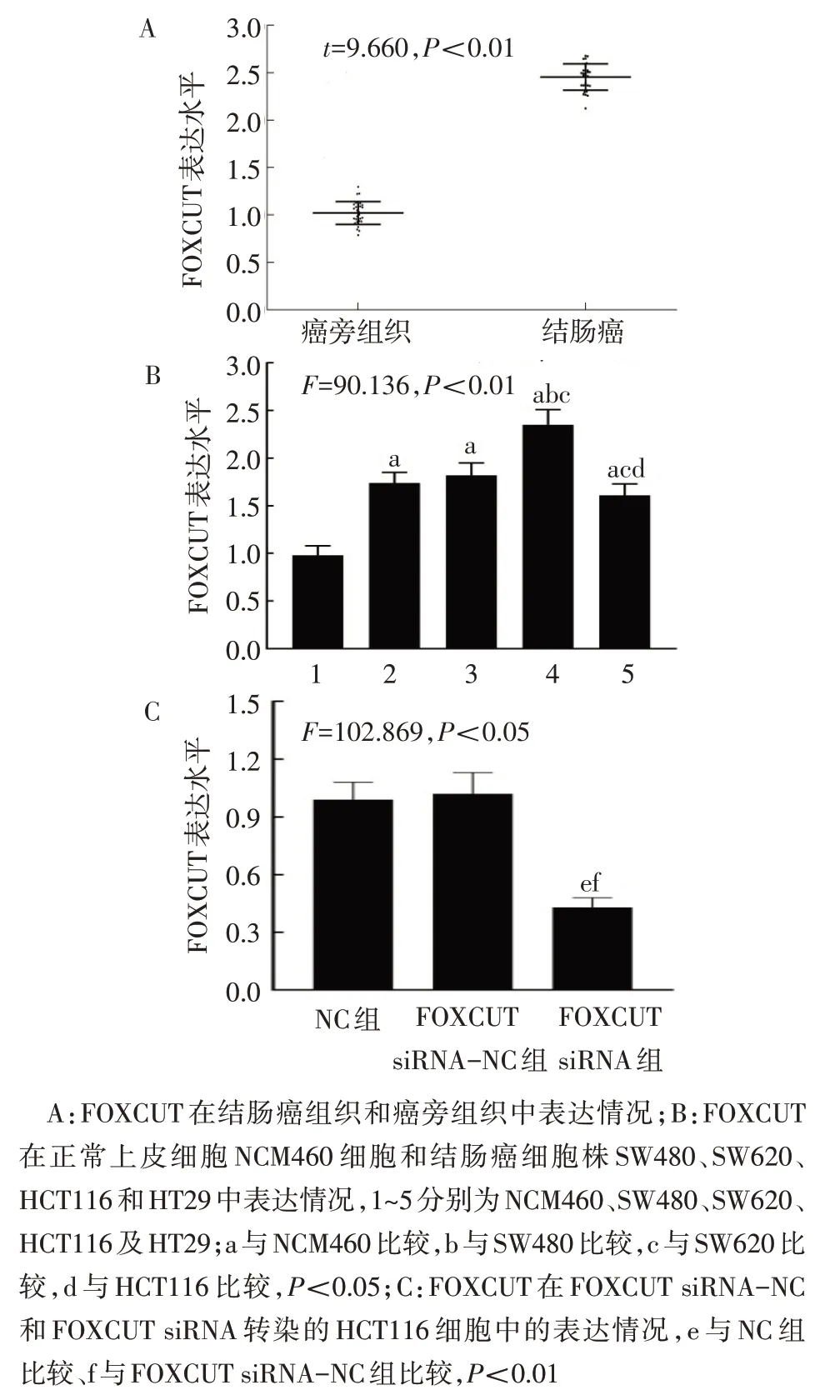
Fig.1 Expression levels of FOXCUT in colon tissues and cells图1 FOXCUT在结肠组织及细胞中的表达水平
Fig.2 CCK−8 standard curve图2 CCK−8标准曲线
2.4 沉默FOXCUT对HCT116细胞侵袭的影响 与FOXCUT siRNA−NC 组(97.93±12.31)比较,FOXCUT siRNA 组HCT116 细胞侵袭数(38.83±10.97)显著减少(t=8.780,P<0.01),见图4。

Fig.3 Effects of FOXCUT silencing on colony forming ability of HCT116 cells图3 沉默FOXCUT对HCT116细胞集落形成能力的影响

Fig.4 Effects of FOXCUT silencing on invasion of HCT116 cells(×400)图4 沉默FOXCUT对HCT116细胞侵袭的影响(×400)
2.5 沉 默 FOXCUT 对 HCT116 细 胞Notch1、Hes1mRNA表达的影响 与FOXCUT siRNA−NC组比较,FOXCUT siRNA 组 HCT116 细胞Notch1、Hes1mRNA表达水平显著降低(n=6,t分别为11.658、8.445,均P<0.01),见图5。

Fig.5 Effects of FOXCUT silencing on Notch1 and Hes1 mRNA expression levels in HCT116 cells图5 沉默FOXCUT对HCT116细胞Notch1、Hes1 mRNA表达的影响
2.6 沉默 FOXCUT 对 HCT116 细胞 Notch1、Hes1 蛋白表达的影响 与FOXCUT siRNA−NC 组比较,FOXCUT siRNA组HCT116细胞Notch1、Hes1蛋白表达水平显著降低(t分别为 8.818、10.955,均P<0.01),见图6。
3 讨论

Fig.6 Effects of FOXCUT silencing on Notch1 and Hes1 protein expressions in HCT116 cells图6 沉默FOXCUT对HCT116细胞Notch1、Hes1蛋白表达的影响
3.1 FOXCUT 在结肠癌组织及细胞株中的表达情况 lncRNA在人类基因组中含量丰富,主要通过染色体重塑、基因印迹、降解和翻译mRNA等形式发挥作用[6]。FOXCUT 是近年来新发现的一种 lncRNA,因位于FOXC1基因启动子上游而得名,而FOX家族可通过多种机制促进肿瘤细胞转移及侵袭,在结肠癌等恶性肿瘤进展中发挥重要作用[7]。孔祥盼等[8]研究报道,FOXCUT 在口腔鳞癌组织及细胞中高表达,抑制FOXCUT表达可体外抑制口腔鳞癌Tca8113细胞增殖和迁移。本研究发现,与癌旁组织及正常结肠上皮细胞相比,结肠癌组织及细胞株SW480、SW620、HCT116、HT29 中FOXCUTmRNA 表达水平均显著增高,提示FOXCUT可能起促癌样基因作用,其表达上调与结肠癌发生有关,但FOXCUT 与结肠癌细胞生物学行为的关系仍待进一步验证。
3.2 FOXCUT 对HCT116 细胞增殖、侵袭能力的影响 TCGA数据库显示FOXC1和FOXCUT在胃癌组织中高表达,与肿瘤直径、淋巴结转移、TNM 分期、分化程度有关;体外实验表明,抑制FOXCUT表达可抑制胃癌细胞增殖及侵袭,促进其凋亡[9]。本研究沉默 FOXCUT 后发现,与 FOXCUT siRNA−NC 组比较,FOXCUT siRNA 组 HCT116 细胞增殖活力、集落形成能力及侵袭能力均显著降低,再次验证了FOXCUT 在结肠癌细胞中的促癌样作用,抑制其表达可抑制其恶性增殖及侵袭行为。此外,检测FOXCUT表达有助于鼻咽癌[10]、头颈部肿瘤[11]、三阴性乳腺癌[12]等多种肿瘤的早期诊断及预后评估,因此推测FOXCUT可能作为结肠癌诊断的潜在生物标志物。
3.3 FOXCUT 影响HCT116 细胞增殖、侵袭能力的机制 Notch信号通路几乎涉及细胞所有的增殖、分化、凋亡、侵袭、迁移及血管形成等活动,Notch 受体是细胞正常发育的决定性因素,目前已鉴定4 种Notch受体及5个相应配体,其异常表达与肿瘤细胞增殖密切相关[13]。Hes1 是 Notch 下游关键靶基因。研究证实,抑制Notch 通路可引起Notch1、Hes1等相关基因表达下调,PTEN 表达增加,进而负性调节PI3K/Akt 通路,参与调控食管癌细胞增殖、凋亡、侵袭和迁移[14]。本研究发现,下调 FOXCUT 可降低Notch1、Hes1 mRNA 及蛋白表达水平,提示下调FOXCUT 抑制结肠癌HCT116 细胞增殖及侵袭能力可能与降低Notch1、Hes1表达、抑制Notch 通路激活有关。熊祎虹等[15]发现,激活Notch1可促进结肠癌细胞及其干细胞增殖,促进肿瘤发生,证实Notch 通路激活在结肠癌细胞增殖、侵袭等生物学行为中发挥重要作用,因此推测FOXCUT可能通过调控Notch信号通路影响结肠癌细胞的增殖和侵袭行为。
综上所述,沉默FOXCUT可抑制结肠癌HCT116细胞增殖及侵袭,可能与抑制Notch 通路激活有关。本研究仅初步探究了FOXCUT 调控Notch 通路对结肠癌细胞生物学行为的影响,但关于FOXCUT 对Notch通路的调控作用是直接还是间接,是否还有其他信号通路参与,将是笔者下一步重点探究的内容。

