雷帕霉素对Yap1-β-连环蛋白诱导儿童肝母细胞瘤抑制作用的研究①
任 慧,赵天娇,张 娟,陈秀珍,刘 锋,牛会忠
(河北省儿童医院普外科,河北石家庄050000)
肝母细胞瘤(hepatoblastoma,HB)发病率约为2.46/100万,是最常见的儿童肝部恶性肿瘤,多见于2岁以下婴幼儿。HB的发病率呈逐渐升高趋势[1]。HB的发病机制尚未完全阐明,Beckwith-Wiedemann综合征、家族性腺瘤性息肉、低出生体质量早产儿等均增加HB的发病风险[2]。手术切除联合术后辅助化疗是HB的主要治疗模式,是患者长期无瘤生存的有效方式。随着治疗水平的提高,HB的预后明显改善,低危HB患儿的5年生存率约为80%~90%,但仍有部分因为化疗耐药、术后残留等因素出现术后复发,影响治疗效果。对HB分子机制的研究有助于更好的了解HB的发病机制,探讨新的治疗方法[3]。虽然HB发病率较低并呈散发性,仍有几项小样本的队列研究显示β-连环蛋白(β-catenin)途径是导致HB的重要始动因素[4]。已有研究显示,在60%~70%的HB病理组编码β-catenin的CTNNB1基因存在缺失或错义突变,破坏β-catenin的磷酸化和降解,导致活性β-catenin持续累积于细胞核和细胞浆中,持续活化下液靶基因,参与肝母细胞的发生[5]。Patel等[6]研究显示,多数HB病例中转录共刺激因子-Yes相关蛋白(yes-associated protein,YAP)被激活,约80%的HB患者可检测到YAP和β-Catenin的协同活化。在小鼠中运用高压尾静脉注射技术共转染功能活化形式的YAP1和β-catenin可促使HB形成,但其具体机制仍不清楚。本研究注射YAP1-β-catenin诱导HB,采用哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂雷帕霉素(rapamycin,RAPA)进行干预,探讨抑制mTOR对Yap1-β-连环蛋白诱导的儿童肝母细胞瘤生长发育的影响,现将结果报道如下。
1 材料与方法
1.1 材料 无特定病原体(specific pathogen free,SPF)级FVB/N小鼠18只,8~10周龄,体重20~25g,购于山东大学实验动物中心。动物许可证号[SCXK(鲁)2018-103],山东大学医学院实验动物中心使用许可证号[SYXK(鲁)2018-131]。实验动物采用12h光照-黑暗循环,自由饮水和进食。pt3-ef1αyaps127a和pT3-EF1α-ΔN90-β-catenin由大连宝公司构建。
1.2 方法
1.2.1 造模和干预 常温融解pt3-ef1α-yaps127a和pT3-EF1α-ΔN90-β-catenin,将10μgpt3-ef1α-yaps127a、10μgpT3-EF1α-ΔN90-β-catenin和4μg PCMV/SB混合于2 mL生理盐水中。每只小鼠通过高压尾静脉注射转染法注射2 mL,小鼠取双侧尾静脉进行注射,注射过程5~9 s,推注成功可见小鼠短暂性呼吸急促、活动力减弱等心衰症表现[7]。注射完毕后随机将小鼠分为对照组和观察组各9只,对照组小鼠在注射后保持10周正常饮食,观察组在注射后保持5周正常饮食,然后采用含19 mg/kg RAPA的饮食治疗5周。
1.2.2 超声检查 于注射后第4周、7周、8周、9周、10周对小鼠行超声检查。采用Vevo®3100小动物超声成像平台进行评估小鼠的肝脏体积和肝脏肿瘤,探头频率20 MHz。小鼠吸入异氟醚和氧气混合物进行镇静,首先采用超声二维成像观察肝脏和肿瘤,然后切换到三维模式,3D扫描参数:传感器频率21 MHz,输出功率100%,增益23~27 db,动态范围60 db,深度18 mm,3D范围27~35 mm,三维步长0.1 mm,三维扫描图像储存于硬盘中,采用Vevo lab 3.0.0软件进行后期处理。采用多切面法,绘制各切面的肝脏边界,重建肝脏三维图像,通过软件分析计算肝脏体积,然后逐帧在连续切面上识别肝脏肿瘤,测量每个病变体积。根据第10周肿瘤体积计算抑瘤率(tumor inhibition rate,TIR)=(对照组肿瘤体积-观察组肿瘤体积)/对照组肿瘤体积×100%。
1.2.3 HE染色和免疫组化染色 治疗后第10周处死小鼠取肝脏,采用10%福尔马林固定48h,然后石蜡包埋,连续切石蜡片4μm,晾干玻片后行常规HE染色和相关免疫组化染色。
1.3 统计学方法 采用SPSS23.0进行统计学数据分析,计量资料采用均数±标准差(-x±s)表示,组间采用独立样本t检验进行分析,组内比较采用重复测量数据方差分析,生存时间比较采用Log-Rank法分析,以P<0.05为差异有统计学意义。
2 结果
2.1 RAPA对HB小鼠模型肝脏体积的影响 注射第4周时2组小鼠的肝脏体积[(783.7±48.2)mm3vs(805.3±59.6)mm3]差异无统计学意义,在注射10周末观察组小鼠肝脏体积[(5 963.7±1 423.5)mm3vs(1 492.3±483.5)mm3]显著降低(P<0.05),从7周开始观察组小鼠肝脏体积增加速度明显减慢,随着时间延长,与对照组肝脏体积差异越来越明显(图1~2)。

图1 RAPA对HB小鼠模型肝脏体积的影响
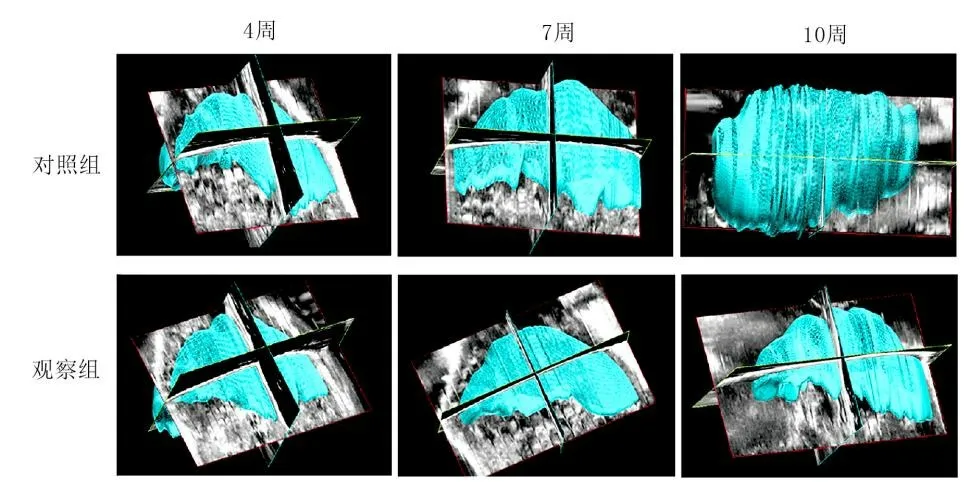
图2 RAPA对HB小鼠模型肝脏体积影响的超声三维重建图像
2.2 RAPA对HB小鼠模型肿瘤数量的影响 注射第4周时2组小鼠的肿瘤数量[(0.3±0.9)个vs(0.5±0.8)个]差异均无统计学意义,在注射10周末观察组小鼠肿瘤数量[(19.4±11.2)个vs(40.3±8.5)个]显著降低(P<0.05);与对照组相比较,从第7周开始,观察组小鼠肿瘤数量显著减少,且随着时间越长,与对照组小鼠肿瘤数量差异越来越明显(图3)。

图3 RAPA对HB小鼠模型肿瘤数量的影响
2.3 RAPA对HB模型小鼠肿瘤直径的影响 注射第4周时2组小鼠的肿瘤直径[(0.5±2.6)mm vs(0.9±3.1)mm]差异无统计学意义,在注射10周末观察组小鼠肿瘤直径[(45.8±23.2)mm vs(179.3±34.6)mm]显著降低(P<0.05);与对照组相比较,从第7周开始,观察组小鼠肿瘤直径明显减少,随着时间延长,与对照组小鼠肿瘤直径差异越来越明显(图4)。
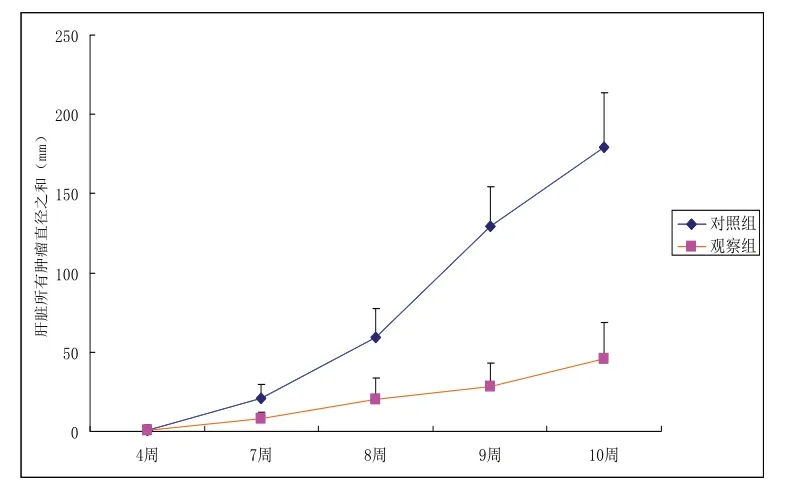
图4 RAPA对HB模型小鼠肿瘤直径的影响
2.4 RAPA对HB模型小鼠大体形态的影响对照组小鼠在注射后第10周末因为肿瘤形成导致肝脏显著增大,肿瘤体积显著高于对照组(图5)。

图5 RAPA对HB模型小鼠大体形态的影响
2.5 RAPA对HB模型小鼠肝脏HE及免疫组化染色的影响HE染色显示,注射后第10周末,对照组肿瘤的组织学表现为密集的低分化或未分化HB;RAPA治疗组小鼠肿瘤负荷降低,肿瘤组织由分化良好的细胞组成,组织学表现类似于高良好的HB(图6)。标记外源性Δn90-β-连环蛋白的Myc标签蛋白免疫组化染色显示,对照组可见大量大小不等的myc标签蛋白阳性HB肿瘤结节,占据肝叶大部;观察组myc标签蛋白阳性HB结节数量明显减少,肝实质所占比例较大(图7)。
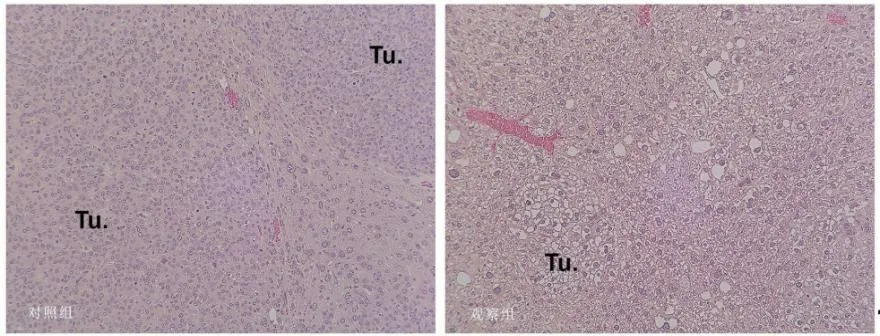
图6 RAPA对HB模型小鼠肝脏HE染色结果的影响(Tu代表肿瘤组织,×100)
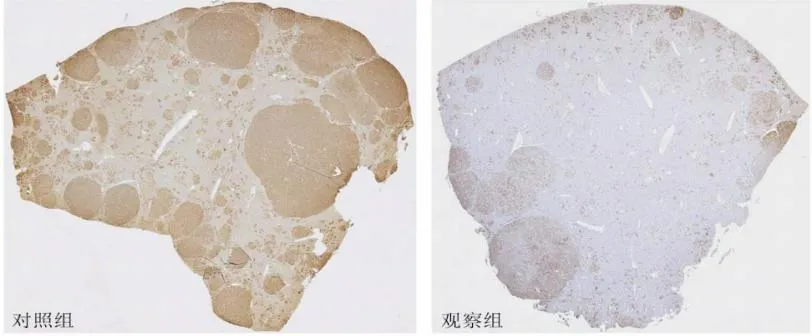
图7 RAPA对HB模型小鼠肝脏免疫组化靶向myc标签染色结果的影响(×10)
3 讨论
HB是儿童时期常见的肝脏恶性肿瘤,占肝脏原发性恶性肿瘤的50%~60%,居儿童实体肿瘤的第3位。HB单纯手术切除效果欠佳,5年生存率仅为20%~30%。近年来随着辅助化疗的应用和手术技术的进步,HB的5年生存率已经显著提高,但HB化疗耐药和复发后的治疗仍是HB的治疗难点问题[8]。与多数儿童肿瘤一样,HB的病因、发病机制目前尚未完全阐明,目前报道约70%的HB与CTNNB1突变相关。CTNNB1基因编码β-catenin,CTNNB1突变导致β-catenin表达异常,通过MYC肿瘤蛋白活化引起细胞增殖,Wnt/β-catenin是目前广泛接受的HB致瘤信号通路,但直接抑制Wnt/β-catenin较难实现[9]。
本研究结果显示,RAPA可显著减缓HB模型小鼠肝脏肿瘤数量、肿瘤直径和肝脏体积,本研究结果证明mTOR在HB的发展中发挥重要作用。Hippo/YAP信号通路在体内控制细胞增殖和凋亡,已有研究显示,Yap表达水平在HB中呈高表达,高于在原发性肝细胞肝癌中的表达,且YAP与β-catenin共活化仅见于HB中,较少见原发性肝细胞肝癌[10]。YAP通路可激活mTOR信号通路,调控细胞生长,在肿瘤的发生发展中发挥重要作用。mTOR包括mTORC1和mTORC2。mTORC1控制体内多种生物学进程,其异常激活与肿瘤、心血管疾病、2型糖尿病、神经退行性病变等多种疾病相关,如在肝细胞癌中即发现mTORC1通路激活[11]。在HB细胞系中存在mTORC1的异常激活,通过YAP1-β-catenin可建立HB动物模型,mTORC1抑制剂MLN0128体外可抑制人HB细胞的生长[12]。在Yap1-β-catenin动物模型中,YAP1可上调谷酰胺转运体slc38a1表达,调节GS的表达,调节谷氨酰氨表达水平,促进mTORC1的激活[13]。YAP1也可下调mTOR的负调节因子PTEN来激活mTOR信号[14]。因此多种调节mTOR的机制共同激活可能是HB发生、发展的重要机制。
目前多种mTOR抑制剂已经被批准临床应用,体外研究显示对前列腺癌[15]、结肠癌[16]、肝癌[17]、乳腺癌[18]等多种实体肿瘤治疗有效,但因为mTOR信号通路的复杂性和存在继发耐药性,mTOR抑制剂临床应用治疗肿瘤临床效果仍存在局限性。RAPA及其类似物具有细胞抑制作用,可抑制细胞增殖,与细胞毒性化疗药物联合应用显示具有协同作用。本研究结果显示,在注射第4周时2组小鼠的肝脏体积[(783.7±48.2)mm3vs(805.37±59.6)mm3]和肿瘤大小[(0.5±2.6)mm vs(0.9±3.1)mm]均无显著差异,在注射10周末RAPA饮食组小鼠肝脏体积[(5963.7±1423.5)mm3vs(1492.3±483.5)mm3]和肿瘤直径[(179.3±34.6)mm vs(45.8±23.2)mm]均显著降低,TIR为72.69%。本研究结果提示:RAPA饮食可减缓HB肿瘤生长和细胞增殖;但经RAPA饮食干预的小鼠HB肿瘤并未完全消失,而是肿瘤负担降低。结果提示,RAPA可抑制HB细胞增殖,但不能完全杀死肿瘤,可能与HB发病涉及到多个信号通路有关,因此在RAPA治疗的同时应联合细胞毒药物化疗以进一步提高疗效。组织学观察显示,RAPA饮食干预的小鼠肿瘤组织表现分化程度较好,考虑与以下因素有关:①RAPA通过抑制mTORC1改变细胞代谢减缓肿瘤增殖,促进HB细胞分化向增殖缓慢的分化良好的HB细胞;②YAP1-βcatenin模型存在异质性,随着RAPA干预时间延长,RAPA抑制低分化HB细胞增殖,分化良好HB细胞在治疗过程中持续存在。
综上所述,本研究采用mTOR抑制剂RAPA对YAP1-β-catenin模型小鼠进行干预,结果显示RAPA可抑制HB增殖,促使HB向分化良好的组织学形态发展。

