细粒棘球绦虫腺苷酸活化蛋白激酶AMPKα生物信息学分析
颜明智,李锦田,刘 辉,库尔班尼沙·阿马洪,吕国栋,赵 军
(1新疆医科大学药学院,乌鲁木齐830011;新疆医科大学第一附属医院2临床医学研究院,3临床药学科,乌鲁木齐830054)
囊型包虫病是一种由细粒棘球绦虫(Echinococcusgranulosus)的幼虫引起的人畜共患的慢性寄生虫病,对于发展中国家仍然是一个严重的公共卫生问题[1-2]。目前治疗包虫病的主要手段有手术治疗和药物治疗,但是手术治疗存在高风险、易复发等问题,对于无法手术治疗的患者,只能采用药物疗法[3]。阿苯达唑是世界卫生组织首推的包虫药物,但该药物存在生物利用度低、副作用多并缺乏杀虫能力,治疗效果无法令人满意[4],因而亟需筛选和开发新的包虫药物靶点。生物信息学分析技术具有高效率、低成本的特点,在药物靶点、疫苗候选分子等筛选上具有显著的优势,近年来逐渐成为一种热门技术,为包虫病的防治提供了新的研究策略。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种异三聚体复合物,由催化α亚基(α1和α2)、支架β亚基(β1和β2)和调节γ亚基(γ1、γ2和γ3)构成[5]。作为能量稳态的主要调节器,AMPK通过调控葡萄糖和脂肪酸等多种代谢途径以平衡细胞的能量状态,在能量代谢调节方面起到关键性作用[6]。当病毒、细菌或寄生虫等病原体入侵宿主后会对宿主的AMPK产生不同的影响(激活或抑制AMPK),以满足自身的生长发育条件[7-8]。AMPK主要通过3种互补效应激活:上游激酶促进苏氨酸172位点(Thr172)磷酸化;蛋白磷酸酶抑制Thr172去磷酸化;变构激活[9]。而Thr-172位于α-亚基N-末端的丝氨酸/苏氨酸激酶区,该位点的磷酸化是其激酶活性所必需的[10]。因此AMPKα对AMPK活性调节起到了重要作用,是一个潜在的药物靶点。此外,细粒棘球绦虫中存在独立于宿主的AMPK信号通路,这为针对EgAMPK设计专一性的靶向药物提供了可能。但目前对EgAMPKα结构研究较为匮乏,EgAMPKα的药物对接位点鲜有报道。本研究通过生物信息学技术分析了EgAMPKα序列和编码基因的理化特性,构建系统发育树,并通过3D分子对接技术预测了AMPK激动剂对接位点,为理解细粒棘球绦虫的生物学功能及其包虫药物靶点的筛选提供了参考。
1 材料与方法
1.1 序列检索 从NCBI的蛋白质数据库(https://www.ncbi.nlm.nih.gov/protein/)中 获 得EgAMPKα(GenBank:AER10553.1)、EmAMPKα(GenBank ID:AER10552.1)、SmAMPKα(GenBank ID:AZB50365.2)、CsAMPKα2(GenBank ID:GAA51741.1)、CeAMPKα1(GenBank ID:AAR06928.1)、BmAMPKα(GenBank ID:ABQ62953.1)、ClAMPKα1(GenBank ID:PKK20873.1)、SsAMPKα2(GenBank ID:ACL80207.1)、DrAMPKα1(GenBank ID:NP_001103756.1)、MmAMPKα1(Gen-Bank ID:AAW79567.1)、HsAMPKα2(GenBank ID:NP_006243.2)的基因序列。
1.2 EgAMPKα生物信息学分析 利用ProtParam(https://web.expasy.org/protparam/)对细粒棘球绦虫及其模式生物AMPKα的分子量、等电点、不稳定性指数等生理生化特性进行预测[11]。利用ProtScale(https://web.expasy.org/protscale/)预测EgAMPKα亲水性[11]。利 用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测EgAMPKα信号肽[12]。利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预 测 分 析EgAMPKα的跨膜区域[13]。利用Motif Scan(https://my-hits.sib.swiss/cgi-bin/motif_scan)分析EgAMPKα翻译后修饰位点[14]。利用ProtComp 9.0(http://www.softberry.com/berry.phtml? topic=protcompan&group=programs&subgroup=proloc)预 测亚细胞定位[15]。通过CDD数据库(https://www.ncbi.nlm.nih.gov/cdd/?term=)分析EgAMPKα的结构域[16]。通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析EgAMPKα二级结构,并利用DNAStar对EgAMPKα柔性区、表面可及区和抗原指数进行分析[17]。利用Swiss-Model(https://swissmodel.expasy.org/interactive)对EgAMPKα和HsAMPKα2序列进行同源建模。使用Verify 3D(https://servicesn.mbi.ucla.edu/Verify3D/)对EgAMPKα的3D模型进行评估。通过ZICN15数据库(http://zinc.docking.org/)检索获取二甲双胍的3D结构[18],并利用Autodock(Version 4.2.6)软件将EgAMPKα和HsAMPKα2的3D模型通与二甲双胍的3D结构进行分子对接,通过Py-MOL(Version 2.4)软件对对接结果进行三维图显示。使用DNAMAN软件(Version 5.2.2)对EgAMPKα及其同源基因进行多序列比对分析。利用MEGA软件(Version 10.0.5)建立系统发育树。
2 结果
2.1 EgAMPKα的生理生化特征EgAMPKα化学式为C2467H3882N678O687S21,包含478个氨基酸,分子量为54 705.35Da,等电点为8.40,脂肪族氨基酸指数为93.35,不稳定指数是46.48,是一种不稳定亚基。EgAMPKα包含多个亲水性区域,亲水性平均系数为-3.311~2.522,亲水性的总平均值(GRAVY)为-0.225,属于亲水性亚基(表1)。

表1 EgAMPKα及其同源基因的生理生化特征
2.2 EgAMPKα的信号肽和跨膜区域EgAMPKα的信号肽(Sec/SPI)为0.000 4,无信号肽裂解位点,也不存在跨膜区域。
2.3 EgAMPKα的翻译后修饰位点和亚细胞定位EgAMPKα中有3个N端糖基化位点(位于304~307,437~440,450~453氨基酸区段),2个cAMP和cGMP依赖的蛋白激酶磷酸化位点(位于259~262,445~448氨基酸区段),10个酪蛋白激酶II磷酸化位点(位于11~14,89~92,101~104,116~119,129~132,244~247,262~265,290~293,306~309,435-438氨基酸区段),3个N端豆蔻酰化位点(位于37~42,43~48,130~135氨基酸区段),6个蛋白激酶c磷酸化位点(位于4~6,112~114,116~118,190~192,244~246,306~308氨基酸区段)。通过ProtCompv.9.0预测亚细胞定位结果表明EgAMPKα的亚细胞定位分布部位是质膜。
2.4 EgAMPKα结构域 EgAMPKα中存在丝氨酸/苏氨酸蛋白激酶α亚基的催化结构域,位于第17~272氨基酸区段,EgAMPKα的自抑制区域位于第289~343氨基酸区段,在EgAMPKα亚基C-末端发现了负责β/γ连接的结构域,位于第359~476氨基酸区段(图1)。
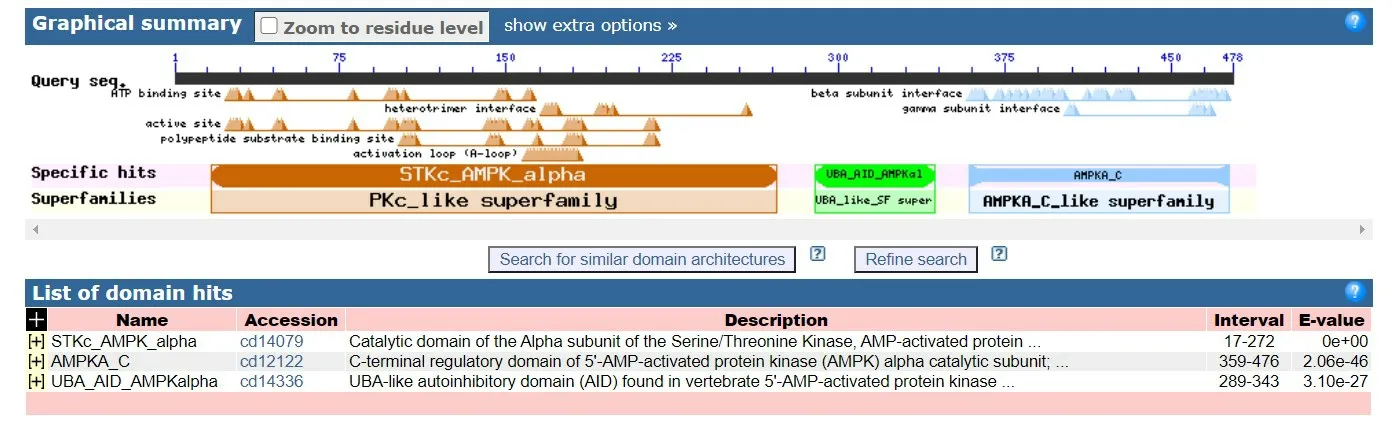
图1 EgAMPKα的保守结构域
2.5 EgAMPKα二级结构 EgAMPKα的二级结构(包括α螺旋,β折叠,β转向和无规卷曲)。EgAMPKα基因序列长度是478,其中α螺旋约占32.85%,β折叠约占17.99%,β转角约占6.90%,无规卷曲约占42.26%(图2)。
2.6 EgAMPKα的B细胞表位预测 EgAMPKα预测了7个具有良好柔韧性、表面可及性和高抗原性指数的区域,分别位于55~59、61~67、110~123、135~142、270~282、320~340、420~440氨基酸区段(图3)。
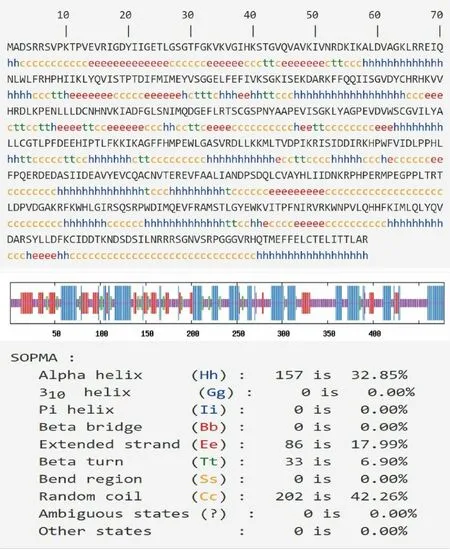
图2 EgAMPKα二级结构预测
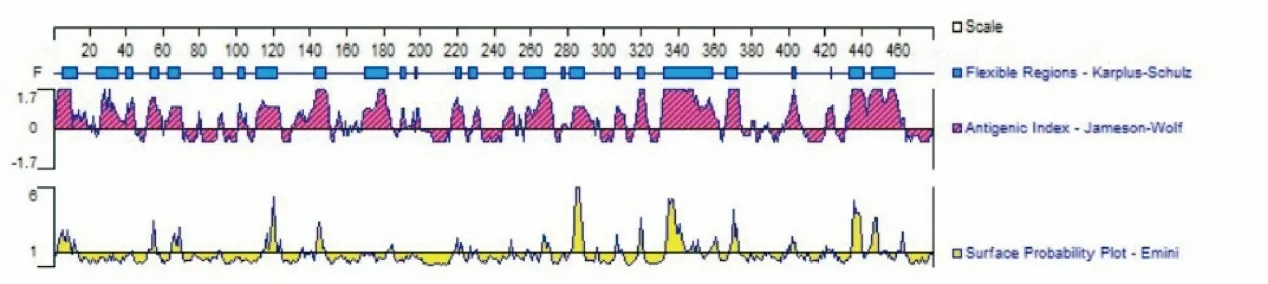
图3 EgAMPKα的B细胞表位预测
2.7 EgAMPKα和HsAMPKα2的同源建模及分子对接研究Swiss-Model服务器构建的EgAMPKα3D结构与模板序列同源性为41.87%,GMQE值为0.53;HsAMPKα2的3D结构与模板序列同源性为41.88%,GMQE值为0.43。EgAMPKα中86.96%的残基3D/1D平均值≥0.2,HsAMPKα2中91.36%的残基3D/1D平均值≥0.2。二甲双胍与HsAMPKα2的结合涉及5个氢键,分别与氨基酸残基ASP-290和GLU-304连接,结合能为-4.18 kcal/mol。二甲双胍与EgAMPKα的结合涉及4个氢键,分别与氨基酸残基GLUT294和GLU298连接,结合能为-4.58 kcal/mol(图4)。

图4二甲双胍与HsAMPKα2、EgAMPKα分子对接
2.8 EgAMPKα及其同源基因的多重序列比对EgAMPKα的催化结构域在所有被比对的物种中较为保守,EgAMPKα(GenBanK ID:AER10553.1)与其同源 基 因(GenBank ID:AER10552.1、AZB50365.2、GAA51741.1、AAR06928.1、ABQ62953.1、PKK20873.1、ACL80207.1、NP_001103756.1、AAW79567.1、NP_006 243.2)的相似性分别为99.79%、81.17%、84.09%、66.99%、66.67%、62.64%、62.78%、62.42%、61.32%、63.00%(图5)。细粒棘球绦虫的AMPKα与多房棘球绦虫的AMPKα具有高度的相似性,而与小鼠和人等哺乳动物序列相似性较低。

图5 EgAMPKα及其同源基因的多重序列比对
2.9 EgAMPKα系统发育树的构建EgAMPKα与多房棘球绦虫(GenBank ID:AER10552.1)、肺吸虫(GenBank ID:KAA3677245.1)、曼氏血吸虫(Gen-Bank ID:AZB50365.2)、华支睾吸虫(GenBank ID:GAA51741.1)、日本血吸虫(GenBank ID:TNN11340.1)的共处一个分支,其中与多房棘球绦虫亲缘关系最近,而与人、小鼠等哺乳动物亲缘关系较远(图6)。
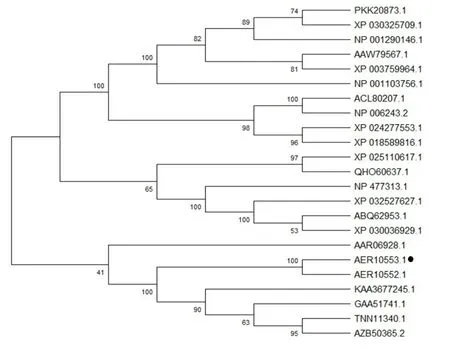
图6 EgAMPKα与其他物种AMPKα的进化树
3 讨论
囊型包虫病极易被忽视,但它却严重威胁生命的人畜共患病,需要加强防治并研发新型治疗途径[19]。已有研究发现,癌细胞通过摄取大量的葡萄糖,通过糖酵解途径以满足自身浸润性、无限制性地增殖[20]。而当葡萄糖含量无法满足癌细胞增殖时,会通过磷酸化AMPKα上的Thr172位点活化AMPK,从而增加下游葡萄糖转运蛋白对葡萄糖的转运[9]。
本课题组在细粒棘球绦虫中发现虫体中存在EgAMPKα,因而对EgAMPKα及其同源基因进行了比对分析。本研究发现EgAMPKα是一个较为保守的基因,与人和小鼠的同源性分别为63.00%和61.32%。EgAMPKα的N端存在一个高度保守的丝氨酸/苏氨酸蛋白激酶α亚基的催化结构域,提示该催化结构域与其他物种的α催化结构有着类似的功能。本研究发现在催化结构域的176位点上存在一个特征性的Thr磷酸化位点,负责对EgAMPKα的活化,这与人类AMPKα1的Thr172位点位置不同。但总的来说,EgAMPK与哺乳动物具有类似的功能结构域,但在亲缘关系和序列相似性上,与多房棘球绦虫的AMPKα具有高度的同源性,而与人和小鼠等哺乳动物的AMPKα存在较大差异。提示可以针对EgAMPKα的基因序列设计特异性的药物分子,靶向寄生虫AMPKα的同时减少对宿主AMPK的影响。
随着生物信息学的发展,基因与小分子化合物相互作用的预测变得尤为重要,评估小分子与治疗靶点结合的亲和力是药物靶点研究的重要组成部分,极大的简化了药物靶点的筛选过程[21]。二甲双胍是一种具有降糖[22]、抗癌[23]和抗寄生虫[24]活性的药物分子。已有研究报道,二甲双胍可以通过作用于线粒体,提高细胞AMP浓度或通过激活AMPK上游激酶,使AMPKα亚基中的Thr-172发生磷酸化从而间接激活AMPK[25]。但二甲双胍与EgAMPKα之间是否存在直接的相互作用尚不清楚。本研究以人类的AMPKα亚基结构作为对照,通过分子对接技术发现,二甲双胍在EgAMPKα和HsAMPKα的自抑制区域中都存在潜在的结合位点,且对EgAMPKα的结合较HsAMPKα2更为紧密,表明二甲双胍对寄生虫的药效较人类宿主可能更为明显。AMPKα的自抑制区域位于α催化结构域和C端β/γ结合结构域中间,呈现出α-螺旋的结构,主要负责对AMPK活性的抑制[26]。已有研究报道,小分子化合物PT1可以通过与人类AMPKα中的自抑制区域结合,从而激活AMPK[27]。提示二甲双胍可以通过与EgAMPKα上的自抑制区域结合,干扰自抑制区域发挥抑制AMPK活化的功能,从而更有利于EgAMPK上游激酶对EgAMPK的活化作用。因此本研究认为EgAMPKa的自抑制区域不仅具有抑制AMPK活性的功能,还可作为一个潜在的包虫药物靶点。
综上所述,本研究通过生物信息学技术分析EgAMPKα的结构与功能,并借助分子对接技术分析药物分子对细粒棘球绦虫与宿主之间可能存在的靶点效应,EgAMPKα有望成为一种新型包虫病药物候选靶点,为包虫病药物开发和靶点筛选上提供了一定理论基础。

