过氧化氢体外诱导细粒棘球绦虫囊泡氧化损伤模型的建立①
文丽梅,巩月红,吕国栋,张嘉伟,王建华
(1新疆医科大学第一附属医院药学部临床药学科,乌鲁木齐830054;2新疆医科大学药学院,乌鲁木齐830011;3省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐830011;4新疆医科大学第一附属医院临床医学研究院,乌鲁木齐830054)
包虫病又称棘球蚴病(echinococcosis)是由棘球绦虫的蚴虫寄生于人体所致的一种严重的人畜共患寄生虫疾病,95%病例为细粒棘球蚴(Echinococcus granulosus,Eg)感染所致囊型包虫病(cystis echinococcosis,CE)。该病呈全球分布,我国西部地区为高流行区,但随着现代社会的发展,人口流动的增加,宠物(犬)和经济动物(狐狸)养殖数量增多,包虫病已从我国的西北部向东南部、由畜牧地区向农业地区等逐渐蔓延,严重影响人类健康,已成为倍受关注的严重公共卫生问题[1-2]。
青蒿素类药物的抗寄生虫作用机制分为[3]:Fe2+依赖的活性氧键断裂后产生的自由基使寄生虫体内活性氧(reactive oxygen species,ROS)含量的升高,导致其死亡;过氧桥键被迅速氧化从而减少虫体内抗氧化剂谷胱甘肽(GSH)/硫氧还蛋白系统的辅助因子,导致GSH不能控制虫体内ROS的产生和ROS的升高。氧化损伤作为抗包虫药物的重要机制之一,目前尚无关于细粒棘球绦虫原头蚴氧化损伤模型的研究。
生理情况下机体存在自动修复的氧化及抗氧化均衡系统。在病理情况下,自由基产生过多抑或体内抗自由基能力不足时,氧化应激发生,机体的氧化还原失衡,随之出现级联式生化反应,导致组织细胞发生氧化损伤[4]。自由基清除剂(FRS)是指具有延迟、抑制和阻断ROS/氧自由基(OFR)氧化损伤的物质的总称,是能够与OFR结合并使之清除的机体保护剂[5]。N-乙酰半胱氨酸(NAC),作为一种新型氧自由基清除剂,可直接发挥抗氧化作用,同时又是谷胱甘肽的前体,它能够提高细胞内还原型谷胱甘肽及过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶等的含量,维持细胞氧化还原平衡以及保护细胞不受氧化损伤、阻止氧化张力诱导的细胞凋亡、从而具有清除自由基和保护细胞作用[6-8]。
本研究通过检测H2O2和NAC干预细粒棘球绦虫囊泡后活性氧含量检测,塌陷率统计和超微结构观察,建立H2O2诱导体外细粒棘球绦虫囊泡氧化损伤模型,为抗包虫病药物氧化损伤作用研究奠定基础。
1 材料与方法
1.1 仪器 二氧化碳恒温细胞培养箱,美国Thermo公司生产;酶标仪,美国Thermo公司生产;湿热灭菌锅,购自日本SANYO公司;SW-CJ-IFD型超净操作台,购自苏州净化设备有限公司;DM1400 B型倒置荧光显微镜,德国Leica公司生产;-80℃冰箱,购自美国Thermo公司;-20℃冰箱(SC-329GA),购自中国海尔公司;激光共聚焦显微镜(SP8),购自德国Leica公司。
1.2 试剂 胎牛血清,购于美国Hyclone公司;青、链霉素和RPMI1640培养基购自于美国Gibco公司;二甲基亚砜(DMSO),购自美国Amresco公司;过氧化氢(H2O2),购自于天津永晟精细化工有限公司;N-乙酰半胱氨酸和活性氧检测试剂盒,均购自于碧云天生物有限公司。
1.3 原头蚴及囊泡培养 羊源细粒棘球蚴原头节无菌取自新疆乌鲁木齐华凌屠宰市场病羊肝包囊,无菌抽取囊液,经清洗、胃蛋白酶处理[9]和活力检测后置37℃、5%CO2恒温培养箱培养。囊泡为细粒棘球绦虫体外培养发育而成,直径2~3 mm。
1.4 方法
1.4.1 H2O2和NAC处理囊泡后活性氧含量检测 取符合实验标准的囊泡按每孔10个接种于96孔培养板中,置37℃,5%CO2培养箱培养48 h。采用终浓度为0、50、100、200μmol/L和400μmol/L的H2O2联合终浓度为0、1、2 mmol/L和5 mmol/L的NAC预先干预2 h囊泡,处理0.5 h后进行活性氧的检测,检测方法按照说明书进行操作。
1.4.2 H2O2和NAC处理囊泡后活性氧观察 取培养的囊泡按每孔10个接种于96孔板中,置37℃,5%CO2培养箱培养48 h。分组设置为1%DMSO组、50μmol/L H2O2组、100μmol/L H2O2组、200μmol/L H2O2组、200 μmol/L H2O2+5 mmol/L NAC组和5 mmol/L NAC组,共6组,其中200μmol/L H2O2+5 mmol/L NAC组和5 mmol/L NAC组,先采用终浓度为5 mmol/L的NAC对细粒棘球绦虫囊泡预先干预2 h,然后进行DMSO和H2O2的干预0.5 h(5 mmol/L NAC组不再做任何处理),收集囊泡。采用DCF-DA(10μmol/L)和Hoechst 33342(10μg/mL)在37℃下避光孵育30 min。孵育后,PBS清洗3遍,采用激光共聚焦显微镜对其体内活性氧进行定性观察,并拍照。
1.4.3 H2O2和NAC干预囊泡后其活性的检测 取培养的囊泡按每孔25个接种于96孔孔培养板中,置37℃,5%CO2培养箱培养48 h。分组为DMSO组、H2O2(200μmol/L)组和H2O2(200μmol/L)+5 mmol/LNAC组,干预4 d,每1 d对囊泡的塌陷情况观察并记录,统计分析塌陷率,活性(%)=(100-塌陷率)%。
1.4.4 H2O2和NAC处理囊泡后超微结构观察 取培养的囊泡按每孔25个接种于96孔板中,置37℃,5%CO2培养箱培养48 h。分组为DMSO组、H2O2(100μmol/L)、H2O2(200μmol/L)和H2O2(200μmol/L)+5 mmol/L NAC(预前2 h),干预0.5 h后,收集囊泡。PBS清洗3遍,将其保存在4%戊二醛混合液中24 h,再依次用双重固定法固定和1%锇酸固定1 h,经脱水、包埋、切片、染色后用透射电镜观察囊泡超微结构变化并拍照。
1.5 统计学分析 应用SPSS19.0软件进行数据的统计分析,计数资料以均数±标准差(-x±s)表示,两组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 细粒棘球绦虫原头蚴和囊泡形态学观察 羊源无菌提取的细粒棘球绦虫原头蚴形态清晰,其中存在大量钙颗粒,见图1A;经体外培养后的囊泡形态饱满,界限明显,见图1B;经药物干预发生损伤的囊泡,见图1C,形态塌陷,界限模糊;图1D和图1E为培养过程中的囊泡。

图1细粒棘球绦虫原头蚴和囊泡形态学观察
2.2 H2O2和NAC对原头蚴体内ROS含量的影响H2O2和NAC处理原头蚴后其体内的ROS含量随着H2O2浓度从50μmol/L增加到400μmol/L,囊泡中的ROS含量逐渐增加。此外,5 mmol/L的NAC可明显抑制H2O2引起的囊泡中ROS含量增多作用。实验结果表明200μmol/L的H2O2可明显增加囊泡体内的ROS含量,且5 mmol/L的NAC可明显抑制其活性ROS的升高,见图2。

图2 H2O2和NAC对囊泡内ROS含量的影响
2.3 采用激光共聚焦显微镜对原头蚴体内ROS的观察 随着H2O2浓度的升高,原头蚴体内的ROS荧光强度逐渐增强,结果表明200μmol/L H2O2组的原头蚴体内ROS含量最高,与5 mmol/L NAC联用后,ROS荧光强度减弱。由此可见,5 mmol/L NAC对H2O2诱导的原头蚴体内的ROS荧光强度有较好的抑制作用,见图3。
2.4 H2O2和NAC对囊泡活性的影响 H2O2干预囊泡2 d后,囊泡活性明显下降,200μM H2O2组的活性降至0%,200μmol/L H2O2+5 mmol/L NAC组的活性为(75.41±4.76)%,5 mmol/L NAC组和空白组的活性均为100%,说明200μmol/L的H2O2可明显造成囊泡的塌陷,而5 mmol/L的NAC可明显抑制H2O2造成的塌陷,见图4。
2.5 H2O2和NAC对原头蚴超微结构的影响DMSO组的合胞体带完整,微绒毛完整,无病变;100μmol/L H2O2组的囊泡合胞体带疏松、扩张,出现水样结构,胞质成分释放较多,出现异染色质;200μmol/L H2O2组合胞体带疏松、扩张,出现水样结构和嗜锇体,胞质成分释放较多,异染色质较多;NAC干预组,合胞体带完整,微绒毛散在,核仁固缩,无异染色质。结果显示:H2O2可损伤囊泡的超微结构,并造成DNA损伤;NAC可缓解H2O2对囊泡造成的损伤。见图5。

图3采用激光共聚焦显微镜对H2O2和NAC干预囊泡后体内ROS的观察
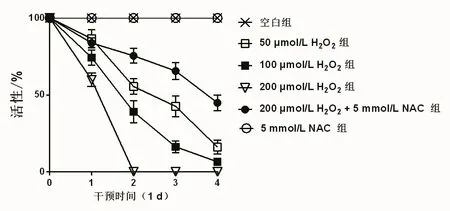
图4 H2O2和NAC对囊泡活性的影响

图5采用电镜对H2O2和NAC干预后囊泡的超微结构观察
3 讨论
本研究显示,随着H2O2含量的升高囊泡体内的ROS含量逐渐升高,其中5mmol/L NAC对H2O2诱导的囊泡体内的ROS含量升高有较好的抑制作用。采用塌陷率对H2O2及H2O2与5 mmol/L NAC联合干预囊泡的药效进行评价,发现与NAC联合干预可以有效改善H2O2单独干预囊泡造成的损伤。同时,采用电镜对药物干预后囊泡的超微结构观察发现H2O2可导致囊泡体内异染色质的增多,说明其可能对囊泡的DNA造成损伤。文献[10]报道,金属离子参与DNA氧化损伤,其作用大小主要取决于金属活化H2O2的能力(Fenton反应)和金属离子与DNA分子的亲和力,这与本研究结果一致。然而,NAC干预组,合胞体带完整,微绒毛散在,核仁固缩,无异染色质,NAC可明显改善H2O2对囊泡超微结构造成的损伤。采用激光共聚焦对囊泡内的ROS分布量进行观察,其结果以ROS含量检测结果一致。
H2O2是一种重要的ROS,非常容易穿过细胞膜并与细胞内的Fe2+通过Fenton反应形成高活性的自由基(·OH),导致一系列反应。因H2O2容易获得,性质相对稳定,操作比较简单,所以是目前应用最为广泛的氧化损伤模型的应激源,是研究各类细胞氧化损伤时使用的主要方法之一[11]。然而,以H2O2为刺激源诱导建立细胞氧化应激模型的方法在医学领域应用较多,但关于建立细粒棘球绦虫囊泡的氧化应激损伤模型的报道极少,且判别标准不完全相同。本研究采用检测囊泡塌陷率作为判定囊泡活性检测指标,同时,采用活性氧检测试剂盒直接对H2O2和NAC干预原头蚴后体内的ROS含量进行检测。
综上所示,H2O2可诱导细粒棘球绦虫囊泡氧化应激模型的建立,且NAC可有效抑制H2O2诱导的氧化应激,为抗包虫病药物氧化损伤作用研究的重要抑制剂之一。本研究发现H2O2可能损害囊泡的DNA,需要后续实验进一步证实。

