类风湿关节炎滑膜成纤维细胞增殖及巨自噬的表达水平
邵鑫 蒋先虹 王瑞 蒲强红 刘福

【摘 要】目的:探討体外原代培养的类风湿关节炎滑膜成纤维细胞(RA-FLS)中是否存在巨自噬现象以及在类风湿关节炎(RA)中的发病机制。方法:培养原代RA-FLS,以骨关节炎(OA)患者膝关节滑膜组织中培养的骨关节炎滑膜成纤维细胞(OA-FLS)作为对照组。采用MTT法检测细胞增殖活力;流式细胞仪检测细胞凋亡;采用实时荧光定量聚合酶链反应(RT-qPCR)、蛋白免疫印迹法(Western Blot)分别检测2组细胞中巨自噬标志性因子LC3、P62 mRNA及蛋白的相对表达水平,激光共聚焦显微镜检测LC3、P62蛋白的表达。结果:从患者膝关节滑膜组织中成功分离、培养出RA-FLS与OA-FLS,MTT结果显示,RA-FLS增殖活力明显强于OA-FLS;流式细胞仪结果显示,RA-FLS的细胞凋亡减少;RT-qPCR、Western Blot结果表明,RA-FLS与OA-FLS相比,LC3 mRNA及蛋白的相对表达水平升高、P62 mRNA及蛋白的相对表达水平降低,差异均有统计学意义(P < 0.05);激光共聚焦显微镜结果显示,RA-FLS中LC3表达更高,P62表达更低。结论:RA-FLS中LC3 mRNA及蛋白的相对表达水平明显增高,P62 mRNA及蛋白的相对表达水平显著降低,提示RA中巨自噬水平活化,这可能是导致RA-FLS出现凋亡抵抗,增殖活性明显高于OA-FLS的潜在原因。
【关键词】 关节炎,类风湿;骨关节炎;滑膜成纤维细胞;巨自噬;LC3;P62
Proliferation and Expression of Macroautophagy in Synovial Fibroblasts of Rheumatoid Arthritis
SHAO Xin,JIANG Xian-hong,WANG Rui,PU Qiang-hong,LIU Fu
【ABSTRACT】Objective:To investigate the existence of macroautophagy in rheumatoid arthritis synovial fibroblasts(RA-FLS)in vitro and its pathogenesis.Methods:Primary RA-FLS were cultured,and OA-FLS were used as a control group.MTT was used to detect cell proliferation activity;flow cytometry was used to detect cell apoptosis;RT-qPCR and Western Blot were used to detect the relative expression levels of LC3,P62 mRNA and protein in the two groups;and laser confocal microscopy was used to detect the expression levels of LC3 and P62.Results:RA-FLS and OA-FLS were successfully isolated and cultured from synovial tissue of knee joint.MTT results showed that the proliferation activity of RA-FLS was significantly stronger than that of OA-FLS.Flow cytometry results showed that the apoptosis of RA-FLS was reduced;RT-qPCR and Western Blot results showed that compared with OA-FLS,the relative expression levels of LC3 mRNA and protein of RA-FLS were higher,and P62 protein of RA-FLS was lower.The difference was statistically significant(P < 0.05).Laser confocal microscopy showed that LC3 expression was higher and P62 expression was lower in RA-FLS.Conclusion:The relative expression levels of LC3 mRNA and protein in RA-FLS were significantly increased,while the relative expression levels of P62 mRNA and protein in RA-FLS were significantly decreased,suggesting that the level of macroautophagy was activated in RA,which may be the potential reason for the apoptosis resistance and proliferation activity of RA-FLS being significantly higher than those of OA-FLS.
【Keywords】 arthritis,rheumatoid;osteoarthritis;synovial fibroblasts;macroautophagy;LC3;P62
类风湿关节炎(rheumatoid arthritis,RA)主要病理特征为滑膜增生、血管翳形成及软骨破坏,最终可致残疾和死亡。国内调查结果显示,RA等关节疾病和脑血管病是我国两大主要致残原因[1]。近年来,随着对本病认识的加深和新治疗方法的出现,其预后得到明显的改善,但总预后仍不容乐观,RA的发病机制至今仍未完全明确[2]。巨自噬过程在自身免疫性疾病中的作用逐渐成为研究热点,大量研究表明巨自噬在RA发病机制、病程进展中占有关键性地位[3]。类风湿关节炎滑膜成纤维细胞(RA-FLS)是一种以肿瘤样方式异常增殖的细胞,细胞活性增强,凋亡减少,导致滑膜异常增生,这在RA的发病机理中起关键作用[4]。巨自噬通过形成双膜囊泡(称为自噬体)而发生,是一个“自食”过程,该过程中有一系列自噬相关蛋白共同参与周密调控,此过程维持了细胞内环境的稳态平衡[5]。近年来,巨自噬在RA中发挥的作用受到广泛关注,有研究发现,巨自噬与RA的发病相关,并对其机制进行探索[6]。通常情况下,自噬是在应激条件下促进细胞存活的一种调节方式[7]。本研究检测巨自噬标志性因子P62、LC3在RA-FLS中的表达水平,初步探讨RA的发病机制。
1 实验材料
1.1 对象与资料 收集川北医学院附属医院骨科住院部RA患者的膝关节滑膜组织,培养原代RA-FLS。同时收集骨关节炎(osteoarthritis,OA)患者的膝关节滑膜组织,分离、培养原代骨关节炎滑膜成纤维细胞(OA-FLS)作为对照。本研究获得川北医学院附属医院伦理委员会批准,所有受试者均知情并同意参与。
1.2 主要仪器 倒置显微镜(上海OLYMPUS公司);超微量紫外分光光度计(北京五洲东方科技发展有限公司);全波长全自动酶标仪(瑞士Tecan公司);LightCycler96实时荧光定量PCR仪(瑞士罗氏公司);凝胶成像系统(法国Vilber Lourmat公司);脱色摇床(海门市其林贝尔仪器制造有限公司)。
1.3 主要试剂 胎牛血清、DMEM培养基(美国Gibco公司);青链霉素(美国Hyclone公司);Ⅱ型胶原酶(美国Sigma公司);MTT(上海碧云天生物科技有限公司);PCR引物合成(生工生物工程上海股份有限公司);RIPA蛋白裂解液、苯甲基磺酰氟(北京索莱宝科技有限公司);一抗稀释液(上海碧云天生物科技有限公司);Trizol(美国Ambion公司);逆转录试剂盒(德国QIAGEN公司);脱脂奶粉(北京索莱宝科技有限公司);PVDF膜(美国Cell Signaling Technology公司);鼠抗人β-actin单克隆抗体(成都ZenBioScience公司);兔抗人LC3单克隆抗体、兔抗人P62单克隆抗体(美国Cell Signaling Technology公司);辣根过氧化物酶标记的兔抗、辣根过氧化物酶标记的鼠抗(成都ZenBioScience公司);BCA蛋白浓度测定试剂盒(美国Thermo Fisher公司);FITC标记的兔抗、TRITC标记的兔抗(成都ZenBioScience公司);Annexin V / FITC凋亡检测试剂盒(南京凯基生物科技有限公司)。
2 方 法
2.1 原代细胞培养 RA与OA患者的滑膜组织取出后,立即放入无菌磷酸盐缓冲盐水(PBS)中带入超净工作台,用无菌剪剪成1 mm3体积的小块,加入3倍体积4 mg·mL-1的Ⅱ型胶原酶,放入37 ℃孵箱中消化4 h,过200目无菌筛网,转移到25 cm2培养瓶中培养。取第3~7代较纯的RA-FLS与OA-FLS用于后续实验研究。
2.2 MTT法检测细胞活力 取对数生长期细胞RA-FLS与OA-FLS,消化离心后用完全培养基调整细胞悬液密度至2×104个·mL-1,每孔接种100 μL
于96孔板,时间梯度为1,2,3,4,5,6,7 d。另设空白对照组(无细胞组)扣除背景影响,每组设置6个复孔,四周用PBS补充,防止加样孔液体挥发过快导致差异;过夜待细胞贴壁成形后弃去原培养基,按时间梯度分别检测细胞的增殖活力,未检测孔每隔3 d换液1次;每孔加入5 mg·mL-1的MTT溶液20 μL,置孵箱中继续孵育4 h;弃液,每孔加入DMSO溶液150 μL,避光溶解10 min;用酶标仪测定各孔在570 nm波长处的吸光度(OD值)。细胞增殖活力(%)=[(给药组细胞OD值-空白组OD值)/(对照组细胞OD值-空白组OD值)]×100%。
2.3 流式细胞仪检测细胞凋亡 取对数生长期细胞RA-FLS与OA-FLS,消化离心后用完全培养基调整细胞悬液密度至1×105个·mL-1,接种于6孔板中,每孔2 mL。过夜待细胞贴壁,用PBS洗涤后收集细胞,加入标记荧光素AnnexinV-FITC 5 μL混匀后,加入PI染色试剂5 μL,混匀后室温避光反应5 min,流式细胞仪检测细胞凋亡率。
2.4 实时荧光定量PCR检测LC3、P62 mRNA的表达水平 细胞接种同2.3,用Trizol试剂提取细胞总RNA,紫外分光光度计检测RNA浓度。根据RNA浓度检测的结果,将RNA逆转录成cDNA,根据试剂说明进行实时定量PCR反应。PCR扩增程序:95 ℃预变性30 s;95 ℃反应5 s,60 ℃反应30 s,72 ℃反应20 s,40个循环。△△CT=△CT[CT(对照组目的基因)-CT(对照组内参基因)]-△CT[CT(实验组目的基因)-CT(实验组内参基因)]。内参β-actin和目的基因序列見表1。
2.5 Western Blot检测LC3、P62蛋白的表达水平 细胞接种及处理同2.3、2.4,用蛋白裂解液充分裂解细胞中的蛋白至少30 min,BSA法测定蛋白浓度,金属浴95 ℃变性蛋白10 min,然后进行SDS-PAGE蛋白凝胶电泳,转膜,5%脱脂奶粉封闭,孵育一抗,孵育二抗,显影成像,结果用IMage J分析。
2.6 统计学方法 采用GraphPad Prism 6软件进行统计分析。计量资料以表示,组间比较采用独立样本t检验。以P < 0.05为差异有统计学意义。
3 结 果
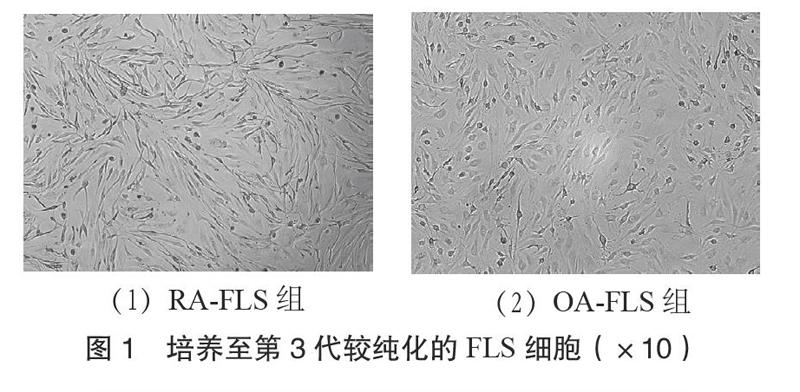
3.1 MTT检测结果 倒置显微镜下分别观察
RA-FLS与OA-FLS的细胞形态,原代滑膜细胞簇集生长,传至第3代后细胞较纯,分散式生长,均为长梭形,可见RA-FLS比OA-FLS更为细长。见图1。MTT结果显示,RA-FLS在1~3 d时生长速度最快,5~7 d基本达到增殖平衡,OA-FLS细胞生长速度明显低于RA-FLS。见图2。
3.2 流式细胞仪检测结果 流式细胞仪检测结果显示,RA-FLS组凋亡率为(6.4700±1.8474)%,OA-FLS组为(11.7500±1.3452)%,2组比较,差异有统计学意义(P < 0.05)。
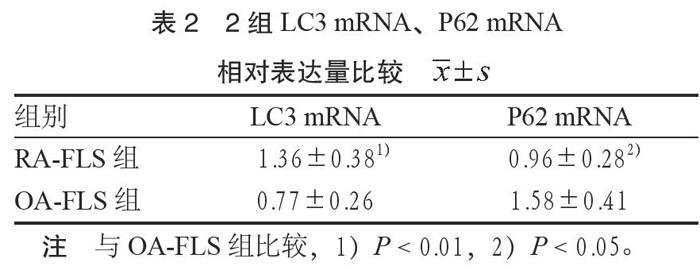
3.3 RT-qPCR结果 RA-FLS与OA-FLS均存在LC3 mRNA、P62 mRNA的表达,RT-qPCR结果显示,RA-FLS组LC3 mRNA的相对表达量显著高于OA-FLS组(P < 0.05);RA-FLS组P62 mRNA的相对表达量明显低于OA-FLS组(P < 0.05)。见表2。
3.4 Western Blot结果 RA-FLS与OA-FLS均存在LC3蛋白、P62蛋白的表达,Western Blot结果显示,RA-FLS组LC3-Ⅱ蛋白的相对表达量明显低于OA-FLS组(P < 0.05);RA-FLS组P62蛋白的相对表达量显著高于OA-FLS组(P < 0.05)。见表3。
3.5 激光共聚焦檢测结果 激光共聚焦检测结果显示,DAPI蓝色荧光代表细胞核,FITC绿色荧光代表LC3蛋白,TRITC红色荧光代表P62蛋白。与OA-FLS比较,RA-FLS中LC3绿色荧光斑点明显增多,P62红色荧光斑点减少,表明自噬途径被激活。见图3。
4 讨 论
位于滑膜内膜层的RA-FLS通过产生肿瘤坏死因子-α、白细胞介素(IL)-1β、IL-6和IL-8等细胞因子和有助于软骨破坏的蛋白酶在RA中起关键作用[8]。此外,RA-FLS参与了骨侵蚀性血管翳的形成和关节的血管新生,这些均与RA-FLS的快速增殖、凋亡减少密切相关[8]。不同RA患者的病情不同,经处理后的细胞株不足以说明RA患者体内的实际病理情况,以原代分离培养的
RA-FLS作为实验对象更具有代表性,本研究通过Ⅱ型胶原酶消化法成功从患者滑膜组织中培养原代滑膜细胞[9]。笔者首先通过MTT检测到RA-FLS的细胞增殖活力显著强于OA-FLS,这与SUN等[10-11]的研究结果一致,提示直接靶向RA-FLS是改善RA疾病进程的一种可靠思路。流式细胞仪检测结果表明,与OA-FLS相比,RA-FLS出现凋亡抵抗。
接着,本研究进一步发现,LC3、P62 mRNA的表达在RA-FLS中显著增加。LC3常被作为巨自噬的标志性因子,P62中LIR结构域负责识别并与自噬受体蛋白LC3结合,保证了巨自噬的正常进行。巨自噬是溶酶体吞噬和降解胞浆内含物的过程[12]。巨自噬的启动受Unc51样激酶1复合物的调控[13],其中最关键的步骤是通过微管LC3与磷脂酰乙醇胺的缀合形成自噬体[14]。LC3被半胱氨酸蛋白酶Atg4裂解以产生胞质形式的LC3-Ⅰ,在被Atg7激活后,被转移到Atg3,以便与藻红蛋白的缀合物形式被改变,称为LC3-Ⅱ,LC3-Ⅱ是测试自噬活性的最常用标记[15]。进一步通过SDS-PAGE和免疫印迹分析后发现,在RA-FLS与OA-FLS中均检测到LC3-Ⅰ及LC3-Ⅱ蛋白,LC3-Ⅱ的数量与自噬小体的数量密切相关,可作为自噬小体形成的良好指标[16-17],在RA-FLS中LC3-Ⅱ蛋白的相对表达明显多于OA-FLS,预示RA-FLS中自噬小体形成增多。自噬体形成后,通过将P62结合的泛素化底物掺入自噬体中,然后降解为自溶体,P62水平被自噬选择性降解,并作为自噬通量的读数[18]。因此,LC3-Ⅱ水平的增加、P62水平的降低反映了自噬的激活[19]。先前的报道还显示,RA或关节炎患者的FLS自噬增加,FLS自噬途径持续活化[20-22]。本研究显示,RA-FLS中P62 mRNA及蛋白相对表达水平均低于OA-FLS,自噬体形成增加和P62水平降低的组合提示RA中自噬激活;激光共聚焦结果同样表明,RA-FLS中LC3蛋白明显增多,P62蛋白明显减少,表明RA-FLS中自噬的激活可能是引起其凋亡减少、活性增强的重要因素之一。YANG等[23]也同样证明了RA-FLS中LC3-Ⅱ的表达上调以及P62表达的降低,表明RA中巨自噬的激活。
综上所述,RA-FLS中LC3 mRNA及蛋白的相对表达水平明显增高,P62 mRNA及蛋白的相对表达水平显著降低,提示RA中巨自噬水平活化,这可能是导致RA-FLS出现凋亡抵抗,增殖活性明显高于OA-FLS的潜在原因,从自噬着手治疗RA,控制滑膜组织异常增生可能是有效的方案。
参考文献
[1] ORMSETH SR,DRAPER TL,IRWIN MR,et al.Multidimensional model of disability and role functioning in rheumatoid arthritis[J].Arthritis Care Res (Hoboken),2015,67(12):1686-1692.
[2] URMAN A,TAKLALSINGH N,SORRENTO C,et al.Inflammation beyond the joints:rheumatoid arthritis and cardiovascular disease[J].Scifed J Cardiol,2018,2(3):1000019.
[3] ZHU L,WANG HZH,WU Y,et al.The autophagy level is increased in the synovial tissues of patients with active rheumatoid arthritis and is correlated with disease severity[J].Mediators Inflamm,2017(1):7623145.
[4] GANESAN R,RASOOL M.Fibroblast-like synoviocytes-dependent effector molecules as a critical mediator for rheumatoid arthritis:Current status and future directions[J].Int Rev Immunol,2017,36(1):20-30.
[5] YIN Z,PASCUAL C,KLIONSKY DJ.Autophagy:machinery and regulation[J].Microb Cell,2016,3(12):588-596.
[6] FAN T,ZHANG C,ZONG M,et al.Hypoxia-induced autophagy is inhibited by PADI4 knockdown,which promotes apoptosis of fibroblast-like synoviocytes in rheumatoid arthritis[J].Mol Med Rep,2018,17(4):5116-5124.
[7] FU YF,LIU X,GAO M,et al.Endoplasmic reticulum stress induces autophagy and apoptosis while inhibiting proliferation and drug resistance in multiple myeloma through the PI3K/Akt/mTOR signaling pathway[J].Oncotarget,2017,8(37):61093-61106.
[8] BARTOK B,FIRESTEIN GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233-255.
[9] 洪永桃.自噬在類风湿关节炎滑膜成纤维细胞中的作用及甲氨蝶呤对自噬的影响[D].南充:川北医学院,2015.
[10] SUN Y,SUN XH,LIU ZX,et al.MiR-338-5p suppresses rheumatoid arthritis synovial fibroblast proliferation and invasion by targeting ADAMTS-9[J].Clin Exp Rheumatol,2018,36(2):195-202.
[11] GUO JL,DU J,FEI D,et al.miR152 inhibits rheumatoid arthritis synovial fibroblast proliferation and induces apoptosis by targeting ADAM10[J].Int J Mol Med,2018,42(1):643-650.
[12] MIZUSHIMA N.Autophagy:process and function[J].Genes Dev,2007,21(22):2861-2873.
[13] CAO Y,KLIONSKY DJ.Physiological functions of Atg6/Beclin 1:a unique autophagy-related protein[J].Cell Res,2007,17(10):839-849.
[14] MIZUSHIMA N,KOMATSU M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[15] VOMERO M,BARBATI C,COLASANTI T,et al.Autophagy and rheumatoid arthritis:current knowledges and future perspectives[J].Front Immunol,2018,18(9):1577.
[16] KABEYA Y,MIZUSHIMA N,UENO T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[17] MIZUSHIMA N,YOSHIMORI T.How to interpret LC3 immunoblotting[J].Autophagy,2007,3(6):542-545.
[18] ICHIMURA Y,KOMINAMI E,TANAKA K,et al.Selective turnover of p62/A170/SQSTM1 by autophagy[J].Autophagy,2008,4(8):1063-1066.
[19] KOMATSU M,WAGURI S,KOIKE M,et al.Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice[J].Cell,2007,131(6):1149-1163.
[20] YANG R,ZHANG Y,WANG L,et al.Increased autophagy in fibroblast-like synoviocytes leads to immune enhancement potential in rheumatoid arthritis[J].Oncotarget,2017,8(9):15420-15430.
[21] XU K,XU P,YAO JF,et al.Reduced apoptosis correlates with enhanced autophagy in synovial tissues of rheuma-toid arthritis[J].Inflamm Res,2013,62(2):229-237.
[22] SHIN YJ,HAN SH,KIM DS,et al.Autophagy induction and CHOP under-expression promotes survival of fibroblasts from rheumatoid arthritis patients under endoplasmic reticulum stress[J].Arthritis Res Ther,2010,12(1):R19.
[23] YANG R,ZHANG Y,WANG L,et al.Increased autophagy in fibroblast-like synoviocytes leads to immune enhancement potential in rheumatoid arthritis[J].Oncotarget,2017,8(9):15420-15430.
收稿日期:2020-09-14;修回日期:2020-10-30
基金項目:四川省卫计委项目基金(18ZD009)
作者单位:1.乐山市人民医院,四川 乐山 614000;2.川北医学院附属医院,四川 南充 637000
通信作者:刘福 四川省南充市顺庆区文化路63号,nslf91@163.com,13890760097