基于网络药理学的肉桂治疗腰椎间盘突出症分子机制研究
海云翔 宋敏 杨秀娟 田杰祥
【摘 要】目的:利用網络药理学方法探究肉桂治疗腰椎间盘突出症的分子作用机制及关键靶点。
方法:从药物和疾病两个角度出发,通过TCMSP、TCMID数据库收集肉桂化学成分,根据阈值筛选有效活性成分并预测其作用靶点,构建“肉桂活性成分-靶点”网络。GenCards、OMIM数据库检索腰椎间盘突出症相关基因,建立“疾病-靶点”网络,将药物靶点与疾病靶点相互映射,并对映射所得到的关键靶点进行DAVID分析,构建“成分-靶点-通路”网络图。结果:获得肉桂主要化学成分105个,筛选去重汇总后得到15个有效活性成分及药物靶蛋白74个;腰椎间盘突出症相关基因309个,药物靶点与疾病靶点映射后获得尿激酶型纤溶酶原激活剂、前列腺素内过氧化物合酶、超氧化物歧化酶1等8个共有靶点。GO富集分析确定了13个条目,主要包括细胞外区域、细胞外间隙等细胞成分,蛋白同源二聚化活动、蛋白结合等分子功能,一氧化氮生物合成过程的正调控、细胞对三磷酸腺苷的反应、细胞迁移正调控等生物过程。KEGG通路富集分析确定了4条相关信号通路,主要有核转录因子-κB信号通路、脂肪细胞脂解调节信号通路等,涉及炎症、代谢、免疫等。结论:肉桂通过多途径、多靶点发挥治疗腰椎间盘突出症的作用,该研究初步探讨了其作用所涉及的关键靶点、生物学过程及信号通路,为进一步开展肉桂治疗腰椎间盘突出症的分子生物学实验验证提供了参考和依据。
【关键词】 腰椎间盘突出症;网络药理学;肉桂;分子机制;信号通路
Molecular Mechanism of Cinnamon Bark in the Treatment of Lumbar Disc Herniation Based on Network Pharmacology
HAI Yun-xiang,SONG Min,YANG Xiu-juan,TIAN Jie-xiang
【ABSTRACT】Objective:To explore the molecular mechanism and key targets of cinnamon bark in the treatment of lumbar disc herniation by network pharmacology.Methods:From the perspectives of drugs and diseases,the chemical components of cinnamon bark were collected through databases TCMSP and TCMID,and the active components were screened according to the threshold value and their targets were predicted to construct the "cinnamon active components-target" network.Databases GenCards and OMIM were used to search the genes related to lumbar disc herniation to establish the "disease-target" network,mapping the drug targets and disease targets,and conducting DAVID analysis on the key targets obtained from the mapping to construct the "component-target-pathway" network.Results:One hundred and five main chemical components of cinnamon bark were obtained,15 active components and 74 drug target proteins were obtained after screening,309 genes related to lumbar disc herniation were obtained,and 8 common targets including urokinase type plasminogen activator,prostaglandin endoperoxidase and superoxide dismutase 1 were obtained after mapping drug targets and disease targets.Thirteen items were identified by GO enrichment analysis,mainly including cellular components such as extracellular region and extracellular space,molecular functions such as protein homodimerization,protein binding,positive regulation of nitric oxide biosynthesis,cell response to adenosine triphosphate,and positive regulation of cell migration.KEGG pathway enrichment analysis identified four related signaling pathways,including nuclear factor-κB signaling pathway,adipocyte lipolysis regulation signaling pathway,involving inflammation,metabolism,immunity and so on.
Conclusion:Cinnamon bark can play a role in the treatment of lumbar disc herniation through multiple ways and targets.This study preliminarily discussed the key targets,biological processes and signal pathways involved in its role,and provided reference and basis for further molecular biological experimental verification of cinnamon bark in the treatment of lumbar disc herniation.
【Keywords】 lumbar disc herniation;network pharmacology;cinnamon bark;molecular mechanism;signaling pathway
腰椎间盘突出症(lumbar disc herniation,LDH)是由各种原因导致的椎间盘退行性变,在外力因素下,以纤维环破裂、髓核从破裂口突出,刺激和压迫马尾神经、腰神经根、坐骨神经而引起腰腿疼痛的临床综合征[1]。LDH为骨科常見病、多发病,是引起腰腿痛的最主要原因。研究统计,LDH好发于0~50岁人群,其中男女比例约为2∶1,在25~55岁人群中,95%的LDH发生在L4~5和L5~S1水平[2]。本病除与年龄增长退行性病变的发生相关外,还与性别、体质量、职业、生活习惯等因素密切相关[3]。LDH属中医学“腰痛”“腰腿痛”“痹证”范畴。《素问·脉要精微论篇》云:“腰者肾之府,转摇不能,肾将惫矣。”《诸病源候论》云:“肝主筋而藏血,肾主骨而生髓。”可见LDH的发生与“肾”有着密不可分的关系[4-5]。西医学对LDH的发病机制主要以机械压迫学说、化学炎症反应学说及自身免疫学说为主[6]。
肉桂为樟科植物肉桂(Cinnamomum cassia Presl)的干燥树皮,其性大热,味辛、甘,归肾、脾、心、肝经,具有补火助阳、散寒止痛、温通筋脉、引火归元之效[7],临床治疗LDH多以肾阳虚寒、寒凝血瘀等证为主,正如《本草纲目》记载肉桂“坚筋骨,通血脉,宜导百药”。由于肉桂成分复杂,其治疗LDH涉及机体调控网络中多个生物过程和信号通路,单个成分对应单个基因的研究方法已不适合阐明肉桂治疗LDH的分子机制。因此,本研究基于网络药理学方法,通过建立活性成分-靶点-疾病的复杂可视化网络,从而以多成分、多靶点角度阐释肉桂治疗LDH的分子机制,为进一步开展肉桂治疗LDH的分子生物学实验验证提供参考和依据[8]。
1 资料与方法
1.1 软件与数据库 使用中药系统药理学数据库和分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmspsearch.php)、中药综合数据库(TCMID,http://www.Megabionet.org/ tcmid/)收集肉桂化学成分;孟德尔疾病基因数据库(OMIM,http:// www.omim.org/about)、人类基因数据库(Gene Cards,http://www.Genecards.Org/)收集LDH相关基因;Venny 2.1(http://bioinformatics.psb.ugent.be/cg-bin/liste/Venn/calculate_venn.htpl)软件绘制“成分-靶点、疾病-靶点”韦恩图,找出映射;采用DAVID数据库(https://david.ncifcr f.gov/)对获得的共有靶点进行基因本体论(GO)功能富集分析、京都基因与基因组百科全书(KEGG)通路富集分析;Cytoscape 3.5.1软件构建网络及数据分析。
1.2 肉桂主要化学活性成分筛选及靶点预测 TCSMP、TCMID数据库搜集获得肉桂所有化学成分,数据库使用时间截止到2019年11月。以口服生物利用度(OB)≥30%、类药性指数(DL)≥0.08两项指标[9]作为筛选阈值并结合文献报道确定最终药物活性成分,后对有效活性成分所对应的潜在靶蛋白进行逐一搜集,在Unipot数据库上对蛋白名称进行标准化处理,选择物种为“homo sapiens”,得到药物对应的潜在靶点。
1.3 LDH疾病相关靶点获取 以“lumber disc herniation”为检索词在GeneCards数据库及OMIM数据库中检索得到LDH疾病相关基因,对搜集到的疾病靶点处理、去重后,得到LDH相关靶点[10-11]。
1.4 肉桂治疗LDH的网络构建及分析 利用Venny网站将药物-靶点与疾病-靶点进行映射,绘制韦恩图并得到肉桂治疗LDH的作用靶点。运用Cytoscape3.5.1软件构建“药物活性成分-靶点”的可视化网络图。
1.5 生物功能与通路富集分析 利用人类基因组注释数据库DAVID将获取的肉桂治疗LDH的潜在靶点进行GO功能富集分析和KEGG通路富集分析,从而探讨肉桂治疗LDH的生物过程及相关信号通路。
2 结 果
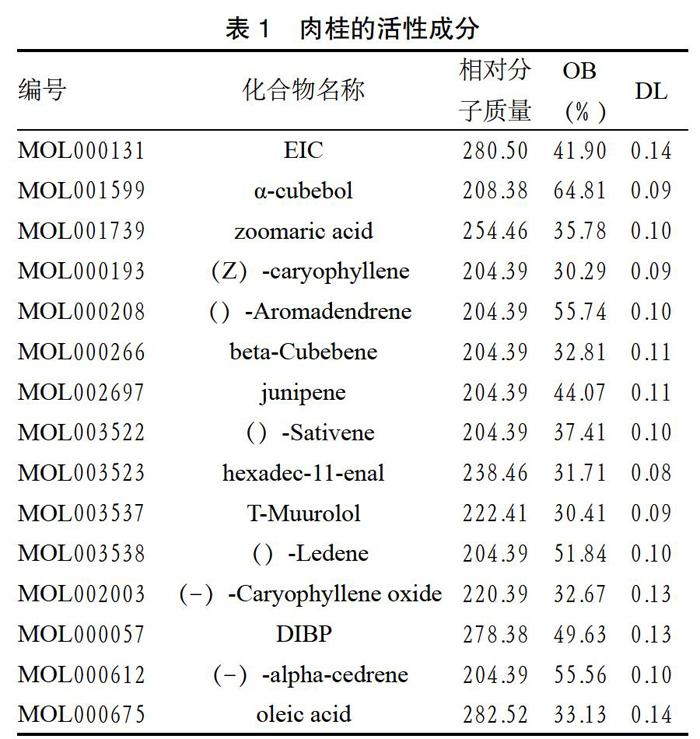
2.1 肉桂主要活性成分 经收集整理,共获得肉桂化学成分105个。以OB≥30%、DL≥0.08作为标准筛选并结合文献报道最终确定15个肉桂主要活性成分。见表1。
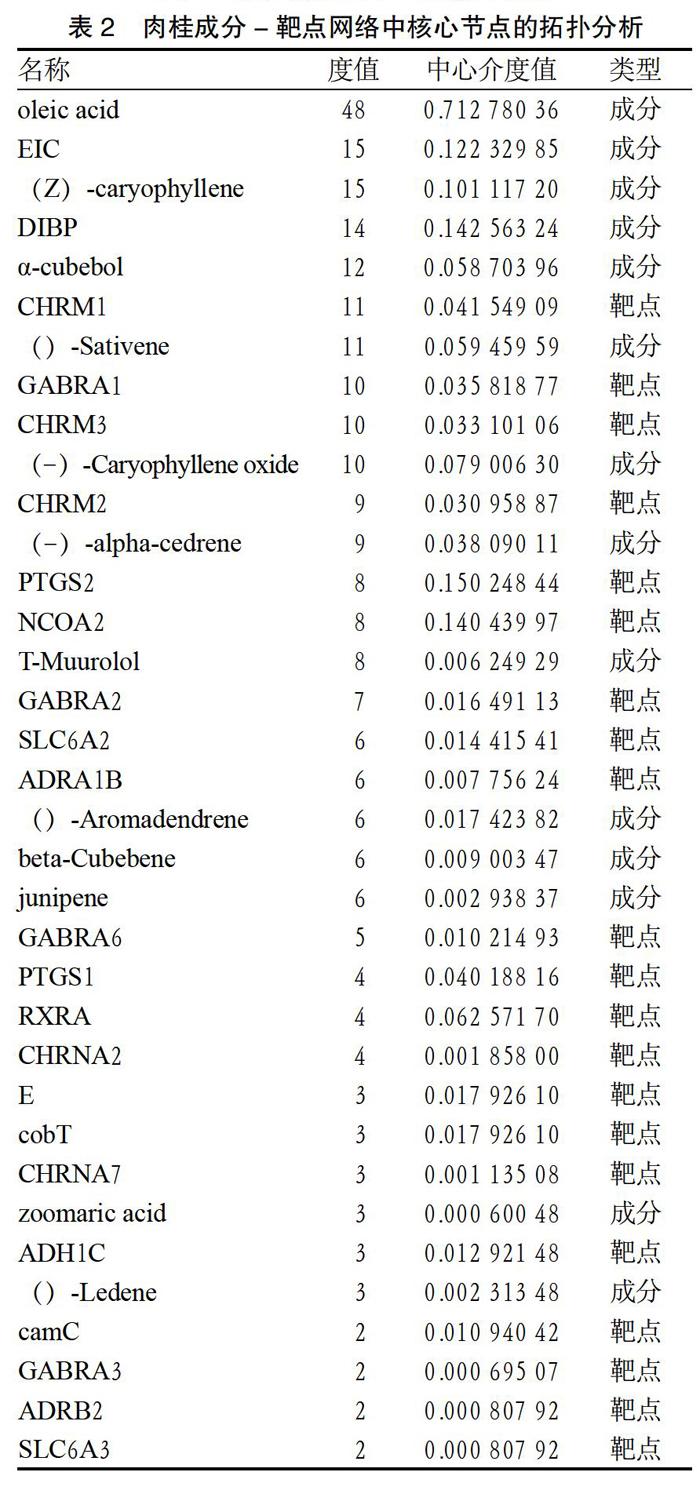
2.2 构建肉桂活性成分-靶点网络 利用TCMSP检索肉桂15个活性成分,共获得166个药物作用靶点(hexadec-11-enal无对应靶点),经去重及Unipot数据库标准化处理后得到74个有效作用靶点。将活性成分、有效作用靶点导入Cytoscape网络可视化软件,构建肉桂活性成分-靶点网络。结果显示,在成分-靶点网络中,共有88个节点(14个中药活性成分节点和74个作用靶点节点),166条边,其中,红色节点代表肉桂活性成分,蓝色节点表示药物作用靶点,见图1、表2。结果表明,肉桂活性成分中油酸可作用于48个靶点。对于化合物作用的靶点,程度最高的为毒蕈碱型乙酰胆碱受体M1(CHRM1),与11个化学成分相关,其次为γ-氨基丁酸受体亚基α-1(GABRA1),与10个化学成分相关。
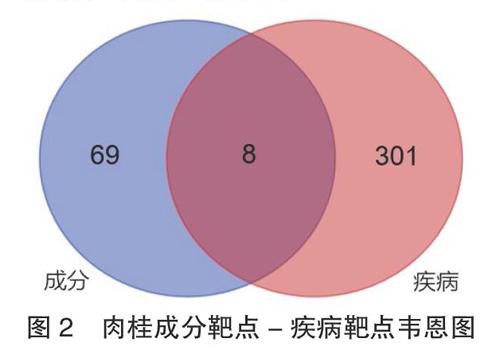
2.3 肉桂治疗LDH的潜在靶点 通过Gene Cards、OMIM等数据库共得到LDH相关靶点309个,采用韦恩图将药物预测所得74个靶点与疾病对应309个靶点进行映射,最终得到尿激酶型纤溶酶原激活剂(PLAU)、胰岛素(INS)、5-羟色胺转运体SLC6A4基因、前列腺素内过氧化物合酶2(PTGS2)、超氧化物歧化酶1(SOD1)、脑源性神经营养因子(BDNF)、生长相关蛋白43(GAP43)、乙酰胆碱(ACHE)等8个肉桂作用于LDH的潜在靶点。见图2。
2.4 肉桂治疗LDH关键靶点的GO功能富集分析 将2.3中肉桂作用于LDH的8个潜在靶点导入DAVID数据库,从生物过程(BP)、细胞成分(CC)、分子功能(MF)3个层面对关键靶点进行不同生物学过程分析,依据P < 0.05列出13条GO功能富集分析结果。见表3、图3、图4。其中细胞成分主要有细胞外区域、细胞外间隙等,分子功能主要为蛋白同源二聚化活动、蛋白结合等,生物过程包括一氧化氮(NO)生物合成过程的正调控、药物反应、细胞迁移正调控等。
2.5 肉桂治疗LDH作用靶点的KEGG通路分析 对肉桂作用于LDH的8个关键靶点进行KEGG通路富集分析,确定了4条主要信号通路,主要与核转录因子-κB(NF-κB)、卵巢类固醇生成、脂肪细胞脂解的调节、含血清素的神经突触等信号通路相关,涉及代谢、炎症、免疫等多个方面。见表4。
2.6 构建肉桂“活性成分-作用靶点-通路”网络 采用Cytoscape软件建立肉桂“活性成分-靶点-通路”网络模型,9个成分,8个靶点,17条代谢通路间的关联关系见图5。肉桂所含效应成分与靶点间、靶点与作用通路间存在复杂的网络关系,其中蓝色表示肉桂效应成分,红色代表成分靶点,绿色代表作用通路。肉桂化学成分中油酸(oleic acid)可调节NF-κB、脂肪细胞脂解、突触集合、含血清素的神经突触、应对受伤等信号通路中的PTGS2、PLAU、GAP43、BDNF、SLC6A4、INS;靶点PTGS2与EIC、棕榈油酸(zoomaric acid)、石竹烯(caryophyllene)、荜澄茄油烯(Cubebene、Sativene)、石竹烯氧化物(Caryophyllene oxide)、α-雪松烯(alpha-cedrene)、油酸(oleic acid)等8个化学成分相对应。
3 讨 论
网络药理学可从多成分、多靶点层面预测药物作用于疾病的靶点和通路。本研究基于该方法探讨肉桂治疗LDH的作用机制,通过TCMSP、TCMID等平台查找肉桂活性成分、作用靶点,GenCards、OMIM等平台查找LDH疾病靶点,采用Cytoscape软件构建“成分-靶点”网络,并将成分-靶点和疾病-靶点映射所得的8个共同靶点输入至 DAVID 软件进行通路富集,并构建“成分-靶点-通路”三维网络模型。
结果表明,肉桂治疗LDH可能与细胞外区域、细胞外间隙、蛋白同源二聚化活动、正调控褐色脂肪细胞分化、细胞对三磷酸腺苷(ATP)的反应、NO生物合成过程的正调控、细胞迁移正调控等生物过程相关。这些生物过程与肉桂抗氧化、抗炎、抗菌和抗肿瘤等药理作用相一致[12]。KEGG通路富集中的4条代谢通路中,NF-κB信号通路与LDH关系最为密切。NF-κB是一种普遍存在于细胞质中的核转录因子,在细胞受到刺激时起着信号传递、诱导基因表达的作用[13]。因其参与并调节多种免疫反应、炎症反应及细胞增殖与凋亡,故NF-κB信号转导通路的异常激活,转录活性增强,并引起细胞间信号的级联放大效应,导致一系列疾病的发生[14]。近年来,NF-κB与椎间盘退变性疾病之间的联系成为研究热点,文献报道显示,椎间盘退变性疾病的发病过程中NF-κB信号通路得到激活,大量炎症因子(如TNF-α、IL-1、IL-6、IL-8)呈现高表达,进而导致LDH患者疼痛发生[15-16]。同样GO功能富集中,LDH与细胞对ATP反应生物过程关系密切,YAMAZAKI等[17]研究发现,人和兔椎间盘纤维环细胞受到振动刺激后可检测到ATP的释放,受振动负荷ATP有快速释放并可快速恢复到基础水平的现象,ATP可作为信号物质调节细胞反应,并可能激活基质破坏的生化通路。
在细胞对ATP反应生物过程及NF-κB信号通路中最为显著的靶点为PTGS2。PTGS2的表达与炎症反应有着密切关系,当细胞受到刺激时,PTGS2表达上调,影响花生四烯酸代谢产生多种前列腺素(PGs),引发疼痛和炎症反应[18]。KATO等[19]通过构建小鼠椎间盘突出模型研究椎间盘自发性再吸收,结果表明,PLAU在基質金属蛋白酶(MMPs)激活中发挥着关键作用,酶原形式存在的MMP-3和MMP-7被激活后发挥基质降解作用,引起椎间盘再吸收。罗继[20]通过免疫组织化学染色,比较了LDH细胞与正常椎间盘组织细胞中PLAU的表达情况,首次发现PLAU在人退变椎间盘组织中表达增高,在正常椎间盘组织中表达低,且PLAU与MMP-3在椎间盘的退变过程中呈正相关,这进一步为椎间盘退变的生物学修复和生物学治疗提供了理论依据。通过图5可以看出,NF-κB信号通路是LDH相关基因及肉桂靶蛋白共同参与的生物学通路,但它们作用的靶点却不尽相同,提示肉桂中的靶蛋白PTGS2、PLAU通过调控NF-κB信号通路对LDH发挥治疗作用。进一步的实验主要探讨NF-κB信号通路及其相关靶点(PTGS2、PLAU)在肉桂可能治疗LDH动物模型中的作用机制。
本研究利用网络药理学手段对肉桂治疗LDH的潜在靶点进行预测,探讨肉桂治疗LDH可能涉及的生物学过程及信号通路,为今后在此研究结果基础上进一步开展肉桂治疗LDH的动物实验及临床试验提供参考和依据。但本研究也存在一定的局限性,如KEGG富集分析显示与卵巢类固醇生成、含血清素的神经突触等通路相关,尚缺研究报道,需后期进一步探讨。
参考文献
[1] KREINER DS,HWANG SW,EASA JE,et al.An evidence-based clinical guideline for the diagnosis and treatment of lumbar disc herniation with radiculopathy[J].Spine J,2014,14(1):180.
[2] HUANG W,HAN Z,LIU J,et al.Risk factors recurrent lumbar disc herination:a systematic revivew and meta-anaiysis[J].Medicine,2016,95(2):e2378
[3] GAO T,LAI Q,ZHOU S,et al.Correlation between facet tropism and lumbar degenerative disease[J].BMC Musculosket Disord,2017,18(1):483.
[4] 莫偉,许海金,叶洁,等.腰椎间盘突出症中医治疗方法的研究进展[J].中国中医急症,2016,25(3):474-476.
[5] 曹盼举,于海洋,张晓刚,等.腰椎间盘突出症的中医病因病机及其治疗思考[J].中医药临床杂志,2018,30(11):1999-2002.
[6] 王洪伟,李长青,周跃.腰椎间盘突出症疼痛发生机制的研究进展[J].中国矫形外科杂志,2011,19(7):568-571.
[7] 陈旭,刘畅,马宁辉,等.肉桂的化学成分、药理作用及综合应用研究进展[J].中国药房,2018,29(18):2581-2584.
[8] 李冰涛,章辉,肖思雨,等.基于网络药理学的葛根治疗冠心病作用机制研究[J].中国中医药信息杂志,2019,26(10):96-100.
[9] XU X,ZHANG W,HUANG C,et al.A novel chemometric method for the prediction of human oral bioavailability[J].Int J Mol Sci,2012,13(6):6964-6982.
[10] 孙凯,魏戌,朱立国,等.“杜仲-牛膝”药对治疗腰痛机制的网络药理学探讨[J].中药新药与临床药理,2019,30(8):935-942.
[11] 孙凯,朱立国,魏戌,等.基于网络药理学的“淫羊藿-白芍”配伍治疗腰椎间盘突出症作用机制研究[J].中国中药杂志,2020,45(3):609-616.
[12] 邓淑蓉,潘宇政.肉桂主要化学成分及药理作用研究概况[J].现代中西医结合杂志,2018,27(4):448-451.
[13] CHATTERJEE A,CHANG X,SEN T,et al.Regulation of p53 family member isoform DeltaNp63 alpha by the nuclear factor-kappa B targeting kinase IkappaB kinase beta[J].Cancer Res,2010,70(4):1419-1429.
[14] 谭伟伟.基于NF-κB信号通路探讨腰突颗粒治疗腰椎间盘突出症的机制[D].合肥:安徽中医药大学,2016.
[15] 谭旭仪,仇杰,仇湘中,等.补肝健腰方对腰椎间盘突出大鼠NF-κB信号通路的影响[J].中医药导报,2019,25(10):37-39.
[16] 易威威,温亚枫,刘浠,等.NF-κB抑制剂对脂多糖刺激的退变人椎间盘髓核细胞炎症因子表达的影响[J].第三军医大学学报,2017,39(8):755-759.
[17] YAMAZAKI S,WEINHOLD PS,GRAFF RD,et al.Annulus cells release ATP in response to vibratory loading in vitro[J].J Cell Biochem,2003,90(4):812-818.
[18] FRUNGIERI MB,WEIDINGER S,MEINEKE V,et al.
Prolifera-tive action of mast-cell tryptase is mediated by PAR2,COX2,prostaglandins,and PPARgamma:possible rele-vance to human fibrotic disorders[J].Proc Natl Acad Sci USA,2002,99(23):15072-15077.
[19] KATO T,HARO H,KOMORI H,et al.Sequential dynamics of inflammatory cytokine,angiogenesis inducing factor and matrix degrading enzymes during spontaneous resorption of the hemiated disc[J].J Orthop Res,2004,22(4):895-900.
[20] 罗继.尿激酶型纤溶酶原激活剂、基质金属蛋白酶-3在退变腰椎间盘中的表达研究及生物学意义[D].长沙:中南大学,2007.
收稿日期:2020-08-15;修回日期:2020-09-18
基金项目:国家自然科学基金(81960832);甘肃省中医药防治慢性疾病重点实验室开放基金项目(GSMBKY2015-07)
作者单位:1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃中医药大学附属医院,甘肃 兰州 730020
通信作者:宋敏 甘肃省兰州市和平开发区中医大道1号,sm@gszy.edu.cn,(0931)8765377