胸膜孤立性纤维瘤诊疗的研究进展
刘万立 洪琼川
2.518116 广东 深圳,深圳市龙岗中心医院胸心外科
胸膜孤立性纤维瘤(Solitary fibrous tumors of the pleura, SFTP)是一种罕见的起源于胸膜间皮下多潜能干细胞的肿瘤。1767年Lieutaud首次描述了这种原发于胸膜的肿瘤。1870年Wagner首先提出这种肿瘤来源于胸膜淋巴管内皮的理论。关于这种肿瘤的发病机理和分类的科学争论一直到1924年仍然存在。1931年Klemperer 和Rabin 提出将胸膜原发肿瘤分为两种类别的理论,即局灶性和弥漫性病变。他们发现局灶性肿瘤起源于间皮的多潜能干细胞,弥漫性肿瘤起源于胸膜下细胞。两种组织起源的理论开创了胸膜肿瘤起源的二元论。1960年,Foster和Ackerman的研究证实了这类肿瘤的组织学特点和大体结构变异较大[1]。目前被普遍接受的观点是胸膜孤立性纤维瘤起源于间皮下组织的一种树突状间质细胞,最常见的免疫组化表现是CD34阳性,具有向肌纤维母细胞、周细胞、血管内皮细胞等多向分化的特点[2]。SFTP表现出广泛的生物学行为,大部分的SFTP为良性、交界性,有10%~20%为恶性。2015年的WHO胸膜肿瘤分类将恶性胸膜孤立性纤维瘤(Malignant Solitary fibrous tumors of the pleura, MSFTP)单独进行分类并描述其病理学特征[3]。随着病例报道与相关研究的增多,人们对于SFTP的认识逐渐加深,本文就胸膜孤立性纤维瘤的临床表现、诊断与治疗、预后与随访等方面的研究进行综述。
临床特征
一、临床表现
胸膜孤立性纤维瘤发病率大约1.4例/百万人,恶性率大约在13%~37%。占所有胸膜肿瘤的5%,其中80%来源于脏层胸膜,20%位于壁层胸膜。发病年龄从5~87岁,多发于50~70岁,在既往的病例报告中大多数的患者没有明显的临床症状。多数病例是在常规行胸部X线检查、胸部CT检查时发现胸腔占位。病例报道中的临床症状包括有胸痛、呼吸困难、咳嗽、发热、体重下降等[4]。此外还有肿瘤引起的副肿瘤综合征(paraneoplastic syndrome, PS)包括低血糖和肺性肥大性骨关节病[5]。Doege和Potter于1930年首次报告该病导致低血糖的发生,由胸膜孤立性纤维瘤导致的低血糖称为Doege-Potter综合征(Doege-Potter Syndrome, DPS),发病率在3%~4%左右。目前研究认为DPS的发生主要与肿瘤产生的IGF-2(Insulin-like growth factor 2)有关[6]。此外也有胸膜孤立性纤维瘤分泌β-hCG的病例报道[7]。
二、影像学特征
胸部X线对胸膜孤立性纤维瘤的定性、定位诊断价值有限且无相关的文献报道,并且对于行胸部X线检查发现的胸腔占位,多需要胸部CT进一步检查。目前临床应用较多的是多层螺旋CT(Computed Tomographic),PET/CT(Integrated positron-emission tomography (PET)/computed tomographic (CT)),磁共振(Magnetic Resonance Imaging, MRI)。胸膜孤立性纤维瘤CT的表现可以概况为[8-9]:(1)大小形态:瘤体大小不等、差异较大,直径从1cm~33cm均有文献报道。形态多规则,部分见分叶状,平扫呈等或较高密度,密度均匀,部分可见钙化、坏死及囊变。少数可表现为明显带蒂病灶。(2)位置:肿瘤起源于胸膜,多向胸腔生长。直径较小的病灶与胸壁两侧呈锐角或者直角。直径较大的病灶多呈两侧锐角或一侧锐角、一侧直角,又称胸膜尾征。且有临近组织受压迫征像,如肺不张。(3)增强:肿瘤的强化与病灶大小、肿瘤细胞密集程度、成分以及血供有关。病灶较小多呈现均匀强化,病灶较大时多呈不均匀强化,可表现为具有特征性的结节斑片状、条片状不均匀显著强化。称之为“地图样”强化[9]。(4)鉴别诊断:SFTP需要与胸膜间皮瘤、肺部肿瘤、神经源性肿瘤相鉴别。有学者提出PET/CT作为功能性和形态学的影像学检查手段,可能为SFTP的诊断,分期和预测预后提供更多的参考依据。有报道[10]描述18F-FDG PET/CT在鉴别良恶性SFTP中的应用。由于样本量较小,仅提出CT联合PET/CT可能对于怀疑恶性SFTP的病人个性化治疗提供帮助。期待更多的研究去探索PET/CT在SFTP中的应用。由于MRI在胸部肿瘤中应用较少,关于SFTP的MRI表现报道也较少。具有特征性的是在T2WI上特征性的“假包膜征”[10]。虽然随着病例报道的增多,影像学检查对于SFTP的诊断率提高,但是同时也存在误诊、漏诊等情况。SFTP的诊断的金标准仍是术后病理结果。
病理学特征
一、大体形态特征
根据手术后切除病灶分析,SFTP的肿瘤病灶多呈纺锤形,大小不一,直径在1 cm~33 cm均有报道,直径大于15 cm通常称为巨大胸膜孤立性纤维瘤[11],质地中等,血供丰富,部分肿瘤可见完整的包膜,部分带蒂。切开肿瘤后可见灰色,白色或棕褐色切面,螺旋状,质硬,较大的病灶可见水肿、出血、钙化和坏死。部分肿瘤可见侵犯周围组织,如肺、胸壁、肋间神经、肌肉等[3]。
二、镜下特征
镜下SFTP肿瘤细胞最主要的特征就是“无特征(patternless pattern)”[12]。富集细胞区细胞排列杂乱,无明显规律,细胞形态多样,细胞多呈细长梭形。细胞核呈强嗜碱性,大小和形状变化较大,核多薄而细长,切面呈圆形或多边形,有中等量的异染色质。核仁很少突出。可见核分裂像,细胞质包含微丝和中等数量的粗内质网池。存在一些线粒体,偶可见脂质滴和少量的糖原颗粒[9]。寡细胞区细胞间质以大量的胶原纤维填充,多表现为玻璃样变性,表现为条索、黏液样、瘢痕样。有时由于病灶血管丰富,间质表现为杂乱的薄壁血管为主的血管外皮细胞瘤样分布[3]。据此,England等[12]认为:除外SFTP典型光镜下的特征外,提示恶性的组织学表现包括:(1)肿瘤细胞密集;(2)细胞多形性(pleomorphism);(3)核分裂像(mitotic figure)增多,大于4/10hpf;(4)肿瘤较大,具有坏死区和出血区。对于SFTPs的诊断,除了光镜下的典型表现外,辅以免疫组织化学染色也是至关重要的。
三、组织免疫及遗传学
SFTPs表达的免疫标志物主要包括:CD34(95%~100%),STAT-6(95%~100%),Bcl-2(94.3%~100%),Beta-catenin(77%~100%) ,Vimentin(100%) ,CD99(88.6%),P53(0~79.6%) ,Calretinin(0~13%) ,cytokeratin(0~3.5%),Ki67(0~2%)[13-15]等。其中CD34、 Bcl-2是目前用于诊断SFTP的一线免疫组织化学标志物,CD34(+)及 Bcl-2(+)是诊断SFTP的强有力依据。需要关注的是对于一些恶性或者去分化的SFTP病例可表现CD34缺失[16],而检测到细胞角蛋白(cytokeratin,CK)的表达。这种异常的免疫特性(CD34-/CK+)与肿瘤的恶性、预后差等有关,同时也需要与胸膜肉瘤样间皮瘤进行鉴别。随着研究的进展,通过对肿瘤基因序列分析发现孤立性纤维性肿瘤的特点是12号染色体基因重排(q13q13)-派生出NAB2-STAT6融合。通过基因检测NAB2-STAT6融合可以用来诊断SFTP。但是由于基因测序的成本较高、对技术设备要求高等原因并不能普及。近来研究人员通过免疫组织化学对STAT6检测已被证明是孤独性纤维瘤的一种高度敏感和特异的标记物并可代替基因测序分析的诊断价值[17-18]。STAT-6的表达率在95%~100%并且在CD34阴性的病例中仍可检测出[15]。因此STAT-6的检测对于一些不能明确诊断或者鉴别有困难的病例有较高的诊断价值。值得一提的是SFTP与血管外皮细胞瘤(hemangiopericytoma, HPC)是一种肿瘤的两种病变还是两种独立的疾病在学术上存在争议,在HPC中也同样检测到NAB2-STAT6融合[19]。免疫标志物在SFTP中的应用除了用于辅助诊断研究外,用于评估SFTP的预后是目前研究的热点。研究发现高P53、Ki67的表达的病例多为恶性肿瘤且预后差。除此之外,对于目前在肿瘤治疗中研究较多的受体酪氨酸蛋白激酶(Receptor tyrosine kinases, RTKs),如血小板衍生生长因子(PDGFR)和MET在部分SFTP中也可检测出来[14]。但是其在STFP中的诊断、治疗价值需要进一步研究。
治 疗
将病灶完整的手术切除是目前公认对于良性和恶性SFTP的首选治疗方式。外科切除病灶的病人远期生存率明显高于未行外科治疗的病人,手术要求完整切除病灶[20-21]。手术方式包括解剖切除、肺楔形切除、肺叶切除,手术入路包括传统的开胸手术和胸腔镜手术。外科治疗应根据肿瘤特征(大小、位置、总体形态)选择具体手术方式。胸腔镜手术较传统开胸手术相比,具有手术切口小、创伤小、术后恢复快等优点。Magdeleinat等[4]建议病灶直径<5cm时选择胸腔镜手术。Lococo等[22]认为对于肿瘤体积大、无蒂、周围组织侵犯、恶性病变的病例开胸手术仍然是标准的手术方式。最新观点认为,扩大切除没有必要,带蒂的肿瘤可以选择楔形切除术切除,而无蒂的肿瘤则需要解剖切除。无论采用哪种手术方式,建议1~2 cm的阴性切缘[23]。对于术后是否需要行辅助放化疗,目前没有共识。目前观点认为良性的SFTP术后无需行辅助治疗。而对于恶性的SFTP目前推荐行辅助化疗,特别是不能完全切除病灶以及复发的病例[20]。Veronesi等[24]报道复发的病例使用的异环磷酰胺+多柔比星后,病灶缩小。Park等[25]报道部分转移性或局部复发病例使用多柔比星,吉西他滨,紫杉醇可以有效控制和稳定病情。SFTP标准化的放化疗方案以及适应症需要进一步研究。此外也期待能发现特定的生物分子、蛋白等药物治疗靶点,为SFTP患者提供有用和新颖的治疗方法。
预后与随访
SFTP总体5年生存率为良性89%~96%,恶性46%~68%[26-28]。England等[12]描述了SFTP的组织学特征并提出良性SFTP切除后复发率在1.4%。一般肿瘤的治疗和预后都与肿瘤的分期密切相关,但是目前没有针对SFTP统一的分期系统。多年来,研究者提出了各种分类和风险分层模型,以在初次诊断时确定复发风险最高的患者,De Perrot等[29]在结合组织学和形态学特征后提出0~Ⅳ分期系统,发现Ⅲ期:恶性无蒂最有可能复发(63%),其次是Ⅱ期:恶性带蒂的(14%),Ⅰ期:良性无蒂(8%),0期:良性带蒂(2%)。Ⅳ定义为有多发远处转移。Bylicki等[30]证实了De Perrot分期系统的预后价值。得出0,Ⅰ,Ⅱ,Ⅲ和Ⅳ期复发率分别为3%,52%,71%和80%。为了更好评估术后复发风险,2013年Tapias等[31]结合了England标准和De Perrot分期提出Tapias评分系统(表1)。得分少于3分的患者在15年内无复发生存率100%,得3分及以上的患者在15年内复发率77%。后续验证研究表明,该评分的敏感性为78%,特异性为74%[32]。随着对SFTP认识的加深,发现免疫标志物与肿瘤的预后密切相关。如高P53表达,Ki-67表达的病例生物学行为多表现为恶性且预后较差[33]。而之前的分期和评分系统并未纳入SFTP的免疫标志物。2017年Diebold等[34]提出Diebold评分系统,并纳入了Ki-67进行评估。由于目前对SFTP的认识尚不足,影响其预后的因素还需进一步研究,如NAB2-STAT6基因不同融合类型与预后的关系。就目前所提出的评分、危险分层系统中没有一个被普遍认可的系统。Bellini等[35]进行比较后提出使用Tapias评分系统评估术后复发风险是较为可靠的。由于SFTP在手术切除后容易复发,所以建议术后可通过目前的评分系统制定个体化的随访计划。建议密切随访最长可达到10年。
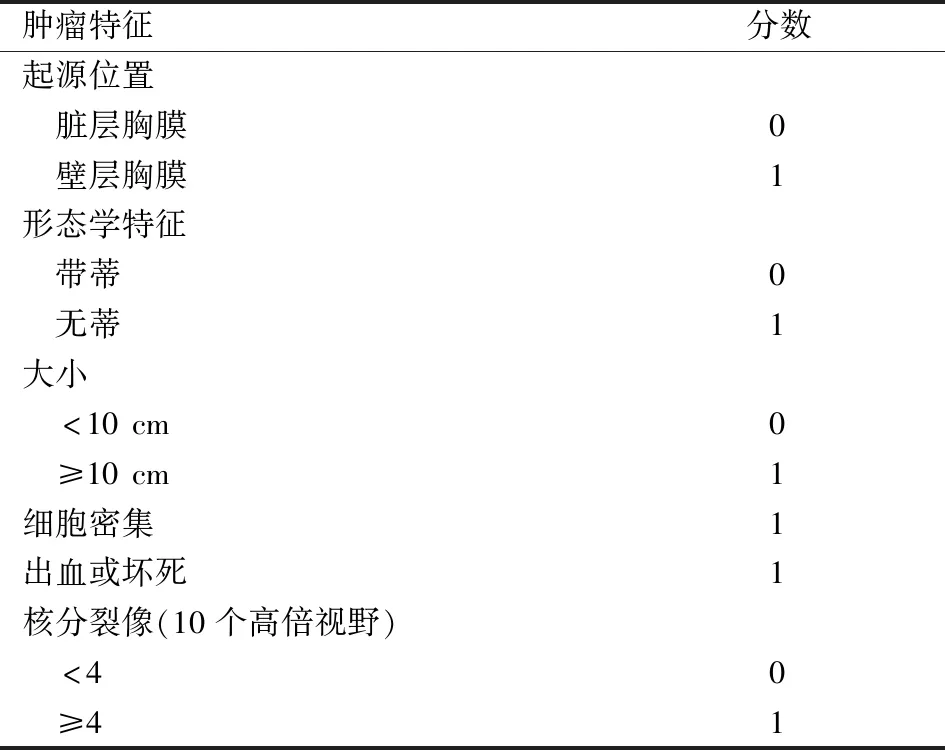
表1 预测SFTP术后复发的Tapias评分系统[31]
总结和展望
SFTP是一种罕见的胸膜肿瘤,具有容易复发、转移等特点。随着病例报道的增加以及研究的深入,对其临床表现、生物学行为已有了一定认识。但是目前仍然有很多问题待解决。
首先应提出更为规范的诊断标准,特别是对于恶性SFTP;其次应进一步明确NAB2-STAT6基因不同位点融合与肿瘤的生物学行为、预后之间的关系以指导临床治疗;最后在治疗方面,应提出统一的,能指导临床治疗抉择的标准分期系统,明确辅助放化疗在SFTP中的适应症以及标准放化疗方案,同时寻找药物治疗靶点,为SFTP患者提供标准化、个体化的治疗方案。

