茄褐纹病菌的生物学特性及其防治药剂室内毒力强度
叶 莹,曾怡林,虞凡霜,张凯东,强 遥,蒋军喜
(江西农业大学 农学院,江西 南昌 330045)
0 引言
【研究意义】茄子褐纹病是国内外茄子生产上的一种重要病害[1],近年来在江西省南昌市普遍发生,给当地茄子生产造成严重经济损失。【前人研究进展】该病由半知菌类真菌茄褐纹拟茎点霉(Phomopsisvexans),有性世代为子囊菌门间座壳属茄褐纹间座壳(Diaporthevexans)侵染所致[2],主要危害茄子叶片、枝干和果实,常引起叶斑、枝枯和果腐等症状,以果腐损失最大[3-4]。自1892年HALSTED报道茄子褐纹病后,世界各地茄子栽培地区均有该病的研究报道,国内外学者关于茄子褐纹病的研究主要集中在病原菌鉴定、致病机制、抗性遗传及抗病品种筛选等方面[5-9]。目前,仅有吴仁锋等[10]对武汉地区茄褐纹病菌的培养性状进行相关研究,而对于茄子褐纹病菌的药剂筛选仅有湖南、山东及安徽等地开展室内毒力测定。【研究切入点】与其他地区相比,南昌市茄褐纹病的研究还不够深入和系统,有关病原菌生物学特性和药剂筛选方面的报道还很少见。【拟解决的关键问题】鉴于此,开展南昌地区茄褐纹病菌生物学特性及其防治药剂室内毒力研究,以期为该病的药剂防治提供科学依据。
1 材料和方法
1.1 材料
1.1.1 菌株 供试菌株H1由江西农业大学植物病理学实验室于2020年7月从南昌市郊茄褐纹病病叶中分离所得,经形态学和分子生物学鉴定确定为茄褐纹病菌(Phomopsisvexans),并经致病性测定为强致病力菌株。该菌株用琼脂培养基(PCA)斜面保存于4℃冰箱,试验前在马铃薯葡萄糖琼脂培养基(PDA)平板上活化。
1.1.2 培养基 试验共选取8种培养基作为供试培养基,即茄叶煎汁培养基、PDA、马铃薯蔗糖琼脂培养基(PSA)、燕麦片培养基(OMA)、玉米片培养基(CMA)、胡萝卜培养基(CA)、水琼脂培养基(WA)和查氏培养基(Czapek),各培养基参照文献[11]的方法配制。
1.1.3 药剂 供试药剂共8种,具体信息见表1。

表1 8种供试药剂的基本情况Table 1 Eight fungicides used in the experiment
1.2 方法
1.2.1 试验设计
1) 病原菌生物学特性测定。采用单因素试验设计设置不同温度、pH、光照条件、培养基、碳源和氮源等培养条件,测定茄褐纹病菌在不同条件下的生长状况,以筛选其最适生长条件。在PDA平板上培养3 d的菌落边缘打取直径5 mm的菌饼,将菌饼接种在平板培养基的中央,按设置的不同条件培养,3次重复。试验条件:温度,将菌饼接种于PDA平板中央,分别放置于5℃、10℃、15℃、20℃、25℃、30℃和35℃的恒温培养箱中黑暗培养;pH,将菌饼接种在用1 mol/L HCl和1 mol/L NaOH调配的pH分别为3、4、5、6、7、8、9、10、11、12和13的PDA平板上,25℃全黑暗培养[12-13];光照条件,将接种的PDA平板分别置于24 h黑暗、12 h光暗交替和24 h光照条件下25℃培养[14];培养基,将菌饼分别接种于PDA、PSA、OMA、CMA、CA、WA、Czapek和茄叶煎汁培养基共8种培养基上,25℃全黑暗培养;碳源,以Czapek培养基为基础培养基,用葡萄糖、纤维二糖、α-乳糖、麦芽糖、甘露醇、山梨醇和可溶性淀粉取代Czapek培养基中的蔗糖,配置成8种不同的碳源培养基[15],将菌饼分别接种于8种不同碳源的培养基上25℃全黑暗培养;氮源,以Czapek培养基为基础培养基,用硝酸钾、磷酸二氢铵、牛肉膏、蛋白胨、酵母膏、硝酸铵和氯化铵取代Czapek培养基中的硝酸钠,配置成8种不同的氮源培养基[15],将菌饼分别接种于8种不同的氮源培养基上25℃全黑暗培养。
2) 病原菌室内毒力测定。采用菌丝生长速率法[16]测定8种药剂对菌株H1的毒力,在预实验的基础上,先将各药剂按其有效成分分别稀释为9个质量浓度梯度。各药剂分别与PDA培养基按1∶9混合均匀后倒入灭菌的培养皿中,制成浓度为1×103μg/mL、2.5×102μg/mL、6.3×101μg/mL、1.6×101μg/mL、3.9×100μg/mL、1×100μg/mL、2.4×10-1μg/mL、6.1×10-2μg/mL和1.5×10-2μg/mL的含药平板,同时以等量的无菌水代替药液制作对照平板。将直径5 mm的适龄菌饼接种于不同浓度梯度的含药和对照平板中央,3次重复,25℃恒温培养箱中黑暗培养。
1.2.2 指标测定 接种培养6 d后,采用“十字交叉法”[12]测量菌落直径,计算菌丝生长速率并根据菌丝生长速率大小判断生长条件优劣;以药剂浓度的对数为自变量(x),相对抑制率的概率值为因变量(y),拟合8种杀菌剂对茄褐纹拟茎点霉的独立回归方程,计算各药剂的抑菌率、抑制中质量浓度(EC50)及相关系数(R),根据EC50判断各药剂的毒力大小,即药剂的EC50越小,其对病原菌毒力越强[17]。
菌丝生长速率=(菌落生长直径-菌饼直径)/菌落培养天数
抑菌率=(对照组净菌落直径-处理组净菌落直径)/对照组净菌落直径×100%
1.3 数据处理与分析
利用SPSS 22和Excel 2010对数据进行统计与分析。
2 结果与分析
2.1 病原菌生物学特性研究
从图1看出,病原菌P.vexans在不同温度、pH、光照条件、培养基、碳源和氮源等培养条件下生长速率存在差异。
2.1.1 温度 病原菌P.vexans在10~30℃条件下均能生长,随着温度升高菌丝生长速度呈先升后降趋势,生长速率依次为 25℃>20℃>30℃>15℃>35℃>10℃>5℃。各处理间均存在显著差异,其中,5℃停止生长,≥35℃几乎不生长,25℃时菌丝生长最快,生长速率达11.06 mm/d。表明,该菌的最适生长温度为25℃。
2.1.2 pH 病原菌P.vexans在pH为3~12时均能生长,随着pH增大菌丝生长速度呈先升后降趋势,生长速率依次为6>5>4=7>8>9>10>3>11>12>13。其中,pH 13时停止生长,pH 4~7时适宜病菌生长,pH 6时菌丝生长最快,达12.50 mm/d,显著高于其余处理,pH 4和pH 7时病菌的生长速率相等。表明,病原菌P.vexans生长最适pH为6,喜偏酸性环境。
2.1.3 光照条件 病原菌P.vexans在连续黑暗、光暗交替和连续光照3种光照条件下均能生长,其生长速率分别为11.00 mm/d、10.92 mm/d和9.36 mm/d,各处理间均存在显著差异,其中,在连续黑暗条件下生长速率最快,显著高于其余2个处理,光暗交替下的生长速率显著高于连续光照。表明,黑暗条件更有利于病原菌P.vexans的菌丝生长。
2.1.4 培养基 病原菌P.vexans在8种不同培养基上均能生长,生长速率为5.06~12.36 mm/d,依次为马铃薯蔗糖琼脂培养基>马铃薯葡萄糖琼脂培养基>胡萝卜培养基>燕麦片培养基>玉米片培养基>茄叶煎汁培养基>查氏培养基>水琼脂培养基,各处理间均存在差异。病原菌在PSA培养基上生长速率最快,菌丝发达,生长速率达12.36 mm/d,其次为PDA、CA、OMA、CMA和茄叶煎汁培养基,生长速率分别为11.63 mm/d、11.08 mm/d、10.44 mm/d、9.44 mm/d和8.25 mm/d,在Czapek培养基和WA培养基上生长速率最缓慢,且菌丝极不发达,不适合该病原菌生长。
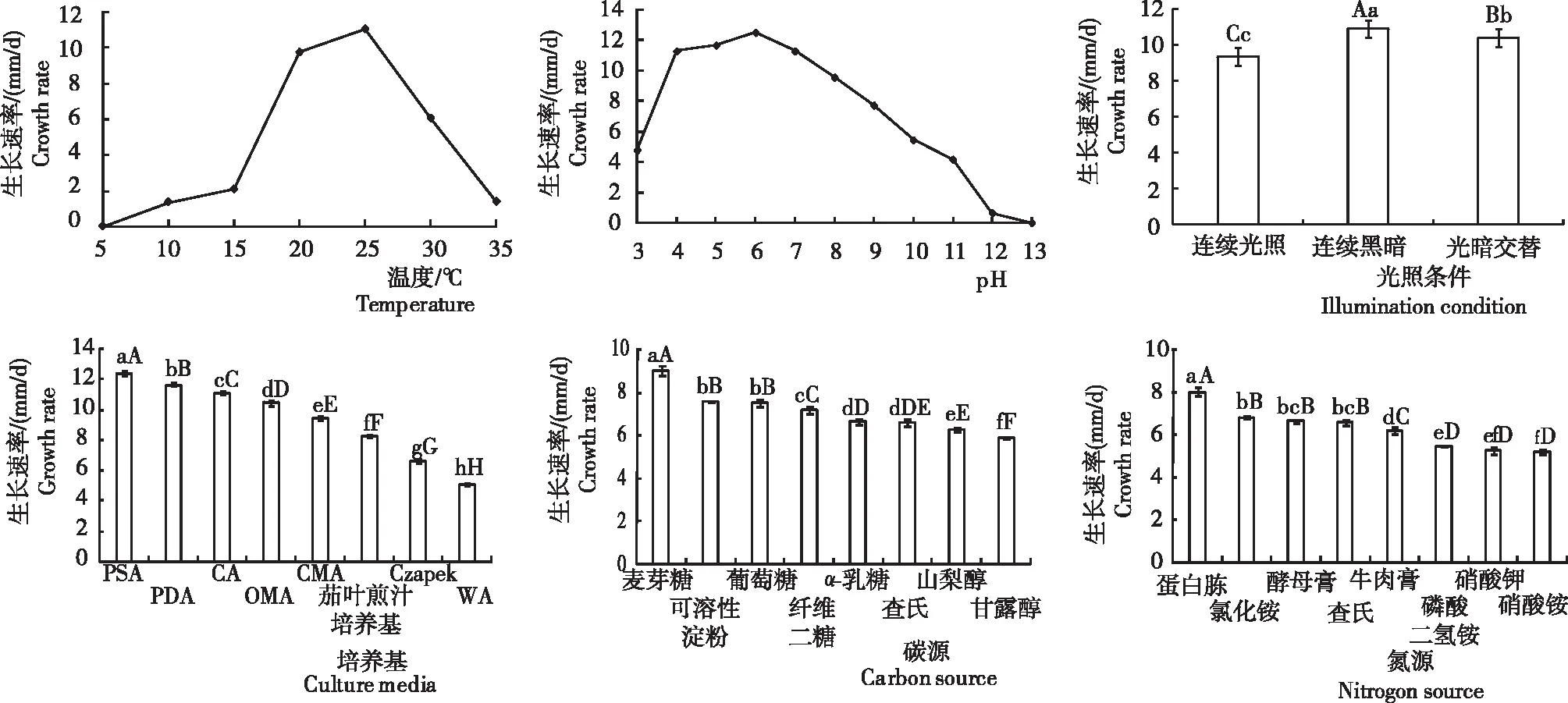
注:不同大小写字母分别表示差异达极显著(P<0.01)和显著水平(P<0.05)。Note:Different capital and lowercase letters indicate significance of difference at P<0.01 and P<0.05 level.图1 不同温度、pH、光照条件、培养基、碳源和氮源处理病原菌菌丝的生长速率Fig.1 Growth rate of pathogen mycelium treated with different temperature, pH, light condition, culture media, carbon source and nitrogen source
2.1.5 碳源 病原菌P.vexan在8种供试碳源培养基上均能生长,生长速率为5.86~9.00 mm/d,依次为麦芽糖>可溶性淀粉>葡萄糖>纤维二糖>α-乳糖>查氏>甘露醇,各处理间存在显著差异。其中,在以麦芽糖为碳源的平板上生长最快,菌丝生长速率达9.00 mm/d,极显著高于其余处理;其次是可溶性淀粉和葡萄糖,分别为7.55 mm/d和7.50 mm/d,二者差异不显著,但均极显著高于其余处理;在以甘露醇为碳源的平板上生长最慢,其菌丝生长速率仅为5.86 mm/d,显著低于其余处理。表明,麦芽糖为病原菌P.vexan最适生长碳源。
2.1.6 氮源 病原菌P.vexan在8种供试氮源培养基上均能生长,生长速率为5.19~8.03 mm/d,依次为蛋白胨>氯化铵>酵母膏>查氏>牛肉膏>磷酸二氢铵>硝酸钾>硝酸铵,处理间存在显著或极显著差异。其中,蛋白胨平板上菌丝生长最快,生长速率达8.03 mm/d,极显著高于其余处理;其次是氯化铵和酵母膏,分别为6.83 mm/d和6.64 mm/d,二者差异不显著,但均极显著高于除查氏外的其余处理;氯化铵为氮源的菌丝生长速率显著高于查氏;硝酸铵平板上菌丝生长最慢,生长速率仅为5.19 mm/d。表明,蛋白胨为病原菌P.vexan最适生长氮源。
2.2 8种杀菌剂对病原菌的室内毒力
2.2.1 毒力回归方程 从表2看出,通过拟合得到8种杀菌剂对茄褐纹病病原菌P.vexan的毒力回归方程:y40%氟硅唑=0.381x+1.719(R=0.944),y15%三唑酮=0.328x+0.500(R=0.993),y70%丙森锌=0.586x+0.996(R=0.938),y50%戊唑醇·25%嘧菌酯=1.268x+1.445(R=0.915),y70%甲基硫菌灵=1.283x+1.146(R=0.934),y43%戊唑醇=1.769x+1.463(R=0.977),y50%异菌脲=1.281x+0.791(R=0.949),y40%嘧霉胺=1.265x-1.144(R=0.926),相关系数R均>0.9,表明,各药剂浓度与抑制率间存在良好的线性关系。

表2 8种杀菌剂对茄褐纹病菌的室内毒力强度Table 2 Indoor virulence intensity of eight fungicides against P. vexans
2.2.2 毒力强度 从表5看出,各药剂的EC50为0.012~8.013 μg/mL,依次为40%氟硅唑<15%三唑酮<70%丙森锌<50%戊唑醇·25%嘧菌酯<70%甲基硫菌灵<43%戊唑醇<50%异菌脲<40%嘧霉胺,表明,40%氟硅唑对病原菌的抑制效果最好,EC50为0.012 μg/mL;其次是15%三唑酮、70%丙森锌和50%戊唑醇·25%嘧菌酯,EC50分别为0.02 μg/mL、0.03 μg/mL和0.072 μg/mL,均<0.10 μg/mL;40%嘧霉胺抑制效果相对最差,EC50为8.013 μg/mL。
3 讨论
吴仁锋等[10]研究武汉市茄褐纹病菌生物学特性发现,菌丝生长最适温度为30℃,最适培养基为PDA,最适pH为6,最适光照条件为24 h全光照,最佳碳源和氮源分别为麦芽糖和硝酸钠。与该研究结果存在明显差异,表明,茄褐纹病菌内部存在较明显的生理分化现象。该生理分化现象是否与茄褐纹病菌致病性有关有待进一步研究。马珂[18]筛选到咪鲜胺、扑海因和甲基硫菌灵等对安徽和县茄褐纹病菌毒力较高的药剂;王姝玮等[19]筛选到咪鲜胺、甲基硫菌灵和苯醚甲环唑等对湖南新化茄褐纹病菌表现高效的药剂;李艳青等[20]研究表明,多菌灵对山东寿光茄褐纹病菌具有强毒力。由于药剂在田间的实际防效受寄主、病原和环境条件等特性及相互关系的影响,因此,该研究筛选出的氟硅唑、三唑酮、丙森锌、戊唑醇·嘧菌酯、甲基硫菌灵、戊唑醇和异菌脲等7种杀菌剂对南昌市茄褐纹病菌的防效还有待进一步的田间药效试验进行验证,以确定真正有效的药剂种类和使用浓度。
4 结论
研究结果表明,该菌生长最适温度为25℃,最适pH为6,全黑暗条件下菌丝生长速率最快,最适培养基为PSA,最佳碳源和氮源分别为麦芽糖和蛋白胨。氟硅唑、三唑酮、丙森锌、戊唑醇·嘧菌酯、甲基硫菌灵、戊唑醇和异菌脲7种杀菌剂对南昌市茄褐纹病菌均具有强毒力,嘧霉胺的毒力则较弱,可推荐前7种杀菌剂在当地生产上防控茄褐纹病使用。该研究为茄褐纹病发病规律研究奠定了一定的基础,同时,上述药剂可为今后开展田间药效试验提供参考。

